Un protocole simple et efficace pour l'insertion catalytique Polymérisation de norbornènes fonctionnels
Summary
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Abstract
Norbornène peut être polymérisé par une variété de mécanismes, y compris la polymérisation par insertion selon laquelle la double liaison est polymérisé et la nature du monomère bicyclique est conservée. Le polymère, polynorbornène résultant, a une très haute température de transition vitreuse, T g, et les propriétés optiques et électriques intéressantes. Cependant, la polymérisation des norbornènes fonctionnels par ce mécanisme est compliqué par le fait que le monomère de norbornène endo substitué a en général une très faible réactivité. En outre, la séparation du monomère endo substitué à partir du monomère exo est une tâche fastidieuse. Ici, nous présentons un protocole simple pour la polymérisation des norbornènes substitués (endo: exo ca. 80:20) portant soit un acide carboxylique ou une double liaison pendentif. Le procédé ne nécessite pas que les deux isomères séparés, et procède à des charges catalytiques faibles (0,01 à 0,02% en mole). Les Pend polymères portantdoubles liaisons fourmis peuvent encore être transformées avec un rendement élevé, pour obtenir un polymère portant des groupes époxy pendants. Ces procédures simples peuvent être utilisés pour préparer les polynorbornènes avec une variété de groupes fonctionnels, tels que des esters, des alcools, des imides, des doubles liaisons, des acides carboxyliques, des groupes alkyles bromés, les aldéhydes et les anhydrides.
Introduction
Norbornène, le BNE, le produit d' addition de Diels-Alder de l' éthylène et du cyclopentadiène (obtenu par «craquage» du dicyclopentadiène (DCPD)), est facilement polymérisé en utilisant soit une polymérisation radicalaire, une polymérisation cationique, 2 à ouverture de cycle métathèse polymérisation 3 et l' insertion catalytique polymérisation. 4, 5, 6, 7 Contrairement aux autres dispositifs, la polymérisation catalytique d'insertion conduit à la formation d'une très haute température de transition vitreuse (T g) de polymère dans lequel le squelette bicyclique de NBE est conservée. Une variété de catalyseurs tels que des catalyseurs à base de métallocènes et de transition tardive de catalyseurs métalliques peuvent être utilisés pour favoriser la polymérisation de NBE. 4, 5, 6, <sup class = "xref"> 7 Toutefois, en raison de sa faible solubilité et en raison de difficultés liées au traitement d'un polymère très élevé T g, l'homopolymère PNBE a, à notre connaissance, n'a jamais trouvé d'emploi.
Polynorbornènes fonctionnels (PNBEs) ont fait l'objet d' une attention considérable au cours des 20 dernières années, car ils combinent la Tg élevée transmise par l'unité de répétition rigide bicyclique, ainsi que des propriétés souhaitables dotés par leurs fonctionnalités. 8, 9, 10 NBE monomères sont obtenus à partir des charges d' alimentation plutôt simples et peu coûteuses, en utilisant une réaction en une seule étape de Diels-Alder entre le cyclopentadiène et le diénophile fonctionnalisée. Cependant, la réaction de Diels-Alder conduit à deux stéréoisomères endo et exo, qui ont des réactivités très différentes. 11 12 En fait, la stéréo endoisomère est moins réactif que forme exo et désactive le catalyseur. 11 12 Ainsi, dans le passé, la préparation des polynorbornènes fonctionnels habituellement nécessaire la séparation des stéréo – isomères endo et exo, et seul le stéréoisomère exo- a été utilisé. Une telle procédure de séparation était temps, et a conduit à l'accumulation de stéréoisomères endo ne ayant pas réagi comme déchets indésirables.
Récemment, nous avons montré que la polymérisation de NBES fonctionnalisés contenant les deux stéréoisomères est en effet possible. 13 Nous avons ainsi pu préparer divers PNBEs substitués, contenant des groupes fonctionnels tels que les esters, les anhydrides, les aldéhydes, les imides, les alcools et les doubles liaisons. En raison de leur T g et la fonctionnalité élevée, ces polymères présentent des propriétés souhaitables. Nous décrivons ici deux méthodes pour préparer des polymères fonctionnels. Le premier conduit àla synthèse du poly polymère hydrosoluble (acide 5-norbornène-2-carboxylique), PNBE (CO 2 H), en utilisant un catalyseur au palladium cationique (figure 1). 13 14 Le même procédé de polymérisation peut être utilisé pour préparer PNBEs fonctionnels avec différentes fonctionnalités pendantes, tels que les esters, les alcools, les imides, les bromo-alkyle, les aldéhydes et les anhydrides. Dans nos mains, ce catalyseur au palladium cationique ne peut pas être utilisé pour des suspensions NBES contenant des doubles liaisons, tels que le 5-vinyl-2-norbornène. Dans ce cas, une insertion partielle de la double liaison de la suspension lors de la polymérisation conduit à la formation d'un matériau réticulé. Par conséquent, nous présentons une seconde méthode dédiée à la formation de poly (5-vinyl-2-norbornène), PNBE (vinyle), en utilisant du Pd 2 (dba) 3: AgSbF 6: PPh 3 en tant que catalyseur in situ. 14 Les groupes vinyle pendants du polymère sont ensuite époxydes, de conduire à thla formation d'e de l' PNBE (époxy) (figure 1). Les deux PNBE (CO 2 H) et PNBE (époxy) ont été trouvés pour conduire à la formation de résines thermodurcissables avec un T g aussi élevée que 350 ° C. 14 Ainsi, la méthode simple décrite ici permet de préparer efficacement des polymères ayant une Tg très élevée et ayant une variété de groupes fonctionnels qui peuvent être utilisés pour de nombreuses applications.
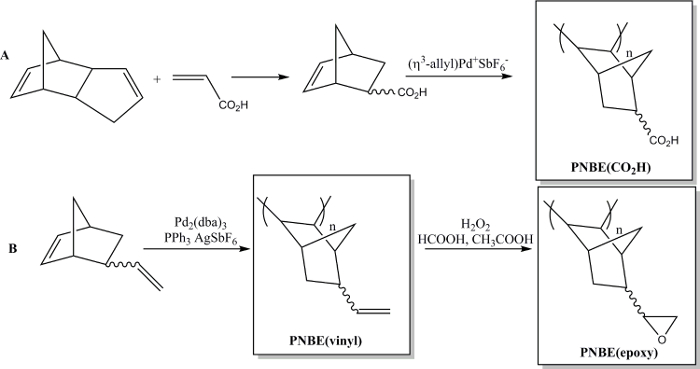
Figure 1: PNBEs fonctionnels préparés par Pd polymérisation catalysée. (A) préparation de PNBE (CO 2 H), (B) préparation de PNBE (vinyle) et PNBE (époxy). La liaison en pointillés indique un mélange d'isomères endo et exo. S'il vous plaît cliquer ici pour voir une version plus grande de cette figurer.
Protocol
Representative Results
Discussion
La méthode proposée ici est simple, et facilement prête à plus grande échelle. Tous les produits chimiques peuvent être utilisés tels que reçus sans autre purification. Notez que l' exécution de la réaction à une échelle inférieure (par exemple des échelles ≤1 g) , on obtient généralement des rendements plus faibles en raison d'une perte inévitable de matériel lors de la manipulation et de la collection.
Les catalyseurs sont formés in situ lors …
Divulgations
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge funding from Fonds de Recherche du Québec – Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Materials
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
References
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B., Rieger, B., Baugh, L., Kacker, S., Striegler, S. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. , 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. . The Synthetic Organic Chemist’s Companion. , (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. . Advanced functional materials, Chapter 1.6.8,30. 1, (2011).
- Kim, D. -. G., Bell, A., Register, R. a. Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S., Intech, S. i. l. a. g. u. i. ,. M. .. A. .. ,. e. d. .. ,. Low Dielectric Materials for Microelectronics. Dielectric Material. , 59-76 (2012).

