En enkel och effektiv protokoll för katalytisk Insertion polymerisation av funktionella norbornener
Summary
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Abstract
Norbomen kan polymeriseras genom en mängd olika mekanismer, inklusive införings polymerisation varvid dubbelbindningen är polymeriserad och den bicykliska naturen av monomeren är konserverad. Den resulterande polymeren, polynorbornen, har en mycket hög glasövergångstemperatur, Tg, och intressanta optiska och elektriska egenskaper. Emellertid är polymerisationen av funktionella norbornener genom denna mekanism kompliceras av det faktum att den endo substituerad norbomen-monomeren har i allmänhet en mycket låg reaktivitet. Dessutom är separationen av endo substituerade monomeren från exo monomeren en mödosam uppgift. Här presenterar vi ett enkelt protokoll för polymerisation av substituerade norbomener (endo: exo ca 80:20) bär antingen en karboxylsyra eller en hängande dubbelbindning. Processen kräver inte att de båda isomerer separeras, och fortsätter med låga katalysatorbelastningar (0,01-0,02 mol%). Polymerbärande pendant dubbelbindningar kan omvandlas ytterligare i högt utbyte, för att ge en polymer bärande hängande epoxigrupper. Dessa enkla förfaranden kan tillämpas för att förbereda polynorbornenes med en mängd olika funktionella grupper, såsom estrar, alkoholer, imider, dubbelbindningar, karboxylsyror, brom-alkyler, aldehyder och anhydrider.
Introduction
Norbornen, NBE, Diels-Alder-addukt av etylen och cyklopentadien (erhållen genom "krackning" av dicyklopentadien (DCPD)), kan lätt polymeriseras med användning av antingen fri-radikal-polymerisation, en katjonisk polymerisation, två ringöppnande metatespolymerisation 3 och katalytisk införing polymerisation. 4, 5, 6, 7 Till skillnad från de andra mekanismer, leder den katalytiska ings polymerisation till bildandet av en mycket hög glasövergångstemperatur (Tg) polymer varvid den bicykliska ryggraden i NBE är konserverad. En mängd olika katalysatorer, såsom metallocenkatalysatorer och sena övergångsmetallkatalysatorer kan användas för att främja polymerisationen av NBE. 4, 5, 6, <sup class = "xref"> 7 På grund av dess låga löslighet och på grund av svårigheter i samband med behandlingen av en mycket hög Tg polymer, den PNBE homopolymeren har, så vitt vi vet, aldrig funnit någon användning.
Funktionella polynorbornenes (PNBEs) har varit föremål för betydande kontroll för de senaste 20 åren, eftersom de kombinerar den höga Tg förmedlas av den bicykliska stela upprepningsenhet samt önskvärda egenskaper utrustade med sina funktioner. 8, 9, 10 NBE monomerer erhålls från ganska enkla och billiga utgångsmaterial, med användning av en en-stegs Diels-Alder-reaktion mellan cyklopentadien och en funktionaliserad dienofil. Leder emellertid Diels-Alder-reaktion till två stereoisomerer, endo- och exo, som har mycket olika reaktiviteter. 11, 12 I själva verket, den endo stereoisomeren är mindre reaktiv än exo formen och deaktiverar katalysatorn. 11, 12 Således, i det förflutna, vid framställning av funktionella polynorbornenes krävs vanligtvis separationen av endo- och exo-stereoisomerer, och endast exo stereoisomer användes. Ett sådant förfarande separation var tidsödande, och ledde till ackumulering av oreagerade Endo stereoisomerer som oönskat avfall.
vi har nyligen visat att polymerisationen av funktionaliserade NBEs innehåller båda stereoisomererna är i själva verket möjligt. 13 Vi har därmed kunnat förbereda en mängd substituerade PNBEs, som innehåller funktionella grupper, såsom estrar, anhydrider, aldehyder, imider, alkoholer och dubbelbindningar. På grund av deras höga Tg och funktionalitet, dessa polymerer visar önskvärda egenskaper. Vi beskriver här två metoder för framställning av funktionella polymerer. Den första leder tillsyntesen av den vattenlösliga polymeren poly (5-norbornen-2-karboxylsyra), PNBE (CO2H), med användning av en katjonisk Pd-katalysator (Figur 1). 13, 14 Samma polymerisationsmetod kan användas för framställning av funktionella PNBEs med olika vidhängande funktionaliteter, såsom estrar, alkoholer, imider, brom-alkyler, aldehyder och anhydrider. I våra händer, kan detta katjoniska Pd-katalysator inte användas för NBEs innehållande vidhängande dubbelbindningar, såsom 5-vinyl-2-norbornen. I detta fall, en partiell införing av hängande dubbelbindning under polymerisationen leder till bildning av ett tvärbundet material. Därför presenterar vi här en andra metod tillägnad bildningen av poly (5-vinyl-2-norbornen), PNBE (vinyl), med användning av Pd2 (dba) 3: AgSbF 6: PPh3 som en in situ-katalysator. 14 De hängande vinylgrupper i polymeren sedan epoxideras vidare, att leda till the bildandet av PNBE (epoxi) (Figur 1). Både PNBE (CO 2 H) och PNBE (epoxi) har befunnits leda till bildning av termoplastiska hartser med en Tg så hög som 350 ° C. 14 Sålunda, den enkla metod som beskrivs här gör det möjligt för en att effektivt framställa polymerer med en mycket hög Tg och med en mångfald funktionella grupper, vilka kan användas för många tillämpningar.
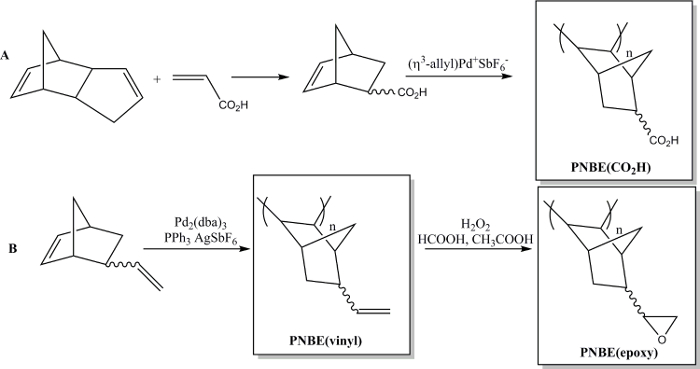
Figur 1: Funktionella PNBEs framställda genom Pd-katalyserad polymerisation. (A) beredning av PNBE (CO 2 H), (B) framställning av PNBE (vinyl) och PNBE (epoxi). Den streckade bindningen indikerar en blandning av endo- och exo-isomerer. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
Den här föreslagna metoden är enkel och lätt mottaglig för uppskalning. Alla kemikalier skulle kunna användas som mottas utan någon rening. Observera att utföra reaktionen vid en lägre skala (t.ex. vågar ≤1 g) vanligtvis ger lägre avkastning på grund av en oundviklig förlust av material under hanteringen och insamlingen.
Katalysatorerna bildas in situ på reaktionen av kommersiella Pd föreningar med katjoniserande medel. I våra händer, är utbytet av reakt…
Divulgations
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge funding from Fonds de Recherche du Québec – Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Materials
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
References
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B., Rieger, B., Baugh, L., Kacker, S., Striegler, S. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. , 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. . The Synthetic Organic Chemist’s Companion. , (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. . Advanced functional materials, Chapter 1.6.8,30. 1, (2011).
- Kim, D. -. G., Bell, A., Register, R. a. Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S., Intech, S. i. l. a. g. u. i. ,. M. .. A. .. ,. e. d. .. ,. Low Dielectric Materials for Microelectronics. Dielectric Material. , 59-76 (2012).

