تباين الخواص مضان كأداة لدراسة التفاعلات البروتين البروتين
Summary
تفاعلات البروتين هي في صميم وظيفة الخلية. وتستخدم تقنيات مقياس الكالوري والطيفية عادة لوصف لهم. نحن هنا وصف تباين مضان كأداة لدراسة التفاعل بين البروتين تحور في متلازمة شوان دايموند (SBDS) والاستطالة عامل مثل 1 GTPase (EFL1).
Abstract
تفاعلات البروتين البروتين دورا أساسيا في وظيفة الكائن الحي. مرة واحدة تم التعرف على التفاعل والتحقق من صحتها من الضروري أن نصنفها على المستوى الهيكلي والميكانيكي. وتوجد العديد من الطرق الحيوية والفيزيائية الحيوية لهذا الغرض. من بينها، مضان تباين هي تقنية قوية تستخدم بشكل خاص عندما تبقى كثافة مضان من البروتين المسمى fluorophore ثابتة على التفاعل البروتين البروتين. في هذه التقنية، وهو بروتين المسمى fluorophore هو متحمس مع الضوء المستقطب عموديا من الطول الموجي المناسب أن يثير انتقائي مجموعة فرعية من fluorophores وفقا لتوجه النسبي مع شعاع واردة. لديه الانبعاثات الناتجة أيضا الاتجاهية التي تعرف تباين (ص) العلاقة في الطائرات العمودية والأفقية على النحو التالي: ص = (أنا VV -I VH) / (أنا VV + 2I VH)، حيث كنت VV وأنا <sيو بي> VH هي شدة مضان من مكونات الرأسي والأفقي، على التوالي. مضان تباين حساس للنشر التناوب من fluorophore، وهي حجم الجزيئي واضح لfluorophore تعلق على البروتين، والذي يتغير على التفاعل البروتين البروتين. في هذا النص، وقد اتضح استخدام تباين مضان كأداة لدراسة تفاعلات البروتين البروتين لمعالجة الربط بين البروتين تحور في متلازمة شوان دايموند (SBDS)، وعامل استطالة مثل-1 GTPase (EFL1). تقليديا، يتم وضع العلامات من البروتين مع fluorophore بها على مجموعة ثيول (السيستين) أو في المجموعات الأمينية (ن-محطة أمين أو ليسين) من البروتين. ومع ذلك، SBDS تمتلك العديد من cysteines وlysines التي لم تسمح الموقع العلامات موجهة منه. كتقنية بديلة، وصبغ 4 "، وقد استخدم 5'مكرر (1،3،2 dithioarsolan-2-YL) فلوريسئين لتسمية تحديدا عزر tetracysteine، Cys-السيستئين برو-الغليسين-السيستئين-السيستئين وهندستها وراثيا في محطة سي من البروتين SBDS المؤتلف. قدمت المناسب من البيانات التجريبية المعلومات الكمية والميكانيكية على وضع ملزم بين هذه البروتينات.
Introduction
الخلايا تحتوي على العديد من الجزيئات الكبيرة التي تتفاعل باستمرار مع بعضها البعض. هذا الارتباط يثير المجمعات التي تشارك في مسارات الخلوية المسؤولة عن عملها في نقل الإشارة، وتنظيم التعبير الجيني وهجرة الخلايا وغيرها. تشمل جميع التفاعلات البروتين البروتين التي تحدث في خلية شبكة تعرف باسم interactome. في خميرة الخباز وقد تبين أن أكثر من 70٪ من البروتينات لدينا شركاء التفاعل 1. فهم interactome من خلية وتوفير وظائف لهم المعلومات ذات الصلة على مدى تعقيد وتنوع الكائنات الحية. وقد وصفت عدة منهجيات لتحديد وتوصيف التفاعلات البروتين البروتين. تختلف عالية من خلال طرق وضع مثل الخميرة اثنين الهجين 2، البروتين جزء المقايسات تكامل 3، تقارب تنقية 4 بالإضافة إلى قياس الطيف الكتلي وmicroarra البروتينتستخدم يس لتحديد التفاعل 5،6. وبمجرد تحديدها، فمن الضروري التحقق من صحة ذلك، وهذا قد تختلف على أساس كل حالة على حدة. عادة، هذه التجارب تنطوي على تعطيل التفاعل نفسه في مستوى أفراد الزوج التفاعل، على سبيل المثال، عن طريق حذف الجينات أو overexpression من واحد من البروتينات، وبعد ذلك تبحث عن التغيرات في خصائص أو وظيفة عضو آخر في المستوى الخلوي. وفي وقت لاحق، وتستخدم التقنيات الفيزيائية الحيوية 7 لوصف التفاعل البروتين البروتين على المستوى الجزيئي. تحقيقا لهذه الغاية، ويتم تحديد بنية البروتين المجمعات التي كتبها البلورات بالأشعة السينية، الرنين المغناطيسي النووي والفحص المجهري البرد الإلكترون في حين تستخدم الكالوري ومضان الطيفي لكميا وميكانيكيا وصفها.
في هذا العمل، وقد استخدم مضان تباين كأسلوب لوصف التفاعل بين GTPase EFL1 وSBDS البروتين. تشارك هذه البروتينات في تركيب الريبوسومات من خلال تشجيع إطلاق سراح حقيقية النواة عامل بدء 6 من سطح 60S الوحيدات الريباسي 8. وتحور البروتين SBDS في المرض المعروف باسم Shwachman الماس متلازمة 9 و بمثابة عامل الصرف جوانين النوكليوتيدات لEFL1 انخفاض تقارب من أجل غوانوزين ثنائي فسفات 10،11. الطفرات المرض في SBDS تلغي التفاعل مع EFL1 وبالتالي تمنع تفعيله.
يستخدم مضان تباين شيوعا في التطبيقات البيولوجية لدراسة بروتين الببتيد أو تفاعلات حمض البروتين النووي. لأنه يقوم على مبدأ أن fluorophore منتهى السعادة لعودته وكانت النتائج الضوء المستقطب في انبعاث الاستقطاب جزئيا. ويعرف تباين مضان من المعادلة 1:
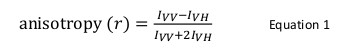
حيث أنا VV وأنا VH هيشدة مضان من عموديا (VV) وأفقيا (VH) الاستقطاب الانبعاثات عند العينة هو متحمس مع الاستقطاب عموديا ضوء 12. مضان تباين حساسة للعوامل التي تؤثر على معدل انتشار التناوب من fluorophore ويعتمد على درجة الحرارة، واللزوجة من الحل وحجم الجزيئي واضح من fluorophore الآن. حجم واضح من البروتين تحتوي على زيادات fluorophore عندما يتفاعل مع بروتين آخر وهذا التغيير ومن ثم يمكن تقييمها على أنها تغير في الخواص المتباينة. وبشكل أكثر تحديدا، فإن fluorophore التي تدور ببطء في حل قريب لعمر الفلورسنت التي يكون لها قيمة أنا VV الكبيرة والصغيرة القيمة أنا VH وبالتالي ستعرض على تباين واسع نسبيا. لfluorophores أن تعثر بسرعة بالنسبة لحياتهم الفلورسنت، وأنا VV وأنا VH تكون مشابهة وسوف قيمة تباين على أن تكون صغيرة 12 </sup > (الشكل 1). وبالإضافة إلى ذلك، إشارة تباين جيدة لقياس الضوضاء، فمن الضروري أن يكون هناك fluorophore مع عمر مضان مماثل للوقت ارتباط التناوب للجزيء من الفائدة. خلاف ذلك، فإنه ليس من الممكن أن يسجل بدقة الفرق في تباين بين البروتين مجانا وأنه في المجمع. على سبيل المثال، وتباين في تحقيق الفلورسنت مع عمر قريب من 4 NSEC مثل فلوريسئين أو رودامين تعلق على انخفاض الوزن الجزيئي مجمع 100 دا هو 0.05. ملزمة لجزيء من 160 كيلو دالتون وزيادة قيمة تباين ل0.29. الفرق التي يمكن قياسها بدقة. في المقابل، فإن نفس التحقيق الفلورسنت تشارك في رد فعل ملزم الذين الزيادة في حجم الجزيئي يختلف من 65 إلى 1000 كيلو دالتون يؤدي إلا إلى تغيير تباين من ،28-،3، التي هي صغيرة جدا بحيث لا يمكن قياسها بدقة. في هذا السيناريو، فإن التحقيق مع عمر من 400 NSEC أن يكون أكثر مناسبة 12.
<p الطبقة = "jove_content">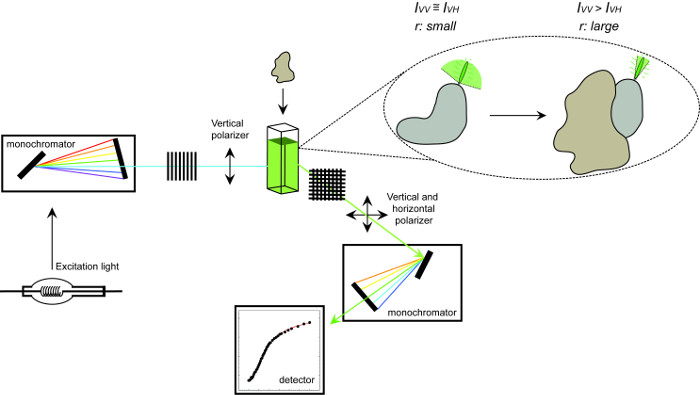
الشكل 1. تمثيل تخطيطي من المعدات المستخدمة لقياس تباين مضان والإجراء. تمثيل تخطيطي من المعدات المستخدمة لإجراء البروتين البروتين التفاعل التجربة قياس تباين مضان. Fluorophores أن تعثر سريع عرض تباين الصغيرة التي يزيد عليها ملزمة لشريك التفاعل. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تتطلب التطبيقات مضان وجود fluorophore في أي من الجزيئات التي شملتها الدراسة. لدراسة تفاعلات البروتين البروتين هناك ثلاثة أنواع من fluorophores: 1) بقايا التربتوفان موجودة في البروتينات، 2) fluorophores تعلق كيميائيا و 3) شركاء الانصهار فلوري مثل البروتين الفلوري الأخضر (GFP) وderiva لهاالأقارب. معظم البروتينات لها بقايا التربتوفان على هيكلها، وبالتالي فإن أسهل طريقة لقياس التفاعل هو عن طريق رصد التغيرات في أطياف مضان المقابلة أو عن طريق رصد التغيرات في كثافة مضان من بقايا التربتوفان. ومع ذلك، قد تكون بقايا التربتوفان الحالي في كل من البروتينات تعقيد التحليل. من ناحية أخرى، لfluorophore لتغيير خصائص فلوري لها بسبب التفاعل فإنه يحتاج إلى أن يكون موجودا على أو بالقرب من موقع ملزمة وأنها يمكن أن تتداخل مع التفاعل نفسها. هذا يحتاج إلى عناية خاصة عند استخدام fluorophores ضخمة مثل GFP. إذا كان أي من هذه fluorophores يمكن استخدامها لدراسات ملزمة من الضروري، بعد ذلك، إلى إدخال fluorophores خارجي إلى واحد من البروتينات ذات الصلة. وجود العديد من fluorophores تصنيعه كيميائيا ويمكن أن تعلق تساهمي للبروتينات من خلال مجموعاتهم التفاعلية مثل المجموعات أمين (سلسلة من الجانب lysines أو N-محطة) ومجموعة ثيول في السيستين. Fالمشتقات luorophore مع ثيوسيانات وsuccinimidyl استرات تتفاعل مع مجموعة أميد في حين iodoacetamide وmaleimide مجموعات ثيول-رد الفعل (13). الأصباغ الأكثر شيوعا في التطبيقات مضان هي مشتقات من فلوريسئين والأصباغ الخضراء رودامين، الكومارين، fluorophores BODIPY والأصباغ اليكسا فلور. ويمكن الاطلاع على قائمة مفصلة من fluorophores المتاحة تجاريا واستخدامها في المراجع 14،15. لوضع العلامات ناجحة، يجب أن تتعرض لمجموعة رد الفعل على سطح البروتين، ولكن نظرا لوجود عدد كبير من المجموعات الوظيفية على رد الفعل الحالية عادة في البروتينية من الصعب جدا الحصول على تعديل للموقع المحدد. البروتين من الاهتمام في هذه الدراسة، SBDS، ويحتوي على 5 cysteines مجانية و 33 lysines التي قد تؤدي إلى العديد من العلامات الموقع. وضع العلامات غير موحدة قد يؤثر على ملزمة وسيعقد تحليل البيانات والجزيئات fluorophore المختلفة قد تثير مختلفة إشارات كثافة الفلورسنت على ملزمة. لاوفهrcome هذه المشكلة، استخدمنا fluorophore فلاش، 4، 5'مكرر (1،3،2 dithioarsolan-2-YL) فلوريسئين لتسمية المباشر الموقع البروتين SBDS. هذا هو صبغ أرسينوكسيد مع قابلية عالية لمدة أربعة cysteines متباعدة في عزر تعرف باسم فلاش العلامة تتكون من CCXXCC تسلسل حيث X هو أي حمض أميني غير السيستين 16،17. يضاف هذا الحافز tetracysteine إلى N- أو C-محطة من البروتين عن طريق الهندسة الوراثية جنبا إلى جنب مع رابط المناسبة لمنع اختلال أضعاف العام للبروتين. وقد تم تصميم هذا الزوج تتكون من فلاش صبغ وفلاش العلامة أصلا للبروتينات تسمية مواقع محددة في الخلايا الحية 17 ولكن يمكن أيضا أن تستخدم لتسمية تنقية البروتينات في المختبر كما يتجلى ذلك هنا. بالإضافة إلى ذلك، كما تم وضع استراتيجيات الأنزيمية لتمكين functionalization في مواقع محددة من البروتينات 18.
في هذه المخطوطة وصفنا فائدة مضان تباين لأداة سا لدراسة تفاعلات البروتين البروتين. ملزمة يمكن تقييمها عن طريق التفتيش بسيط من شكل منحنى ملزم بينما يمكن الحصول على معلومات كمية من نوبة من البيانات التجريبية.
Protocol
Representative Results
Discussion
معظم التجارب الكيميائية الحيوية مع البروتينات تتطلب ليس فقط من البروتين النقي ولكن أيضا على كميات كبيرة منها، بغض النظر عن التقنية المستخدمة. لهذا السبب، يتم الحصول على البروتينات المستخدمة لهذا النوع من التجارب التي كتبها تعبير مغايرة، كما كان الحال المقدمة هنا. ت…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Authors acknowledge the financial support from CONACyT project numbers 167359 and 177138, and from DGAPA-UNAM project number IN201615.
Materials
| 0.5 mm Glass beads | Biospec Products | 11079105 | |
| Tris Base | Formedium | TRIS01 | Ultra pure |
| Glycerol | Sigma-Aldrich | G5516 | |
| dye 4’, 5’-bis(1,3,2 dithioarsolan-2-yl) fluorescein | ThermoFischer Scientific | LC6090 | This kit contains the dye to label a FlAsH tag |
| Ampiciline | IBI Shelton Scientific, Inc | IB02040 | |
| D(+)-Glucose Anhydrous | Formedium | GLU03 | |
| D(+)-Galactose | Formedium | GAL03 | |
| L-Leucine | Formedium | DOC0157 | |
| L-Tryptofan | Formedium | DOC0189 | |
| Bezamidine hydrochloride | Sigma-Aldrich | B6506-5G | |
| PMSF | Gold Biotechnology, Inc | P-470-25 | Phenylmethylsulfonyl fluoride |
| NaCl | Formedium | NAC02 | Sodium Chloride |
| Glycerol | Tecsiquim, S.A. de C.V. | GT1980-6 | |
| MgCl2 | Merck Millipore Corporation | 1725711000 | Magnesium Chloride |
| Imidazole | Sigma-Aldrich | I2399-500G | |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250-100ML | |
| K2HPO4 | Sigma-Aldrich | P3786-500G | Potassium phosphate dibasic |
| NaH2PO4 | Sigma-Aldrich | S3139-500G | Sodium phosphate monobasic |
| Yeast nitrogen base without amino acids | Formedium | CYN0410 | |
| Yeast extract | Formedium | YEM03 | Micro Granulated |
| L-Tyroisne | Formedium | DOC0193 | |
| Adenine sulphate | Formedium | DOC0230 | |
| Casamino acids | Formedium | CAS03 | |
| Tryptone | IBI Shelton Scientific, Inc | IB49182 | |
| IPTG | Formedium | IPTG025 | |
| Name of Material | Company | Catalog Number | Comments/Description |
| Filtration units | Merck Millipore Corporation | UFC901096 | Amicon Ultra-15, membrana PLGC Ultracel-PL, 10 kDa |
| Membrane Filter | Merck Millipore Corporation | GSWP04700 | Membrane Filter, mixed cellulose esters, Hydrophilic, 0.22 µm, 47 mm, white, plain |
| Ni2+ affinity column | QIAGEN | 30760 | Cartridge pre-filled with 5 ml Ni-NTA Superflow |
| Strong Sulfopropyl cation exchanger column | GE Healthcare Life Science | 17-5157-01 | HiTrap SP Sepharose FF 5 ml |
| Size Exclusion column | GE Healthcare Life Science | 28989335 | HiLoad 16/600 Superdex 200 PG |
| Fluorescence cell | Hellma Analytics | 111-057-40 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Spectrophotometer | Agilent Technologies | G6860AA | Cary 60 UV-Vis |
| Shaker | ThermoFischer Scientific | SHKA4000-7 | MaxQ 4000 Benchtop temperature range Ambient-15° to 60°C |
| Centrifuge | ThermoFischer Scientific | 75004271 | Heraeus Megafuge 16R |
| FPLC | Pharmacia Biotech | Discontinued | FPLC system conductivity UV-MM II monitor P500 pump fraction |
| Spectrofluorometer | Olis | No applicable | Olis DM 45 with Polarization Toolbox |
References
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440 (7084), 637-643 (2006).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Michnick, S. W., Hien Ear, P., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods in Enzymology. 470, 336-366 (2010).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Dwane, S., Kiely, P. A. Tools used to study how protein complexes are assembled in signaling cascades. Bioeng Bugs. 2 (5), 247-259 (2011).
- Snider, J., et al. Fundamentals of protein interaction network mapping. Mol Syst Biol. 11 (12), 848 (2015).
- Fersht, A., Baldwin, R. L. . Structure and mechanism in protein science: a guide to enzyme catalysis and protein folding. , 191-214 (2002).
- Menne, T. F., et al. The Shwachman-Bodian-Diamond syndrome protein mediates translational activation of ribosomes in yeast. Nat Genet. 39 (4), 486-495 (2007).
- Boocock, G. R., et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet. 33 (1), 97-101 (2003).
- Garcia-Marquez, A., Gijsbers, A., de la Mora, E., Sanchez-Puig, N. Defective Guanine Nucleotide Exchange in the Elongation Factor-like 1 (EFL1) GTPase by Mutations in the Shwachman-Diamond Syndrome Protein. J Biol Chem. 290 (29), 17669-17678 (2015).
- Gijsbers, A., Garcia-Marquez, A., Luviano, A., Sanchez-Puig, N. Guanine nucleotide exchange in the ribosomal GTPase EFL1 is modulated by the protein mutated in the Shwachman-Diamond syndrome. Biochem Biophys Res Commun. 437 (3), 349-354 (2013).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2010).
- Nishigaki, T., Treviño, C. L., Gòmez, I. . Tools to understand protein-protein interactions. 37, 1-14 (2012).
- Johnson, I. . The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. , (2010).
- Sabnis, R. W. . Handbook of Fluorescent Dyes and Probes. , (2015).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: synthesis and biological applications. J Am Chem Soc. 124 (21), 6063-6076 (2002).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281 (5374), 269-272 (1998).
- Rashidian, M., Dozier, J. K., Distefano, M. D. Enzymatic labeling of proteins: techniques and approaches. Bioconjug Chem. 24 (8), 1277-1294 (2013).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: A laboratory manual. , (2001).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- West, R. W., Chen, S. M., Putz, H., Butler, G., Banerjee, M. GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences. Genes Dev. 1 (10), 1118-1131 (1987).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Eftink, M. R. Fluorescence methods for studying equilibrium macromolecule-ligand interactions. Methods Enzymol. 278, 221-257 (1997).
- Han, H., et al. Binding of Substrates to the Central Pore of the Vps4 ATPase Is Autoinhibited by the Microtubule Interacting and Trafficking (MIT) Domain and Activated by MIT Interacting Motifs (MIMs). J Biol Chem. 290 (21), 13490-13499 (2015).
- Sanchez-Puig, N., Veprintsev, D. B., Fersht, A. R. Binding of natively unfolded HIF-1alpha ODD domain to p53. Mol Cell. 17 (1), 11-21 (2005).
- Trusch, F., et al. The N-terminal Region of the Ubiquitin Regulatory X (UBX) Domain-containing Protein 1 (UBXD1) Modulates Interdomain Communication within the Valosin-containing Protein p97. J Biol Chem. 290 (49), 29414-29427 (2015).
- Kamp, F., Beyer, K. Binding of alpha-synuclein affects the lipid packing in bilayers of small vesicles. The Journal of Biological Chemsitry. 281, 9251-9259 (2006).
- Bujalowski, W. M., Jezewska, M. J. Fluorescence Intensity, Anisotropy, and Transient Dynamic Quenching Stopped-Flow Kinetics. Spectroscopic Methods of Analysis. 875, 105-133 (2012).
- Asano, N., et al. Direct interaction between EFL1 and SBDS is mediated by an intrinsically disordered insertion domain. Biochem Biophys Res Commun. 443 (4), 1251-1256 (2014).

