एक उपकरण प्रोटीन, प्रोटीन बातचीत का अध्ययन करने के रूप में प्रतिदीप्ति एनिसोट्रॉपिक
Summary
प्रोटीन बातचीत एक सेल के समारोह के दिल में हैं। Calorimetric और स्पेक्ट्रोस्कोपी तकनीक आमतौर पर उन्हें चिह्नित करने के लिए इस्तेमाल कर रहे हैं। यहाँ हम प्रोटीन Shwachman-डायमंड सिंड्रोम (SBDS) में उत्परिवर्तित और बढ़ाव कारक की तरह 1 GTPase (EFL1) के बीच बातचीत का अध्ययन करने के लिए एक उपकरण के रूप में प्रतिदीप्ति anisotropy का वर्णन है।
Abstract
प्रोटीन, प्रोटीन बातचीत एक जीवित जीव के समारोह में एक आवश्यक भूमिका निभाते हैं। एक बार एक बातचीत पहचान की गई है और मान्य यह संरचनात्मक और यंत्रवत स्तर पर यह चिह्नित करने के लिए आवश्यक है। कई जैव रासायनिक और biophysical तरीकों ऐसे प्रयोजन के लिए मौजूद हैं। उनमें से, प्रतिदीप्ति anisotropy एक शक्तिशाली तकनीक विशेष रूप से इस्तेमाल किया जाता है जब एक fluorophore लेबल प्रोटीन की प्रतिदीप्ति तीव्रता प्रोटीन, प्रोटीन बातचीत पर लगातार बना रहता है। इस तकनीक में, एक fluorophore लेबल प्रोटीन एक उपयुक्त तरंग दैर्ध्य है कि चुनिंदा भेजे किरण के साथ उनके रिश्तेदार उन्मुखीकरण के अनुसार fluorophores की एक सबसेट उत्तेजित की खड़ी ध्रुवीकरण प्रकाश के साथ उत्साहित है। इस प्रकार के रूप में जिसके परिणामस्वरूप उत्सर्जन भी एक दिशात्मकता जिसका क्षैतिज और ऊर्ध्वाधर विमानों में संबंधों को परिभाषित करता anisotropy (आर) है: आर = (मैं वी.वी. -मैं VH) / (मैं वी.वी. + 2I VH) है, जहां मैं वी.वी. और मैं <sयूबी> VH क्षैतिज और ऊर्ध्वाधर घटक के प्रतिदीप्ति तीव्रता, क्रमशः रहे हैं। प्रतिदीप्ति anisotropy एक fluorophore, एक fluorophore एक प्रोटीन है, जो प्रोटीन, प्रोटीन बातचीत पर बदल दिया है से जुड़ी अर्थात् स्पष्ट आणविक आकार की बारी-बारी से प्रसार के प्रति संवेदनशील है। वर्तमान पाठ में, प्रोटीन, प्रोटीन बातचीत का अध्ययन करने के लिए एक उपकरण के रूप में प्रतिदीप्ति anisotropy के उपयोग प्रोटीन Shwachman-डायमंड सिंड्रोम (SBDS) में उत्परिवर्तित और बढ़ाव कारक जैसे-1 GTPase (EFL1) के बीच बाध्यकारी संबोधित करने के लिए एक उदाहरण प्रस्तुत किया गया था। पारंपरिक, एक fluorophore के साथ एक प्रोटीन की लेबलिंग thiol समूह (सिस्टीन) पर या प्रोटीन के अमीनो समूह (एन टर्मिनल अमाइन या लाइसिन) में किया जाता है। हालांकि, SBDS कई cysteines और lysines है कि यह साइट का निर्देश दिया लेबलिंग की अनुमति नहीं दी पास। एक वैकल्पिक तकनीक, डाई 4 'के रूप में, 5'-बीआईएस (1,3,2 dithioarsolan-2-YL) fluorescein विशेष रूप से एक tetracysteine आकृति, Cys- लेबल करने के लिए इस्तेमाल किया गया थाCys-प्रो-Gly-Cys-Cys, आनुवंशिक रूप से पुनः संयोजक SBDS प्रोटीन की सी टर्मिनस में इंजीनियर। प्रयोगात्मक डेटा की फिटिंग इन प्रोटीनों के बीच बंधन मोड पर मात्रात्मक और यंत्रवत जानकारी प्रदान की।
Introduction
प्रकोष्ठों Biomacromolecules कि लगातार एक दूसरे के साथ बातचीत के एक भीड़ में होते हैं। इस संस्था परिसरों कि संकेत पारगमन, जीन अभिव्यक्ति और अन्य लोगों के बीच सेल प्रवास के नियमन में उनके कामकाज के लिए जिम्मेदार सेलुलर रास्ते में भाग लेने के लिए जन्म देता है। सभी प्रोटीन, प्रोटीन बातचीत है कि एक सेल में घटित एक नेटवर्क interactome के रूप में जाना शामिल हैं। Saccharomyces cerevisiae में इसकी प्रोटीन की 70% से अधिक बातचीत भागीदारों 1 है दिखाया गया है। एक सेल के interactome को समझना और उनके कार्यों जटिलता और रहने वाले जीवों की विविधता पर प्रासंगिक जानकारी प्रदान करते हैं। कई तरीके की पहचान करने और प्रोटीन, प्रोटीन बातचीत को चिह्नित करने वर्णित किया गया है। ऐसे खमीर दो संकर 2, प्रोटीन-टुकड़ा पूरक assays 3, आत्मीयता शुद्धि 4 मास स्पेक्ट्रोमेट्री और प्रोटीन microarra के लिए युग्मित के रूप में डाल तरीकों के माध्यम से विभिन्न उच्चवाईएस एक बातचीत 5,6 की पहचान करने के लिए इस्तेमाल कर रहे हैं। एक बार की पहचान, यह यह मान्य करने के लिए आवश्यक है और यह एक मामला-दर-मामला आधार पर भिन्न हो सकते हैं। आमतौर पर, इन प्रयोगों बातचीत जोड़ी, जैसे के व्यक्तिगत सदस्यों के स्तर पर बातचीत से ही खलल न डालें, जीन विलोपन या प्रोटीन में से एक की overexpression से शामिल है, और फिर कम से गुणों में परिवर्तन या अन्य सदस्य के समारोह के लिए तलाश सेलुलर स्तर। बाद में, biophysical तकनीक 7 आण्विक स्तर पर प्रोटीन, प्रोटीन बातचीत को चिह्नित करने के लिए इस्तेमाल कर रहे हैं। यह अंत करने के लिए, प्रोटीन परिसरों की संरचना एक्स-रे क्रिस्टलोग्राफी, परमाणु चुंबकीय अनुनाद और क्रायो इलेक्ट्रॉन माइक्रोस्कोपी द्वारा निर्धारित कर रहे हैं, जबकि उष्मामिति और प्रतिदीप्ति स्पेक्ट्रोस्कोपी मात्रात्मक और mechanistically उन्हें का वर्णन करने के लिए इस्तेमाल कर रहे हैं।
इस काम में, प्रतिदीप्ति anisotropy GTPase EFL1 और SBD के बीच बातचीत को चिह्नित करने के लिए एक तकनीक के रूप में इस्तेमाल किया गया थाएस प्रोटीन। ये प्रोटीन 60 ribosomal सबयूनिट 8 की सतह से यूकेरियोटिक दीक्षा कारक है 6 की रिहाई को बढ़ावा देने से राइबोसोम के संश्लेषण में भाग लेते हैं। SBDS प्रोटीन एक बीमारी EFL1 guanosine diphosphate 10,11 के लिए अपने संबंध को कम करने के लिए एक गुआनिन न्यूक्लियोटाइड विनिमय कारक के रूप में Shwachman-डायमंड सिंड्रोम 9 और कृत्यों के रूप में जाना जाता है में उत्परिवर्तित है। SBDS में रोग म्यूटेशन EFL1 के साथ बातचीत को खत्म करने और इस प्रकार अपने सक्रियण को रोकने के।
प्रतिदीप्ति anisotropy सामान्यतः प्रोटीन पेप्टाइड या प्रोटीन-न्यूक्लिक एसिड बातचीत का अध्ययन करने के लिए जैविक अनुप्रयोगों में प्रयोग किया जाता है। यह सिद्धांत है कि एक fluorophore एक आंशिक रूप से ध्रुवीकृत उत्सर्जन में ध्रुवीकृत प्रकाश परिणामों के साथ उत्साहित पर आधारित है। प्रतिदीप्ति anisotropy 1 समीकरण द्वारा परिभाषित किया गया है:
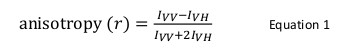
मैं वी.वी. और मैं VH रहे हैं, जहांखड़ी (वी.वी.) और क्षैतिज (VH) के प्रतिदीप्ति तीव्रता उत्सर्जन ध्रुवीकरण जब नमूना उत्साहित है खड़ी साथ प्रकाश 12 ध्रुवीकरण। प्रतिदीप्ति anisotropy कारक है कि fluorophore की बारी-बारी से प्रसार की दर को प्रभावित करने के लिए संवेदनशील है और इस तरह के तापमान, समाधान की चिपचिपाहट और fluorophore का स्पष्ट आणविक आकार पर निर्भर करता है। एक प्रोटीन एक fluorophore बढ़ जाती युक्त जब यह एक और प्रोटीन और इस तरह के परिवर्तन के साथ सूचना का आदान प्रदान के स्पष्ट आकार तो anisotropy में बदलाव के रूप में मूल्यांकन किया जा सकता है। अधिक विशेष रूप से, एक fluorophore है कि इसके फ्लोरोसेंट जीवन भर के लिए समाधान के सापेक्ष में धीरे-धीरे घूमता है एक अपेक्षाकृत बड़े anisotropy प्रदर्शन करेंगे एक बड़ा मैं वी.वी. मूल्य और छोटे मैं VH मूल्य नहीं है और इसलिए होगा। Fluorophores कि तेजी से अपने फ्लोरोसेंट जीवन भर के सापेक्ष हुई बात के लिए, मैं वी.वी. और मैं VH समान हो जाएगा और उनके anisotropy मूल्य छोटा हो जाएगा 12 </sup> (चित्रा 1)। इसके अलावा, शोर माप के लिए एक अच्छा संकेत anisotropy के लिए, यह आवश्यक है ब्याज की अणु की बारी-बारी से सह-संबंध समय के लिए इसी तरह एक प्रतिदीप्ति जीवन भर के साथ एक fluorophore के लिए है। अन्यथा, यह सही मुक्त प्रोटीन के बीच और कहा कि परिसर में anisotropy में अंतर रिकॉर्ड करने के लिए संभव नहीं है। उदाहरण के लिए, एक जीवन भर के 100 दा का एक कम आणविक भार परिसर से जुड़ी ऐसी fluorescein या rhodamine के रूप में 4 NSEC के पास से एक फ्लोरोसेंट जांच की anisotropy 0.05 है। 160 केडीए 0.29 करने के लिए अपने anisotropy मूल्य में वृद्धि होगी एक अणु के लिए बाइंडिंग; एक अंतर यह है कि सही ढंग से मापा जा सकता है। इसके विपरीत, एक ही फ्लोरोसेंट एक बाध्यकारी प्रतिक्रिया आणविक आकार में वृद्धि जिसका 1,000 केडीए के लिए 65 से भिन्न होता है में शामिल जांच केवल 0.3 करने के लिए 0.28 की एक anisotropy परिवर्तन है, जो बहुत छोटा सही मापा जा रहा है में परिणाम होगा। इस परिदृश्य में, 400 nsec का एक जीवन भर के साथ एक अधिक उपयुक्त जांच 12 होगा।
<pवर्ग = "jove_content">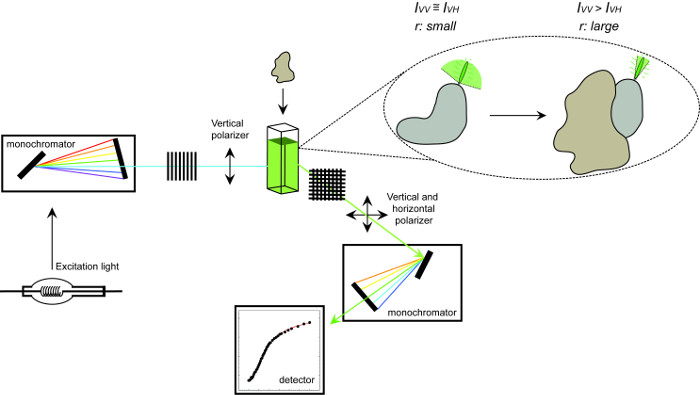
चित्रा 1. प्रतिदीप्ति anisotropy और प्रक्रिया को मापने के लिए इस्तेमाल किया उपकरणों की योजनाबद्ध प्रतिनिधित्व। एक प्रोटीन, प्रोटीन बातचीत प्रयोग मापने प्रतिदीप्ति anisotropy प्रदर्शन करने के लिए इस्तेमाल किया उपकरणों की योजनाबद्ध प्रतिनिधित्व। Fluorophores है कि तेजी से प्रदर्शन छोटे anisotropy कि एक बातचीत साथी के लिए बाध्य पर बढ़ जाती हुई। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
प्रतिदीप्ति अनुप्रयोगों के अणुओं का अध्ययन से किसी में एक fluorophore की उपस्थिति की आवश्यकता होती है। प्रोटीन, प्रोटीन बातचीत का अध्ययन करने के लिए वहाँ fluorophores के तीन प्रकार हैं: 1) नियासिन प्रोटीन में मौजूद अवशेषों, 2) रासायनिक जुड़ी fluorophores और 3) फ्लोरोसेंट संलयन भागीदारों के ऐसे हरी फ्लोरोसेंट प्रोटीन (GFP) और उसके Deriva के रूप मेंtives। सबसे अधिक प्रोटीन, एक बातचीत को मापने के लिए सबसे आसान तरीका है इस प्रकार इसी प्रतिदीप्ति स्पेक्ट्रा में परिवर्तन की निगरानी के द्वारा या tryptophan अवशेषों की प्रतिदीप्ति तीव्रता में परिवर्तन की निगरानी कर रहा है इसकी संरचना पर tryptophan अवशेषों की है। हालांकि, नियासिन अवशेषों विश्लेषण उलझी दोनों प्रोटीन में मौजूद हो सकता है। दूसरी ओर, एक fluorophore एक बातचीत के कारण फ्लोरोसेंट गुणों को बदलने के लिए उस पर या बाध्यकारी साइट के पास स्थित होने की जरूरत है और यह बातचीत के साथ ही हस्तक्षेप कर सकता है। यह विशेष ध्यान जब इस तरह के GFP के रूप में भारी fluorophores का उपयोग कर की जरूरत है। इन fluorophores से कोई बाध्यकारी अध्ययन के लिए इस्तेमाल किया जा सकता है यदि ऐसा है तो, शामिल प्रोटीन से एक के लिए बाह्य fluorophores लागू करने के लिए आवश्यक है। कई रासायनिक संश्लेषित fluorophores मौजूद हैं और covalently ऐसे एमाइन समूह (lysines या एन टर्मिनस के पक्ष श्रृंखला) और सिस्टीन में thiol समूहों के रूप में उनके प्रतिक्रियाशील समूहों के माध्यम से प्रोटीन के लिए संलग्न किया जा सकता है। एफआइसोथियोसाइनेट और succinimidyl एस्टर के साथ luorophore डेरिवेटिव एमाइड समूहों के साथ प्रतिक्रिया करते हुए iodoacetamide और maleimide thiol प्रतिक्रियाशील समूहों 13 हैं। सबसे आम प्रतिदीप्ति अनुप्रयोगों में इस्तेमाल रंगों fluorescein के डेरिवेटिव और rhodamine हरे रंग, coumarins, BODIPY fluorophores और एलेक्सा स्त्राव रंगों कर रहे हैं। व्यावसायिक रूप से उपलब्ध fluorophores और उनके उपयोग की एक विस्तृत सूची संदर्भों 14,15 में पाया जा सकता है। सफल लेबलिंग के लिए, प्रतिक्रियाशील समूह प्रोटीन की सतह पर उजागर किया जाना चाहिए, लेकिन प्रतिक्रियाशील कार्य समूहों को आम तौर पर polypeptides में मौजूद बड़ी संख्या के कारण यह साइट विशेष संशोधन पाने के लिए बहुत मुश्किल है। इस अध्ययन में ब्याज की प्रोटीन, SBDS, 5 मुक्त cysteines और 33 lysines कि कई साइट लेबलिंग में परिणाम हो सकता है शामिल हैं। गैर वर्दी लेबलिंग बाध्यकारी प्रभावित कर सकता है और डेटा विश्लेषण को मुश्किल के रूप में विभिन्न fluorophore अणुओं बाध्यकारी पर विभिन्न फ्लोरोसेंट तीव्रता संकेतों बटोर सकता है। ove करने के लिएइस समस्या rcome, हम फ्लैश fluorophore, 4 ', 5'-बीआईएस (1,3,2 dithioarsolan-2-YL) साइट प्रत्यक्ष लेबल करने के लिए fluorescein SBDS प्रोटीन का इस्तेमाल किया। यह एक मूल भाव अनुक्रम CCXXCC जहां एक्स किसी भी अमीनो सिस्टीन 16,17 के अलावा अन्य एसिड होता है से मिलकर फ्लैश-टैग के रूप में जानते में चार स्थान दिया गया है cysteines के लिए एक उच्च आत्मीयता के साथ एक arsenoxide डाई है। इस tetracysteine मूल भाव एक साथ प्रोटीन की समग्र गुना के विघटन को रोकने के लिए एक उपयुक्त लिंकर साथ एन या प्रोटीन की सी टर्मिनस जेनेटिक इंजीनियरिंग से जोड़ा है। फ्लैश डाई और फ्लैश-टैग से मिलकर जोड़ी मूल कोशिकाओं 17 में रहने वाले साइट विशेष लेबल प्रोटीन के लिए डिजाइन किया गया था, लेकिन यह भी इन विट्रो में शुद्ध प्रोटीन लेबल करने के लिए के रूप में यह यहाँ उदाहरण है इस्तेमाल किया जा सकता है। इसके अतिरिक्त, एंजाइमी रणनीतियों भी प्रोटीन 18 की साइट विशेष functionalization सक्षम करने के लिए विकसित किया गया है।
इस पांडुलिपि में हम प्रतिदीप्ति anisotropy एक की उपयोगिता का वर्णनSA उपकरण प्रोटीन, प्रोटीन बातचीत का अध्ययन करने के लिए। बंधन बाध्यकारी वक्र आकार के सरल निरीक्षण द्वारा मूल्यांकन किया जा सकता है, जबकि मात्रात्मक जानकारी प्रयोगात्मक डेटा के फिट से प्राप्त किया जा सकता है।
Protocol
Representative Results
Discussion
प्रोटीन के साथ अधिकांश जैव रासायनिक प्रयोगों न केवल शुद्ध प्रोटीन, लेकिन यह भी उनमें से बड़ी मात्रा में इस्तेमाल तकनीक पर ध्यान दिए बिना की आवश्यकता होती है। इस कारण से, प्रयोगों के इस प्रकार के लिए इस?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Authors acknowledge the financial support from CONACyT project numbers 167359 and 177138, and from DGAPA-UNAM project number IN201615.
Materials
| 0.5 mm Glass beads | Biospec Products | 11079105 | |
| Tris Base | Formedium | TRIS01 | Ultra pure |
| Glycerol | Sigma-Aldrich | G5516 | |
| dye 4’, 5’-bis(1,3,2 dithioarsolan-2-yl) fluorescein | ThermoFischer Scientific | LC6090 | This kit contains the dye to label a FlAsH tag |
| Ampiciline | IBI Shelton Scientific, Inc | IB02040 | |
| D(+)-Glucose Anhydrous | Formedium | GLU03 | |
| D(+)-Galactose | Formedium | GAL03 | |
| L-Leucine | Formedium | DOC0157 | |
| L-Tryptofan | Formedium | DOC0189 | |
| Bezamidine hydrochloride | Sigma-Aldrich | B6506-5G | |
| PMSF | Gold Biotechnology, Inc | P-470-25 | Phenylmethylsulfonyl fluoride |
| NaCl | Formedium | NAC02 | Sodium Chloride |
| Glycerol | Tecsiquim, S.A. de C.V. | GT1980-6 | |
| MgCl2 | Merck Millipore Corporation | 1725711000 | Magnesium Chloride |
| Imidazole | Sigma-Aldrich | I2399-500G | |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250-100ML | |
| K2HPO4 | Sigma-Aldrich | P3786-500G | Potassium phosphate dibasic |
| NaH2PO4 | Sigma-Aldrich | S3139-500G | Sodium phosphate monobasic |
| Yeast nitrogen base without amino acids | Formedium | CYN0410 | |
| Yeast extract | Formedium | YEM03 | Micro Granulated |
| L-Tyroisne | Formedium | DOC0193 | |
| Adenine sulphate | Formedium | DOC0230 | |
| Casamino acids | Formedium | CAS03 | |
| Tryptone | IBI Shelton Scientific, Inc | IB49182 | |
| IPTG | Formedium | IPTG025 | |
| Name of Material | Company | Catalog Number | Comments/Description |
| Filtration units | Merck Millipore Corporation | UFC901096 | Amicon Ultra-15, membrana PLGC Ultracel-PL, 10 kDa |
| Membrane Filter | Merck Millipore Corporation | GSWP04700 | Membrane Filter, mixed cellulose esters, Hydrophilic, 0.22 µm, 47 mm, white, plain |
| Ni2+ affinity column | QIAGEN | 30760 | Cartridge pre-filled with 5 ml Ni-NTA Superflow |
| Strong Sulfopropyl cation exchanger column | GE Healthcare Life Science | 17-5157-01 | HiTrap SP Sepharose FF 5 ml |
| Size Exclusion column | GE Healthcare Life Science | 28989335 | HiLoad 16/600 Superdex 200 PG |
| Fluorescence cell | Hellma Analytics | 111-057-40 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Spectrophotometer | Agilent Technologies | G6860AA | Cary 60 UV-Vis |
| Shaker | ThermoFischer Scientific | SHKA4000-7 | MaxQ 4000 Benchtop temperature range Ambient-15° to 60°C |
| Centrifuge | ThermoFischer Scientific | 75004271 | Heraeus Megafuge 16R |
| FPLC | Pharmacia Biotech | Discontinued | FPLC system conductivity UV-MM II monitor P500 pump fraction |
| Spectrofluorometer | Olis | No applicable | Olis DM 45 with Polarization Toolbox |
References
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440 (7084), 637-643 (2006).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Michnick, S. W., Hien Ear, P., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods in Enzymology. 470, 336-366 (2010).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Dwane, S., Kiely, P. A. Tools used to study how protein complexes are assembled in signaling cascades. Bioeng Bugs. 2 (5), 247-259 (2011).
- Snider, J., et al. Fundamentals of protein interaction network mapping. Mol Syst Biol. 11 (12), 848 (2015).
- Fersht, A., Baldwin, R. L. . Structure and mechanism in protein science: a guide to enzyme catalysis and protein folding. , 191-214 (2002).
- Menne, T. F., et al. The Shwachman-Bodian-Diamond syndrome protein mediates translational activation of ribosomes in yeast. Nat Genet. 39 (4), 486-495 (2007).
- Boocock, G. R., et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet. 33 (1), 97-101 (2003).
- Garcia-Marquez, A., Gijsbers, A., de la Mora, E., Sanchez-Puig, N. Defective Guanine Nucleotide Exchange in the Elongation Factor-like 1 (EFL1) GTPase by Mutations in the Shwachman-Diamond Syndrome Protein. J Biol Chem. 290 (29), 17669-17678 (2015).
- Gijsbers, A., Garcia-Marquez, A., Luviano, A., Sanchez-Puig, N. Guanine nucleotide exchange in the ribosomal GTPase EFL1 is modulated by the protein mutated in the Shwachman-Diamond syndrome. Biochem Biophys Res Commun. 437 (3), 349-354 (2013).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2010).
- Nishigaki, T., Treviño, C. L., Gòmez, I. . Tools to understand protein-protein interactions. 37, 1-14 (2012).
- Johnson, I. . The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. , (2010).
- Sabnis, R. W. . Handbook of Fluorescent Dyes and Probes. , (2015).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: synthesis and biological applications. J Am Chem Soc. 124 (21), 6063-6076 (2002).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281 (5374), 269-272 (1998).
- Rashidian, M., Dozier, J. K., Distefano, M. D. Enzymatic labeling of proteins: techniques and approaches. Bioconjug Chem. 24 (8), 1277-1294 (2013).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: A laboratory manual. , (2001).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- West, R. W., Chen, S. M., Putz, H., Butler, G., Banerjee, M. GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences. Genes Dev. 1 (10), 1118-1131 (1987).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Eftink, M. R. Fluorescence methods for studying equilibrium macromolecule-ligand interactions. Methods Enzymol. 278, 221-257 (1997).
- Han, H., et al. Binding of Substrates to the Central Pore of the Vps4 ATPase Is Autoinhibited by the Microtubule Interacting and Trafficking (MIT) Domain and Activated by MIT Interacting Motifs (MIMs). J Biol Chem. 290 (21), 13490-13499 (2015).
- Sanchez-Puig, N., Veprintsev, D. B., Fersht, A. R. Binding of natively unfolded HIF-1alpha ODD domain to p53. Mol Cell. 17 (1), 11-21 (2005).
- Trusch, F., et al. The N-terminal Region of the Ubiquitin Regulatory X (UBX) Domain-containing Protein 1 (UBXD1) Modulates Interdomain Communication within the Valosin-containing Protein p97. J Biol Chem. 290 (49), 29414-29427 (2015).
- Kamp, F., Beyer, K. Binding of alpha-synuclein affects the lipid packing in bilayers of small vesicles. The Journal of Biological Chemsitry. 281, 9251-9259 (2006).
- Bujalowski, W. M., Jezewska, M. J. Fluorescence Intensity, Anisotropy, and Transient Dynamic Quenching Stopped-Flow Kinetics. Spectroscopic Methods of Analysis. 875, 105-133 (2012).
- Asano, N., et al. Direct interaction between EFL1 and SBDS is mediated by an intrinsically disordered insertion domain. Biochem Biophys Res Commun. 443 (4), 1251-1256 (2014).

