タンパク質 - タンパク質相互作用を研究するためのツールとしての蛍光異方性
Summary
タンパク質相互作用は、細胞の機能の中心にあります。熱量分光技術は、一般に、それらを特徴付けるために使用されます。ここでは、Shwachman-ダイヤモンド症候群(SBDS)で変異タンパク質と伸長因子様1 GTPアーゼ(EFL1)間の相互作用を研究するためのツールとして蛍光異方性を説明します。
Abstract
タンパク質 – タンパク質相互作用は、生体の機能において重要な役割を果たす。相互作用が同定され、検証された後には、構造的および機構的レベルでそれを特徴付けることが必要です。いくつかの生化学的および生物物理学的方法は、そのような目的のために存在します。中でも、蛍光異方性は、フルオロフォアで標識されたタンパク質の蛍光強度は、タンパク質 – タンパク質相互作用の際に一定のままである場合に特に使用される強力な技術です。この技術では、フルオロフォアで標識されたタンパク質は、選択的に入射ビームとの相対的な向きに応じて蛍光体のサブセットを励起する適切な波長の垂直偏光で励起されます。得られた発光はまた、関係垂直方向と水平方向の面で次のように異方性(r)を定義して方向性があります:私はVVとI R =(I VV -I VH)を /(I VV + 2I VH)、 <sUB> VHは、それぞれ、垂直および水平成分の蛍光強度です。蛍光異方性は、フルオロフォアの回転拡散、タンパク質 – タンパク質相互作用の際に変更されるタンパク質に結合フルオロフォアの、すなわち見かけの分子サイズに敏感です。本テキストでは、タンパク質 – タンパク質相互作用を研究するためのツールとしての蛍光異方性の使用はShwachmanダイヤモンド症候群(SBDS)で変異タンパク質など-1 GTPアーゼ(EFL1)伸び率との間の結合に対処するために例示しました。従来は、フルオロフォアを用いたタンパク質の標識は、チオール基(システイン)、またはタンパク質のアミノ基(N末端アミンまたはリジン)で行われます。しかし、SBDSはそれの部位指向性標識化を許可していませんでしたいくつかのシステイン及びリジンを有しています。代替技術、色素4 'としては、5'-ビス(1,3,2- dithioarsolan -2-イル)フルオレセインは、具体的にはテトラモチーフ、Cys-を標識するために使用しました。遺伝子組換えSBDSタンパク質のC末端に操作されたCys-PRO-グリシン – システイン – システイン、。実験データのフィッティングは、これらのタンパク質間の結合様式の定量的および機構的情報を提供しました。
Introduction
細胞は常に互いに相互作用の生体高分子の多くが含まれています。この関連付けは、シグナル伝達、遺伝子発現、およびとりわけ、細胞遊走の調節におけるそれらの機能を担当する細胞経路に関与する複合体を生じさせます。細胞内で発生するすべてのタンパク質 – タンパク質相互作用は、インタラクトームと呼ばれるネットワークを含みます。 サッカロミセス・セレビシエ(Saccharomyces cerevisiae)におけるそのタンパク質の70%以上は、相互作用パートナー1を有することが示されています。セルとその機能のインタラクトームを理解することは、生物の複雑さと多様性に関連する情報を提供しています。いくつかの方法は、タンパク質 – タンパク質相互作用を同定し、特徴付けるために記載されています。このような酵母ツーハイブリッド2、タンパク質断片相補アッセイ3、質量分析およびタンパク質microarraに結合されたアフィニティー精製4として置く方法による高異なりますYSは対話5,6を識別するために使用されます。識別されると、それを検証するために必要であり、これはケースバイケースで変動し得ます。典型的には、これらの実験は、タンパク質の一つの遺伝子の欠失または過剰発現により、例えば 、相互作用ペアの個々のメンバーのレベルの相互作用自体を破壊し、その後で他のメンバーの性質又は機能の変化を探し含みます細胞レベル。その後、生物物理学的技術7は、分子レベルでのタンパク質-タンパク質相互作用を特徴付けるために使用されます。熱量測定及び蛍光分光法を定量的及び機械的にそれらを記述するために使用されるこの目的のために、タンパク質複合体の構造は、X線結晶学、核磁気共鳴及び低温電子顕微鏡によって決定されます。
本研究では、蛍光異方性は、GTPアーゼEFL1とSBDとの間の相互作用を特徴づけるための手法として使用しましたSタンパク質。これらのタンパク質は、60Sリボソームサブユニット8の表面から真核生物の開始因子6のリリースを促進することによってリボソームの合成に参加しています。 SBDSタンパク質はShwachmanダイヤモンド症候群9として知られている疾患で変異し、EFL1がグアノシン二リン酸10,11との親和性を減少させるためのグアニンヌクレオチド交換因子として作用します。 SBDSにおける疾患変異はEFL1との相互作用を廃止し、したがって、その活性化を防ぎます。
蛍光異方性は、一般的に、タンパク質 – ペプチド又はタンパク質 – 核酸相互作用を研究するために、生物学的用途で使用されます。これは、フルオロフォアは、部分的に偏光放射の偏光の結果で励起という原理に基づいています。蛍光異方性は、式1で定義されています。
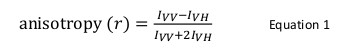
I VVと私VHがある場所サンプルが垂直偏光12で励起されたときに、水平垂直(VV)及び(VH)の蛍光強度は、放射を偏光。蛍光異方性は、フルオロフォアの回転拡散の速度に影響を与える要因に敏感であり、したがって、温度、溶液の粘度およびフルオロフォアのみかけの分子サイズに依存します。それは他のタンパク質とそのような変化と相互作用するとき、フルオロフォア増加を含むタンパク質の見かけの大きさは、その後、異方性の変化として評価することができます。具体的には、その蛍光寿命を解決に相対ゆっくりと回転するフルオロフォアは、大きなI VV値と小さなI VHの値を持つことになりますので、比較的大きな異方性を示すであろう。急速に蛍光寿命を基準に転落蛍光団のために、私VVと私VHは同様であろうとその異方性値が小さい12になります</sup>( 図1)。また、ノイズ測定に優れた異方性信号のために、目的の分子の回転相関時間と同様の蛍光寿命を有する蛍光団を有することが必要です。そうでなければ、正確に遊離タンパク質との複合体中のそれとの間の異方性の差を記録することは不可能です。例えば、100ダの低分子量化合物に結合し、フルオレセインやローダミンなどの4ナノ秒に近い寿命を持つ蛍光プローブの異方性が0.05です。 160キロダルトンの分子に結合すると、0.29にその異方性値が増加します。正確に測定することができる差。これとは対照的に、その増加分子の大きさで変化する65〜1000キロダルトンへの結合反応に関与し、同じ蛍光プローブは正確に測定するには小さすぎるです0.3から0.28の異方性の変化、になります。このシナリオでは、400ナノ秒の寿命を有するプローブは、12より適切であろう。
<pクラス= "jove_content">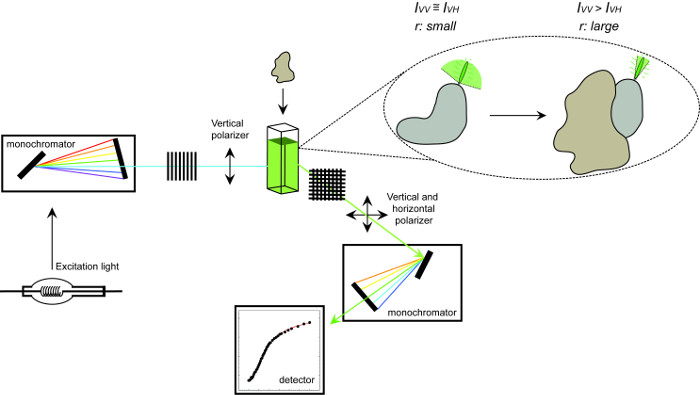
蛍光異方性と手続きを測定するために使用される装置の1概略図。蛍光異方性を測定し、タンパク質-タンパク質相互作用の実験を行うために用いられる装置の概略図。相互作用パートナーに結合すると増加し、高速表示、小さな異方性をタンブルフルオロフォア。 この図の拡大版をご覧になるにはこちらをクリックしてください。
蛍光用途が研究分子のいずれかでフルオロフォアの存在を必要とします。フルオロフォアの三種類があるタンパク質 – タンパク質相互作用を研究するために:1)タンパク質中に存在するトリプトファン残基、2)、緑色蛍光タンパク質(GFP)およびそのderivaように化学的に結合フルオロフォアおよび3)、蛍光融合パートナーティブ。ほとんどのタンパク質は、その構造上のトリプトファン残基を有し、従って、相互作用を測定する最も簡単な方法は、対応する蛍光スペクトルの変化を監視することにより、またはトリプトファン残基の蛍光強度の変化を監視することによってです。しかし、トリプトファン残基の分析を複雑に両方のタンパク質中に存在してもよいです。フルオロフォアによる相互作用、その蛍光特性を変化する一方、または結合部位の近くに位置する必要があり、それが相互作用自体を妨害する可能性があります。 GFPなどのかさばるフルオロフォアを使用する場合に特別な注意が必要です。これらの蛍光体のいずれもが結合研究のために使用できない場合には、その後、関連するタンパク質の一つに外因性蛍光団を導入することが必要です。多くの化学的に合成されたフルオロフォアが存在し、共有結合、アミン基(リジンまたはN末端の側鎖)およびシステイン中のチオール基のようなそれらの反応基を介してタンパク質に結合させることができます。 Fヨードアセトアミドおよびマレイミドは、チオール反応性基13でありながら、イソチオシアネートおよびスクシンイミジルエステルとluorophore誘導体は、アミド基と反応します。蛍光用途で使用される最も一般的な色素は、フルオレセインの誘導体およびローダミングリーン色素、クマリン、BODIPYフルオロフォアおよびアレクサフルオロ色素です。市販のフルオロフォアおよびその使用の詳細なリストは、参考文献14,15に記載されています。成功した標識のために、反応性基は、タンパク質の表面に露出する必要がありますが、原因のポリペプチドに典型的に存在する反応性官能基の数が多いため、部位特異的修飾を得ることは非常に困難です。本研究における目的のタンパク質は、SBDS、複数のサイトの標識をもたらすことができる5遊離システインと33のリジンが含まれています。不均一な標識は、結合に影響を与えることができ、異なるフルオロフォア分子が結合時に異なる蛍光強度信号を引き出すことができるようにデータ解析を複雑にします。 OVEするにはこの問題をrcome、我々はサイトの直接ラベルに、SBDSタンパク質を4 '、5'-ビス(1,3,2- dithioarsolan -2-イル)フルオレセインをフラッシュフルオロフォアを使用していました。これは、フラッシュタグは、Xは、システイン16,17以外の任意のアミノ酸である配列CCXXCCからなるとしても知らモチーフの4つの離間したシステインに対して高い親和性を有するarsenoxide色素です。このテトラシステインモチーフは、タンパク質の全体的な折り畳みの破壊を防止するために一緒に適切なリンカーとN末端または遺伝子工学によるタンパク質のC末端に付加されています。フラッシュ染料とフラッシュタグのペアは、もともと生細胞17に、サイト固有のラベルタンパク質に設計されていたが、それはここで例示されているとして、また、 インビトロで精製されたタンパク質を標識するために使用することができます。また、酵素の戦略はまた、タンパク質18の部位特異的官能化を可能にするために開発されてきました。
本稿では、我々は、蛍光異方性aの有用性を説明しますタンパク質 – タンパク質相互作用を研究するためのSAツール。定量的情報は、実験データのフィットから得られることができるが、結合は、結合曲線の形状の単純な検査によって評価することができます。
Protocol
Representative Results
Discussion
タンパク質のほとんどの生化学的実験に関係なく使用される技術の、純粋なタンパク質だけでなく、それらの大量ではないだけを必要とします。それは、ここで提示する場合であったように、この理由のために、実験のこのタイプのために使用されるタンパク質は、異種発現によって得られます。蛍光分光法が研究され、分子内にフルオロフォアの存在を必要とします。芳香族残基は、それ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Authors acknowledge the financial support from CONACyT project numbers 167359 and 177138, and from DGAPA-UNAM project number IN201615.
Materials
| 0.5 mm Glass beads | Biospec Products | 11079105 | |
| Tris Base | Formedium | TRIS01 | Ultra pure |
| Glycerol | Sigma-Aldrich | G5516 | |
| dye 4’, 5’-bis(1,3,2 dithioarsolan-2-yl) fluorescein | ThermoFischer Scientific | LC6090 | This kit contains the dye to label a FlAsH tag |
| Ampiciline | IBI Shelton Scientific, Inc | IB02040 | |
| D(+)-Glucose Anhydrous | Formedium | GLU03 | |
| D(+)-Galactose | Formedium | GAL03 | |
| L-Leucine | Formedium | DOC0157 | |
| L-Tryptofan | Formedium | DOC0189 | |
| Bezamidine hydrochloride | Sigma-Aldrich | B6506-5G | |
| PMSF | Gold Biotechnology, Inc | P-470-25 | Phenylmethylsulfonyl fluoride |
| NaCl | Formedium | NAC02 | Sodium Chloride |
| Glycerol | Tecsiquim, S.A. de C.V. | GT1980-6 | |
| MgCl2 | Merck Millipore Corporation | 1725711000 | Magnesium Chloride |
| Imidazole | Sigma-Aldrich | I2399-500G | |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250-100ML | |
| K2HPO4 | Sigma-Aldrich | P3786-500G | Potassium phosphate dibasic |
| NaH2PO4 | Sigma-Aldrich | S3139-500G | Sodium phosphate monobasic |
| Yeast nitrogen base without amino acids | Formedium | CYN0410 | |
| Yeast extract | Formedium | YEM03 | Micro Granulated |
| L-Tyroisne | Formedium | DOC0193 | |
| Adenine sulphate | Formedium | DOC0230 | |
| Casamino acids | Formedium | CAS03 | |
| Tryptone | IBI Shelton Scientific, Inc | IB49182 | |
| IPTG | Formedium | IPTG025 | |
| Name of Material | Company | Catalog Number | Comments/Description |
| Filtration units | Merck Millipore Corporation | UFC901096 | Amicon Ultra-15, membrana PLGC Ultracel-PL, 10 kDa |
| Membrane Filter | Merck Millipore Corporation | GSWP04700 | Membrane Filter, mixed cellulose esters, Hydrophilic, 0.22 µm, 47 mm, white, plain |
| Ni2+ affinity column | QIAGEN | 30760 | Cartridge pre-filled with 5 ml Ni-NTA Superflow |
| Strong Sulfopropyl cation exchanger column | GE Healthcare Life Science | 17-5157-01 | HiTrap SP Sepharose FF 5 ml |
| Size Exclusion column | GE Healthcare Life Science | 28989335 | HiLoad 16/600 Superdex 200 PG |
| Fluorescence cell | Hellma Analytics | 111-057-40 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Spectrophotometer | Agilent Technologies | G6860AA | Cary 60 UV-Vis |
| Shaker | ThermoFischer Scientific | SHKA4000-7 | MaxQ 4000 Benchtop temperature range Ambient-15° to 60°C |
| Centrifuge | ThermoFischer Scientific | 75004271 | Heraeus Megafuge 16R |
| FPLC | Pharmacia Biotech | Discontinued | FPLC system conductivity UV-MM II monitor P500 pump fraction |
| Spectrofluorometer | Olis | No applicable | Olis DM 45 with Polarization Toolbox |
References
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440 (7084), 637-643 (2006).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Michnick, S. W., Hien Ear, P., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods in Enzymology. 470, 336-366 (2010).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Dwane, S., Kiely, P. A. Tools used to study how protein complexes are assembled in signaling cascades. Bioeng Bugs. 2 (5), 247-259 (2011).
- Snider, J., et al. Fundamentals of protein interaction network mapping. Mol Syst Biol. 11 (12), 848 (2015).
- Fersht, A., Baldwin, R. L. . Structure and mechanism in protein science: a guide to enzyme catalysis and protein folding. , 191-214 (2002).
- Menne, T. F., et al. The Shwachman-Bodian-Diamond syndrome protein mediates translational activation of ribosomes in yeast. Nat Genet. 39 (4), 486-495 (2007).
- Boocock, G. R., et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet. 33 (1), 97-101 (2003).
- Garcia-Marquez, A., Gijsbers, A., de la Mora, E., Sanchez-Puig, N. Defective Guanine Nucleotide Exchange in the Elongation Factor-like 1 (EFL1) GTPase by Mutations in the Shwachman-Diamond Syndrome Protein. J Biol Chem. 290 (29), 17669-17678 (2015).
- Gijsbers, A., Garcia-Marquez, A., Luviano, A., Sanchez-Puig, N. Guanine nucleotide exchange in the ribosomal GTPase EFL1 is modulated by the protein mutated in the Shwachman-Diamond syndrome. Biochem Biophys Res Commun. 437 (3), 349-354 (2013).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2010).
- Nishigaki, T., Treviño, C. L., Gòmez, I. . Tools to understand protein-protein interactions. 37, 1-14 (2012).
- Johnson, I. . The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. , (2010).
- Sabnis, R. W. . Handbook of Fluorescent Dyes and Probes. , (2015).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: synthesis and biological applications. J Am Chem Soc. 124 (21), 6063-6076 (2002).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281 (5374), 269-272 (1998).
- Rashidian, M., Dozier, J. K., Distefano, M. D. Enzymatic labeling of proteins: techniques and approaches. Bioconjug Chem. 24 (8), 1277-1294 (2013).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: A laboratory manual. , (2001).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- West, R. W., Chen, S. M., Putz, H., Butler, G., Banerjee, M. GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences. Genes Dev. 1 (10), 1118-1131 (1987).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Eftink, M. R. Fluorescence methods for studying equilibrium macromolecule-ligand interactions. Methods Enzymol. 278, 221-257 (1997).
- Han, H., et al. Binding of Substrates to the Central Pore of the Vps4 ATPase Is Autoinhibited by the Microtubule Interacting and Trafficking (MIT) Domain and Activated by MIT Interacting Motifs (MIMs). J Biol Chem. 290 (21), 13490-13499 (2015).
- Sanchez-Puig, N., Veprintsev, D. B., Fersht, A. R. Binding of natively unfolded HIF-1alpha ODD domain to p53. Mol Cell. 17 (1), 11-21 (2005).
- Trusch, F., et al. The N-terminal Region of the Ubiquitin Regulatory X (UBX) Domain-containing Protein 1 (UBXD1) Modulates Interdomain Communication within the Valosin-containing Protein p97. J Biol Chem. 290 (49), 29414-29427 (2015).
- Kamp, F., Beyer, K. Binding of alpha-synuclein affects the lipid packing in bilayers of small vesicles. The Journal of Biological Chemsitry. 281, 9251-9259 (2006).
- Bujalowski, W. M., Jezewska, M. J. Fluorescence Intensity, Anisotropy, and Transient Dynamic Quenching Stopped-Flow Kinetics. Spectroscopic Methods of Analysis. 875, 105-133 (2012).
- Asano, N., et al. Direct interaction between EFL1 and SBDS is mediated by an intrinsically disordered insertion domain. Biochem Biophys Res Commun. 443 (4), 1251-1256 (2014).

