Protein-protein etkileşimleri çalışmak için aracı olarak floresan Anizotropi
Summary
Protein etkileşimleri bir hücrenin işlevi merkezinde yer alıyor. Kalorimetre ve spektroskopik teknikleri yaygın onları karakterize etmek için kullanılır. Burada Shwachman-Diamond Sendromu (SBD'ler) mutasyona uğramış protein ve Uzama faktörü benzeri 1 GTPaz (EFL1) arasındaki etkileşimi incelemek için bir araç olarak floresan anizotropi açıklar.
Abstract
Protein-protein etkileşimi, bir canlı organizmanın işlevinde önemli bir rol oynamaktadır. bir etkileşim tespit ve doğrulandıktan sonra yapısal ve mekanik düzeyde bunu karakterize etmek gereklidir. Çeşitli biyokimyasal ve biyofiziksel yöntemler bu amaçla mevcut. Bir fluoroforla işaretlenmiş proteinin floresans yoğunluğu, protein-protein etkileşimi üzerine sabit kaldığı durumlarda Bunlar arasında floresan anizotropi, özellikle kullanılan güçlü bir tekniktir. Bu teknikte, bir florofor ile işaretlenmiş proteinin seçici gelen ışın ile göreceli yönelimine göre florofor bir alt kümesi uyaran bir uygun dalga boyunda dikey olarak kutuplanmış ışık eksite edilir. Ortaya çıkan emisyon ayrıca, dikey ve yatay düzlemlerde ilişki anizotropi (r) tanımlayan bir yönü vardır: r (I VV -I VH) / (I VV + 2I VH), ben VV ve ben = nerede <sUB> VH sırasıyla dikey ve yatay bileşenleri floresan yoğunlukları vardır. Fosforlu anisotropi, bir flüorofor, protein-protein etkileşimi sırasında değişmiş bir protein, bağlı bir fluorofor, yani görünür molekül boyutu dönme difüzyon duyarlıdır. Bu metinde, protein-protein etkileşimlerini incelemek için bir araç olarak floresans anizotropi kullanımı Shwachman-Diamond Sendromu (SBDS) mutasyona uğramış protein ve uzama faktörü gibi-1 GTPaz (EFL1) arasındaki bağlanma gidermek için örneklendirilmiştir. Geleneksel olarak, bir florofor ile proteinin etiketlenmesi tiol grupları (sistein) veya proteinin amino gruplarının (N-terminal amin ya da lisin) içinde gerçekleştirilir. Ancak, SBDS bunun bölgeye yönelik etiketleme izin vermedi birkaç sistein ve lysines sahiptir. Alternatif bir teknik, boya 4 'de, 5'-bis (1,3,2 dithioarsolan-2-il) floresein özellikle Tetracysteine motifi, Cys- etiketlemek için kullanıldıCys-Pro-Gly-Cys-Cys, genetik rekombinant SBDS proteinin C-terminalinde tasarlanmıştır. Deneysel verilerin uydurma bu proteinler arasındaki bağlanma modu nicel ve mekanik bilgi verdi.
Introduction
Hücreler sürekli birbirleri ile etkileşim biomacromolecules çok sayıda içerir. Bu ilişki, sinyal iletimi, gen ifadesi ve diğerleri arasında, hücre göçünün düzenlenmesinde işleyişi sorumlu hücre yoluna katılabilir kompleksleri yol açar. bir hücrede meydana gelen tüm protein-protein etkileşimleri interaktom bilinen bir ağ ihtiva eder. Saccharomyces cerevisiae'de de proteinlerin% 70'den fazla etkileşim ortakları 1 sahip olduğu gösterilmiştir. Bir hücrenin interaktom anlamak ve fonksiyonları karmaşıklığı ve canlıların çeşitliliği ilgili bilgileri sağlar. Çeşitli metodolojiler, protein-protein etkileşimlerini belirlemek ve tanımlamak için tarif edilmiştir. Bu tür maya iki-hibrid 2, protein fragmanı tamamlama deneyleri 3, kütle spektrometrisi ve protein microarra bağlanmış afinite saflaştırma 4 olarak koyun yöntemlerle yüksek Farklıys bir etkileşim 5,6 tanımlamak için kullanılır. tespit kez, bunu doğrulamak için gerekli olan ve bu bir vaka ile ayrı ayrı değişebilir. Tipik haliyle, bu deneyler, gen silinmesi veya proteinlerin bir aşırı ifadesi ile etkileşim çifti, örneğin, tek tek üyelerin seviyesinde, etkileşim kendisini kesintiye içerir, ve daha sonra diğer üyesinin özelliklerindeki değişiklik ya da işlev için ideal hücresel düzeyde. Daha sonra, biyo-fiziksel teknikler 7 moleküler düzeyde protein-protein etkileşimlerini tanımlamak için kullanılır. kalorimetri ve floresan spektroskopi nicelik ve mekanik olarak bunları tarif etmek için kullanılır ise, bu amaca yönelik olarak, protein kompleksleri yapısı X-ışını kristalografisi, nükleer manyetik rezonans ve kriyo-elektron mikroskobu ile tespit edilir.
Bu çalışmada, floresan anizotropi GTPaz EFL1 ve SBD arasındaki etkileşimi karakterize etmek için bir teknik olarak kullanılanS proteini. Bu proteinler, 60S ribozomal alt birim 8 yüzeyinden ökaryotik başlatma faktörünün 6 salınmasını teşvik ederek ribozomların sentezine katılmadığını. SBDS proteini EFL1 guanosin difosfata 10,11 için afiniteye azaltılması için bir guanin nükleotid değişim faktörü olarak Shwachman-Diamond sendromu, 9 ve hareket olarak bilinen bir hastalık mutasyona uğrar. SBD'ler Hastalık mutasyonlar EFL1 ile etkileşimi ortadan kaldırmak ve böylece aktivasyonunu engeller.
Floresans anisotropi yaygın protein peptid veya protein, nükleik asit etkileşimleri incelemek için biyolojik uygulamalarda kullanılır. Bir fluorofor kısmen polarize emisyon polarize ışık sonuçları ile heyecanlı olduğu ilkesine dayanmaktadır. Floresans anisotropi Denklem 1 ile tanımlanır:
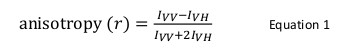
Ben VV ve VH nerededikey 12 ışık polarize ile örnek heyecanlı olduğunda dikey olarak (VV) ve yatay (VH) floresan yoğunlukları emisyonu polarize. Floresans anisotropi fluorofor dönme difüzyon hızını etkileyen faktörlere karşı duyarlıdır ve bu nedenle sıcaklık, çözelti viskozitesi ve fluorofor görünür molekül büyüklüğüne bağlıdır. başka protein ve böyle bir değişiklik ile etkileşime girdiğinde bir florofor artar içeren bir proteinin bariz boyutu daha sonra anizotropide bir değişiklik olarak değerlendirilebilir. Daha spesifik olarak, kendi floresan ömrü çözüm göreceli yavaş dönen bir fluorofor nispeten büyük bir anizotropi sergileyecek bu nedenle büyük bir ben VV değeri ve küçük ben VH değerine sahip olacak ve. Onların floresan ömrü hızla göreceli takla fluorophores için, VV ve VH benzer olacaktır ve bunların anizotropi değeri küçük olacaktır 12 </sup> (Şekil 1). Buna ek olarak, gürültü ölçümü için iyi bir anizotropi sinyali için, ilgili molekülün dönme korelasyon zaman benzer bir floresan ömrü olan bir flüorofor olması gereklidir. Aksi takdirde, doğru bir kompleks serbest protein arasında ve anizotropi farkı kayıt yapmak mümkün değildir. Örneğin, 100 da düşük molekül ağırlıklı bir bileşiğin bağlanmış örneğin flöresin ve rodamin edildiği gibi 4 nsaniye yakın bir ömür süresi olan bir flüoresan probun anizotropi 0.05. kDa 0.29 olan anizotropi değerini artırır 160 bir moleküle bağlanması; doğru ölçülebilir bir fark. Bunun aksine, olan bir artış, moleküler boyut olarak değişmektedir 65 1.000 kDa bir bağlama reaksiyonda yer kişi aynı flüoresan prob sadece doğru bir şekilde ölçülmesi için çok küçük olan 0,3 0.28 bir anisotropi değişikliği ile sonuçlanacaktır. Bu senaryoda, 400 nsaniye bir ömür boyu bir prob 12 daha uygun olacaktır.
<pclass = "jove_content">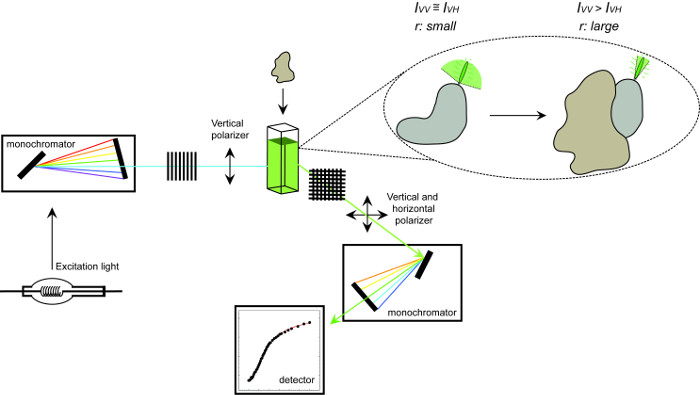
Floresan anizotropi ve prosedürü ölçmek için kullanılan ekipmanın 1. şematik gösterimi Şekil. Bir protein-protein etkileşim deneyi ölçüm floresan anizotropi gerçekleştirmek için kullanılan ekipman şematik gösterimi. Bir etkileşim ortağı bağlanması üzerine artar hızlı ekran küçük anizotropi takla flüoroforlan. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Floresan uygulamaları ele moleküllerin herhangi bir fluorofor varlığını gerektirir. florofor üç türü vardır, protein-protein etkileşimleri incelemek için: 1) proteinleri içinde mevcut triptofan kalıntısı, 2), yeşil flüoresan protein (GFP) ve deriva gibi kimyasal bağlanmış fluorophores ve 3) flüoresan füzyon partnerleritives. Çoğu protein, yapısı bir etkileşimi ölçmek için en kolay yol, ilgili floresans spektrumları değişiklikleri izleyerek veya triptofan artıklarının floresan yoğunluğu değişiklikleri izleyerek, triptofanı kalıntılarına sahip olacak şekilde. Bununla birlikte, triptofan artıklarının analizi karmaşıklaştıran iki protein içinde mevcut olabilir. Bir fluorofor nedeniyle bir etkileşim onun floresan özelliklerini değiştirmek için Öte yandan, bu ya da bağlanma yeri yakınında bulunan gerekiyor ve bu etkileşim kendisi müdahale olabilir. GFP gibi hacimli fluorophores kullanıldığında bu özel dikkat gerektirir. Bu florofor hiçbiri bağlanma çalışmaları için kullanılabilir, bu süreden sonra katılan proteinlerin birine dışsal fluorophores tanıtmak gereklidir. Birçok kimyasal olarak sentezlenmiş fluorophores biri kovalent gibi amin grupları (bir lisin ya da N-terminal yan zincir) ve sistein tiyol grupları olarak reaktif gruplar yoluyla proteinlere bağlanabilir. Fiodoasetamid ve maleimid tiol-reaktif gruplar, 13 ise izotiyosiyanat ve süksinimidil esterlerin ile luorophore türevleri amid grubu ile reaksiyona girer. Floresan uygulamalarda en yaygın olarak kullanılan boya fluoresein türevleri ve rodamin, yeşil boya, kumarinler, BODIPY fluorophores ve Alexa Fluor boyalardır. Piyasada mevcut fluorophores ve bunların kullanımı ayrıntılı bir listesi referanslar 14,15 bulunabilir. Başarılı bir etiketleme için, reaktif grup proteinin yüzeyi ile açık olmalıdır, fakat polipeptidler tipik olarak reaktif işlevsel grupların çok sayıda, mevkiye-özgü modifikasyonu almak çok zordur. Bu çalışmada, ilgili protein, SBDS, birden fazla site etiketleme ile sonuçlanabilir 5 serbest sistein ve 33 lisin bulunmaktadır. Sigara üniforma etiketleme bağlama etkileyebilir ve farklı fluorofor molekülleri bağlanması üzerine farklı floresan yoğunluğu sinyallerini ortaya çıkarabilir olarak veri analizi zorlaştıracaktır. ove içinBu sorunu rcome biz FLASH florofor, 4 'site doğrudan etiket, 5'-bis (1,3,2 dithioarsolan-2-il) floresein SBDS proteini kullanılır. Bu motifi X sistein 16,17 dışında herhangi bir amino asit olduğu sekansı CCXXCC oluşan flaş etiketi olarak bilmek dört aralıklı sistein için büyük bir benzerliği olan bir arsenoxide boyadır. Bu Tetracysteine motifi birlikte proteinin genel kat bozulmasını önlemek için, uygun bir bağlayıcı ile genetik mühendisliği ile N- veya proteinin C-terminaline ilave edilmiştir. FLASH boya ve FLASH etiketinin oluşan bir çift ilk hücreler 17 oturma yeri belirli etiket protein için tasarlanmıştır, ancak, aynı zamanda, burada örnek olarak olduğu gibi, in vitro olarak, saflaştırılmış proteinleri etiketlemek için kullanılabilir. Buna ek olarak, enzimatik stratejiler aynı zamanda, proteinlerin 18 site-spesifik işlevselleştirilmesini sağlamak için geliştirilmiştir.
Bu yazıda floresan anizotropi a yararlılığını açıklarsa aracı protein-protein etkileşimleri incelemek için. niceliksel bilgi deneysel verilerin uyum elde edilebilir ise ciltleme eğri şeklinin basit bir muayene ile değerlendirilebilmektedir.
Protocol
Representative Results
Discussion
proteinleri ile en biyokimyasal deneyler kullanılan tekniğe bakılmaksızın, saf protein değil, aynı zamanda onların büyük miktarlarda sadece gerektirir. Burada sunulan olduğu gibi, bu nedenle, bu deney türü için kullanılan proteinler, heterolog ekspresyonu ile elde edilir. Floresans spektroskopisi çalışılan molekül içinde bir florofor varlığını gerektirmektedir. en çok protein için ortak olan ve her ikisi de mevcut olacağından aromatik artıklar, protein-protein etkileşimleri incelemek için…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Authors acknowledge the financial support from CONACyT project numbers 167359 and 177138, and from DGAPA-UNAM project number IN201615.
Materials
| 0.5 mm Glass beads | Biospec Products | 11079105 | |
| Tris Base | Formedium | TRIS01 | Ultra pure |
| Glycerol | Sigma-Aldrich | G5516 | |
| dye 4’, 5’-bis(1,3,2 dithioarsolan-2-yl) fluorescein | ThermoFischer Scientific | LC6090 | This kit contains the dye to label a FlAsH tag |
| Ampiciline | IBI Shelton Scientific, Inc | IB02040 | |
| D(+)-Glucose Anhydrous | Formedium | GLU03 | |
| D(+)-Galactose | Formedium | GAL03 | |
| L-Leucine | Formedium | DOC0157 | |
| L-Tryptofan | Formedium | DOC0189 | |
| Bezamidine hydrochloride | Sigma-Aldrich | B6506-5G | |
| PMSF | Gold Biotechnology, Inc | P-470-25 | Phenylmethylsulfonyl fluoride |
| NaCl | Formedium | NAC02 | Sodium Chloride |
| Glycerol | Tecsiquim, S.A. de C.V. | GT1980-6 | |
| MgCl2 | Merck Millipore Corporation | 1725711000 | Magnesium Chloride |
| Imidazole | Sigma-Aldrich | I2399-500G | |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250-100ML | |
| K2HPO4 | Sigma-Aldrich | P3786-500G | Potassium phosphate dibasic |
| NaH2PO4 | Sigma-Aldrich | S3139-500G | Sodium phosphate monobasic |
| Yeast nitrogen base without amino acids | Formedium | CYN0410 | |
| Yeast extract | Formedium | YEM03 | Micro Granulated |
| L-Tyroisne | Formedium | DOC0193 | |
| Adenine sulphate | Formedium | DOC0230 | |
| Casamino acids | Formedium | CAS03 | |
| Tryptone | IBI Shelton Scientific, Inc | IB49182 | |
| IPTG | Formedium | IPTG025 | |
| Name of Material | Company | Catalog Number | Comments/Description |
| Filtration units | Merck Millipore Corporation | UFC901096 | Amicon Ultra-15, membrana PLGC Ultracel-PL, 10 kDa |
| Membrane Filter | Merck Millipore Corporation | GSWP04700 | Membrane Filter, mixed cellulose esters, Hydrophilic, 0.22 µm, 47 mm, white, plain |
| Ni2+ affinity column | QIAGEN | 30760 | Cartridge pre-filled with 5 ml Ni-NTA Superflow |
| Strong Sulfopropyl cation exchanger column | GE Healthcare Life Science | 17-5157-01 | HiTrap SP Sepharose FF 5 ml |
| Size Exclusion column | GE Healthcare Life Science | 28989335 | HiLoad 16/600 Superdex 200 PG |
| Fluorescence cell | Hellma Analytics | 111-057-40 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Spectrophotometer | Agilent Technologies | G6860AA | Cary 60 UV-Vis |
| Shaker | ThermoFischer Scientific | SHKA4000-7 | MaxQ 4000 Benchtop temperature range Ambient-15° to 60°C |
| Centrifuge | ThermoFischer Scientific | 75004271 | Heraeus Megafuge 16R |
| FPLC | Pharmacia Biotech | Discontinued | FPLC system conductivity UV-MM II monitor P500 pump fraction |
| Spectrofluorometer | Olis | No applicable | Olis DM 45 with Polarization Toolbox |
References
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440 (7084), 637-643 (2006).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Michnick, S. W., Hien Ear, P., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods in Enzymology. 470, 336-366 (2010).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Dwane, S., Kiely, P. A. Tools used to study how protein complexes are assembled in signaling cascades. Bioeng Bugs. 2 (5), 247-259 (2011).
- Snider, J., et al. Fundamentals of protein interaction network mapping. Mol Syst Biol. 11 (12), 848 (2015).
- Fersht, A., Baldwin, R. L. . Structure and mechanism in protein science: a guide to enzyme catalysis and protein folding. , 191-214 (2002).
- Menne, T. F., et al. The Shwachman-Bodian-Diamond syndrome protein mediates translational activation of ribosomes in yeast. Nat Genet. 39 (4), 486-495 (2007).
- Boocock, G. R., et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet. 33 (1), 97-101 (2003).
- Garcia-Marquez, A., Gijsbers, A., de la Mora, E., Sanchez-Puig, N. Defective Guanine Nucleotide Exchange in the Elongation Factor-like 1 (EFL1) GTPase by Mutations in the Shwachman-Diamond Syndrome Protein. J Biol Chem. 290 (29), 17669-17678 (2015).
- Gijsbers, A., Garcia-Marquez, A., Luviano, A., Sanchez-Puig, N. Guanine nucleotide exchange in the ribosomal GTPase EFL1 is modulated by the protein mutated in the Shwachman-Diamond syndrome. Biochem Biophys Res Commun. 437 (3), 349-354 (2013).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2010).
- Nishigaki, T., Treviño, C. L., Gòmez, I. . Tools to understand protein-protein interactions. 37, 1-14 (2012).
- Johnson, I. . The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. , (2010).
- Sabnis, R. W. . Handbook of Fluorescent Dyes and Probes. , (2015).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: synthesis and biological applications. J Am Chem Soc. 124 (21), 6063-6076 (2002).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281 (5374), 269-272 (1998).
- Rashidian, M., Dozier, J. K., Distefano, M. D. Enzymatic labeling of proteins: techniques and approaches. Bioconjug Chem. 24 (8), 1277-1294 (2013).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: A laboratory manual. , (2001).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- West, R. W., Chen, S. M., Putz, H., Butler, G., Banerjee, M. GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences. Genes Dev. 1 (10), 1118-1131 (1987).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Eftink, M. R. Fluorescence methods for studying equilibrium macromolecule-ligand interactions. Methods Enzymol. 278, 221-257 (1997).
- Han, H., et al. Binding of Substrates to the Central Pore of the Vps4 ATPase Is Autoinhibited by the Microtubule Interacting and Trafficking (MIT) Domain and Activated by MIT Interacting Motifs (MIMs). J Biol Chem. 290 (21), 13490-13499 (2015).
- Sanchez-Puig, N., Veprintsev, D. B., Fersht, A. R. Binding of natively unfolded HIF-1alpha ODD domain to p53. Mol Cell. 17 (1), 11-21 (2005).
- Trusch, F., et al. The N-terminal Region of the Ubiquitin Regulatory X (UBX) Domain-containing Protein 1 (UBXD1) Modulates Interdomain Communication within the Valosin-containing Protein p97. J Biol Chem. 290 (49), 29414-29427 (2015).
- Kamp, F., Beyer, K. Binding of alpha-synuclein affects the lipid packing in bilayers of small vesicles. The Journal of Biological Chemsitry. 281, 9251-9259 (2006).
- Bujalowski, W. M., Jezewska, M. J. Fluorescence Intensity, Anisotropy, and Transient Dynamic Quenching Stopped-Flow Kinetics. Spectroscopic Methods of Analysis. 875, 105-133 (2012).
- Asano, N., et al. Direct interaction between EFL1 and SBDS is mediated by an intrinsically disordered insertion domain. Biochem Biophys Res Commun. 443 (4), 1251-1256 (2014).

