Studie av endoplasmatiskt retikulum och Mitochondria Interaktioner av<em> In Situ</em> Proximity Ligation Assay i fixerade celler
Summary
Här beskriver vi ett förfarande för att visualisera och kvantifiera med hög känslighet de endogena interaktioner mellan det endoplasmatiska retiklet och mitokondrier i fixerade celler. Protokollet har en optimerad in situ närhet ligering analys med inriktning på inositol 1,4,5-trifosfat receptor / glukos-reglerad protein 75 / spänningsberoende anjon kanal / cyklofilin D komplexet vid mitokondrierna associerade membran gränssnitt.
Abstract
Structural interactions between the endoplasmic reticular (ER) and mitochondrial membranes, in domains known as mitochondria-associated membranes (MAM), are crucial hubs for cellular signaling and cell fate. Particularly, these inter-organelle contact sites allow the transfer of calcium from the ER to mitochondria through the voltage-dependent anion channel (VDAC)/glucose-regulated protein 75 (GRP75)/inositol 1,4,5-triphosphate receptor (IP3R) calcium channeling complex. While this subcellular compartment is under intense investigation in both physiological and pathological conditions, no simple and sensitive method exists to quantify the endogenous amount of ER-mitochondria contact in cells. Similarly, MAMs are highly dynamic structures, and there is no suitable approach to follow modifications of ER-mitochondria interactions without protein overexpression. Here, we report an optimized protocol based on the use of an in situ proximity ligation assay to visualize and quantify endogenous ER-mitochondria interactions in fixed cells by using the close proximity between proteins of the outer mitochondrial membrane (VDAC1) and of the ER membrane (IP3R1) at the MAM interface. Similar in situ proximity ligation experiments can also be performed with the GRP75/IP3R1 and cyclophilin D/IP3R1 pairs of antibodies. This assay provides several advantages over other imaging procedures, as it is highly specific, sensitive, and suitable to multiple-condition testing. Therefore, the use of this in situ proximity ligation assay should be helpful to better understand the physiological regulations of ER-mitochondria interactions, as well as their role in pathological contexts.
Introduction
Mitokondrier och endoplasmatiskt retikulum (ER) inte är självständiga organeller i cellen, men de interagerar strukturellt och funktionellt vid kontaktställen som definieras som mitokondrier associerade endoplasmatiska retiklet membran (MAM). I själva verket mams motsvarar regioner där membranen i ER och mitokondrier är nära apposed, så att interaktioner mellan proteiner från båda sidor. Ändå gör membranen i dessa organeller inte smälter inom dessa områden, så att de behåller sina separata enheter. De mams spelar en avgörande roll i kalcium (Ca2 +) och fosfolipid överföring från ER till mitokondrierna, påverkar energimetabolism och cellöverlevnad 1-3.
Sambandet mellan ER och mitokondrier först visualiseras på 1970-talet med elektronmikroskopi. Sedan dess transmissionselektronmikroskopi 4,5 elektron tomografi 6,7 eller immun lokalisering av ER och mitokondrier specifika fluoroforens / fluorescerande proteiner 8 var klassiskt använts för att studera ER-mitokondrier interaktioner. En annan användbar verktyg för analys av MAM är baserad på användningen av subcellulär fraktionering. Den tillåter isolering av MAM fraktioner genom differentiell ultracentrifugering kopplad till en Percoll gradient 9. Men innehåller slutprodukten anrikade MAM fraktioner, snarare än rena fraktioner. Helt och hållet, är dessa strategier inte särskilt känsliga och / eller kvantitativ, och de är inte lätta att stora screening. Alternativt har genetiska tillvägagångssätt med läkemedels inducerbar fluorescerande interorganell linkers framkommit, men de tillåter inte analysen av organell interaktion på endogena expressionsnivåer av proteiner 10.
Baserat på Szabadkai upptäckt av IP3R / GRP75 / VDAC komplexet vid MAM 11, utvecklade vi en kvantitativ metod för att analysera ER-mitokondrier interaktioner. Vi använde in situ närhet ligatipå analys för att detektera och kvantifiera interaktioner mellan VDAC1 och IP3R1, två organell-ytproteiner som är inblandade i Ca 2 + -channeling komplexet vid MAM-gränssnittet i fixerade celler 12. I korthet sonde vi VDAC1 vid den yttre mitokondriemembranet (mus-anti-VDAC1 primär antikropp) och IP3R1 vid ER-membranet (kanin-anti-IP3R1 primär antikropp) (figur 1, fält A). Sedan, enligt analysen, tillsatte vi både anti-mus- och anti-kanin IgG (mus och kanin närhet ligering analyssonder), som är konjugerade till komplementära oligonukleotid-förlängningar. Om de två riktade proteinerna är på ett avstånd under 40 nm, kan oligonukleotiderna hybridisera med anslutnings oligos därefter tillsatta för att tillåta bildningen av en cirkulär DNA-mall (Figur 1, panel b). Detta cirkulär DNA-molekyl ligeras och förstärks, vilket skapar en enda DNA-produkt kovalent fäst till en av närhetssonder (Figur 1, panel C) </strong>. Eftersom avståndet mellan ER och mitokondrier vid MAM gränssnittet varierar från 10 nm till 25 nm 6, närhet ligering och amplifiering kan ske, vilket leder till efterföljande detektering på grund av hybridisering av Texas Red-märkta oligonukleotidprober (fig 1, panel D ). Varje fluorescerande prick representerar interaktioner mellan VDAC1 / IP3R1, vilket möjliggör kvantifiering av in situ ER-mitokondrier interaktioner i enskilda celler.
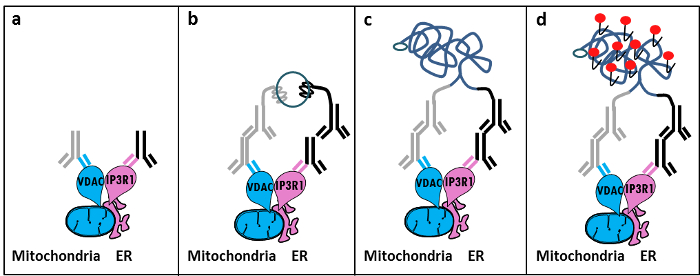
Figur 1: Schematisk illustration av detektion av det endoplasmatiska retiklet-mitokondrier interaktioner med In Situ Proximity Ligation Assay. a) En mus primär antikropp riktad mot VDAC1 och en kanin primär antikropp riktad mot IP3R1 kan binda till deras epitoper i närhet vid MAM gränssnitt, b) Tillsats av ett par av närhets ligerings proberriktat mot mus och kanin-IgG. Dessa sönder har fäst DNA-strängar som kan bilda mallar för ligeringen av anslutnings oligos. c) Det cirkulära DNA-strängen som bildas efter ligation kan förstärkas och d) visualiseras genom mikroskop som en fluorescerande prick med Texas Red-märkta oligonukleotider. Klicka här för att se en större version av denna siffra.
Liknande in situ närhet ligerings analysexperiment kan utföras med GRP75 / IP3R1 par av antikroppar, såväl som cyklofilin D (CypD) / IP3R1 antikroppar, med tanke på att CypD visades interagera med IP3R / GRP75 / VDAC komplexet vid MAM gränssnittet 12-14.
Protocol
Representative Results
Discussion
Collectively, our studies indicate that the in situ proximity ligation assay is truly a relevant strategy to follow and quantify endogenous ER-mitochondria interactions in fixed cells, without the need for using organelle-specific fluorophores or fluorescent proteins. The specific use of VDAC1/IP3R1 antibodies has been adapted to study ER-mitochondria interactions in HuH7 cells. However, alternative isoforms of VDAC and IP3R may be used, depending on the cell type. In this case, antibodies need to be validated b…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi tackar alla människor i vårt laboratorium som har bidragit till att optimera och validera protokoll. Detta arbete stöddes av INSERM och nationella forskningsinstitut (ANR-09-JCJC-0116 OCH ANR-11-BSV1-033-02). ET stöddes under sin doktorsexamen från en forskartjänst från det franska ministeriet för högre utbildning och forskning.
Materials
| Formaldehyde | Sigma | F-8775 | |
| Glycine | Sigma | G-8898 | |
| Triton | Sigma | T8532 | |
| 35mm Glass bottom culture dishes | MatTeK corporation | P35G-0-14-C | |
| Blocking solution | Sigma | DUO-92004 or DUO-92002 | provided in the Duolink PLA probes, Sigma |
| VDAC1 antibody | Abcam | ab14734 | |
| IP3R1-H80 antibody | Santa Cruz | sc28614 | |
| CypD antibody | Abcam | ab110324 | |
| Grp75 antibody | Santa Cruz | sc13967 | |
| TBS 10X | euromedex | ET220 | Dilute to obtain 1X |
| Tween 100X | euromedex | 2001-B | dilute in TBS to obtain 0,01% |
| PLA Probes Mouse MINUS | Sigma | DUO-92004 | Duolink, Sigma |
| PLA Probes Rabbit PLUS | Sigma | DUO-92002 | Duolink, Sigma |
| Duolink detection reagents red | Sigma | DUO-92008 | Duolink, Sigma |
| Ligation solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Ligase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Amplification solution | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Polymerase | Sigma | DUO-92008 | Part of the Duolink detection reagents red, Sigma |
| Duolink Mounting Medium | Sigma | DUO80102 | Duolink, Sigma |
| Softwares: | |||
| Blob-finder software | BlobFinder is a freely distributed software that can perform calculations on cells from fluorescence microscopy images. This software can be downloaded for free from The Centre for Image Analysis at Uppsala University who have developed the software and the work was supported by the EU FP6 Project ENLIGHT and Olink Bioscience. http://www.cb.uu.se/~amin/BlobFinder/index_files/Page430.htm | ||
| ImageJ software | Can be downloaded for free from: http://rsb.info.nih.gov/ij/download.html |
References
- Bravo-Sagua, R., et al. Organelle communication: signaling crossroads between homeostasis and disease. The international journal of biochemistry & cell biology. 50, 55-59 (2014).
- Giorgi, C., et al. Mitochondria-associated membranes: composition, molecular mechanisms, and physiopathological implications. Antioxidants & redox signaling. 22, 995-1019 (2015).
- Phillips, M. J., Voeltz, G. K. Structure and function of ER membrane contact sites with other organelles. Nature reviews. Molecular cell biology. 17, 69-82 (2016).
- Cosson, P., et al. The RTM resistance to potyviruses in Arabidopsis thaliana: natural variation of the RTM genes and evidence for the implication of additional genes. PLoS One. 7, 39169 (2012).
- Mannella, C. A. Structure and dynamics of the mitochondrial inner membrane cristae. Biochim Biophys Acta. 1763, 542-548 (2006).
- Csordas, G., et al. Structural and functional features and significance of the physical linkage between ER and mitochondria. The Journal of cell biology. 174, 915-921 (2006).
- Mannella, C. A., Buttle, K., Rath, B. K., Marko, M. Electron microscopic tomography of rat-liver mitochondria and their interaction with the endoplasmic reticulum. Biofactors. 8, 225-228 (1998).
- Rizzuto, R., et al. Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+ responses. Science. 280, 1763-1766 (1998).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nat Protoc. 4, 1582-1590 (2009).
- Csordas, G., et al. Imaging interorganelle contacts and local calcium dynamics at the ER-mitochondrial interface. Mol Cell. 39, 121-132 (2010).
- Szabadkai, G., et al. Chaperone-mediated coupling of endoplasmic reticulum and mitochondrial Ca2+ channels. J Cell Biol. 175, 901-911 (2006).
- Tubbs, E., et al. Mitochondria-associated endoplasmic reticulum membrane (MAM) integrity is required for insulin signaling and is implicated in hepatic insulin resistance. Diabetes. 63, 3279-3294 (2014).
- Paillard, M., et al. Depressing Mitochondria-Reticulum Interactions Protects Cardiomyocytes From Lethal Hypoxia-Reoxygenation Injury. Circulation. 128, 1555-1565 (2013).
- Rieusset, J., et al. Disruption of calcium transfer from ER to mitochondria links alterations of mitochondria-associated ER membrane integrity to hepatic insulin resistance. Diabetologia. 59, 614-623 (2016).
- Allalou, A., Wahlby, C. BlobFinder, a tool for fluorescence microscopy image cytometry. Computer methods and programs in biomedicine. 94, 58-65 (2009).
- Theurey, P., et al. Mitochondria-associated endoplasmic reticulum membranes allow adaptation of mitochondrial metabolism to glucose availability in the liver. Journal of molecular cell biology. , (2016).
- de Brito, O. M., Scorrano, L. Mitofusin 2 tethers endoplasmic reticulum to mitochondria. Nature. 456, 605-610 (2008).
- Soderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nature methods. 3, 995-1000 (2006).
- De Pinto, V., Messina, A., Lane, D. J., Lawen, A. Voltage-dependent anion-selective channel (VDAC) in the plasma membrane. FEBS letters. 584, 1793-1799 (2010).
- Kaul, S. C., Taira, K., Pereira-Smith, O. M., Wadhwa, R. Mortalin: present and prospective. Experimental gerontology. 37, 1157-1164 (2002).

