Un système microfluidique avec Patterning de surface pour les enquêtes cavitation Bubble (s) Interaction -Cell et les effets biologiques résultantes au niveau d'une seule cellule
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
Dans ce manuscrit, nous décrivons d'abord le protocole de fabrication d'une puce microfluidique, avec des points d'or et des régions revêtues de fibronectine sur le même substrat de verre, qui contrôle précisément la génération de bulles en tandem et des cellules individuelles à motifs à proximité avec des emplacements bien définis et des formes. On démontre ensuite la génération de bulles en tandem en utilisant deux lasers puisés illuminant une paire de points d'or avec un temps de retard peu microsecondes. Nous visualisons l'interaction bulle-bulle et la formation de jet par imagerie à haute vitesse et de caractériser le champ d'écoulement résultante à l'aide d'images de particules (PIV). Enfin, nous présentons quelques applications de cette technique pour l'analyse cellulaire unique, y compris la cellule poration de la membrane avec absorption macromolécule, déformation de la membrane localisée déterminée par les déplacements des billes de intégrine de liaison attachés, et la réponse de calcium intracellulaire de l'imagerie ratiométrique. Nos résultats montrent que un flux d'éjection rapide et directionnelle est proproduite par l'interaction tandem bulle, qui peut imposer une contrainte de cisaillement très localisée sur la surface d'une cellule cultivée à proximité. En outre, les différents effets biologiques peuvent être induites en modifiant la résistance de l'écoulement de jet en réglant la distance de sécurité de la cellule pour les bulles en tandem.
Introduction
Il y a une reconnaissance croissante que l' hétérogénéité cellulaire, résultant de l'expression stochastique des gènes, des protéines et des métabolites, existe au sein d' une grande population de cellules et sert un principe fondamental en biologie pour permettre l'adaptation de la cellule et de l' évolution 1. Par conséquent, il est souvent imprécis et peu fiable pour utiliser des mesures en vrac sur la population pour comprendre la fonction des cellules individuelles et de leurs interactions. Le développement de nouvelles technologies pour l' analyse unicellulaire est donc d' un grand intérêt dans la recherche biologique et pharmacologique, et peut être utilisé, par exemple, pour mieux comprendre les voies et les processus de signalisation clés en biologie des cellules souches et la thérapie du cancer 2-4. Au cours des dernières années, l'émergence de plates – formes microfluidiques a grandement facilité l' analyse unicellulaire, où le positionnement, le traitement et l' observation de la réponse de cellules individuelles ont été réalisées avec des stratégies d' analyse nouvelles 5.
Cavitation joue un rôle important dans un large éventail d'applications biomédicales, y compris le traitement des cancers par ultrasons focalisés de haute intensité (HIFU) 6, la fragmentation non-invasive de calculs rénaux par lithotritie par ondes de choc (SWL) 7, l' administration de médicaments ou d'un gène par sonoporation 8, et la destruction récemment rapporté des cellules ou des tissus par hydrodynamique bulle cavitation 9,10. Malgré cela, les processus dynamiques de bulle (s) de cavitation interactions avec les tissus biologiques et les cellules ne sont pas bien compris. Ceci est dû au caractère aléatoire de cavitation d'initiation et de bulle dynamique produites par les ultrasons, les ondes de choc et de la pression hydraulique locale; en outre, il y a un manque de permettre des techniques pour résoudre les réponses intrinsèquement complexes et rapides de cellules biologiques, en particulier au niveau d'une seule cellule.
En raison de ces défis, il est pas surprenant que très peu d'études ont abeillen signalé pour étudier les interactions bulle de cellules dans des conditions expérimentales bien contrôlées. Par exemple, la poration de la membrane des cellules individuelles en suspension piégée 11 et la grande déformation impulsif des globules rouges humains 12 ont été démontrées en utilisant des bulles générées par laser uniques dans des canaux microfluidiques. Cette dernière technique, cependant, ne peut produire de très petites déformations dans des cellules eucaryotes en raison de la présence du noyau 13. Par ailleurs, il est difficile de contrôler les effets biologiques en aval lorsque l'on traite les cellules en suspension. Dans d' autres études, l' échographie excitation d'un micro – bulles lié à la cellule (ou agent de contraste pour ultrasons) pour produire la poration de la membrane et / ou des réponses du calcium intracellulaire dans les cellules adhérentes individuelles a été rapporté 8. Membrane poration de cellules adhérentes simples peut également être produit en utilisant des bulles tandem laser généré dans une mince couche de liquide contenant Trypan solution bleu absorbant la lumière 14, oupar une bulle de gaz oscillante produite par des impulsions laser d' une microseconde irradiant au moyen d' un substrat optiquement absorbant dans microchambres 15. Par comparaison, le substrat d'absorption optique présente un avantage par rapport à la solution de bleu de Trypan laser absorbant parce que ce dernier est toxique pour les cellules. Plus important encore, les bulles de laser générées sont plus contrôlable en termes de taille des bulles et de l'emplacement que des bulles acoustiquement excités. Néanmoins, dans toutes ces études antérieures, la forme de la cellule, l' orientation et les conditions d'adhésion ne sont pas contrôlées, ce qui peut influencer sensiblement la réponse cellulaire et bioeffets produites par des contraintes mécaniques 16.
Pour remédier à ces inconvénients dans les études précédentes, nous avons récemment mis au point un système expérimental pour la génération de bulles, patron de cellules, interactions bulle-bulle de cellules, et en temps réel des essais biologiques de la réponse cellulaire dans une puce microfluidique construit en utilisant une combinaison unique de microfabrication techniques. Les trois principales caractéristiques qui distinguent notre système expérimental des autres dans le domaine sont: 1) la formation de motifs de points d'or de taille micronique sur le substrat de verre pour permettre l' absorption du laser localisé pour la génération de bulles 17; 2) la formation de motifs d'îlots de taille micronique de la matrice extracellulaire (ECM) pour l'adhérence des cellules sur le même substrat pour contrôler à la fois l'emplacement et la géométrie des cellules individuelles; et 3) la compression de la dimension du domaine d'interaction bulle-bulle-cellule de la 3D à un espace-2D quasi pour faciliter la visualisation dans le plan d'interactions bulle-bulle, jet champs d'écoulement, la déformation de la cellule, et bioeffets, tous capturés dans une séquence d'imagerie simplifiée (figure 1d).
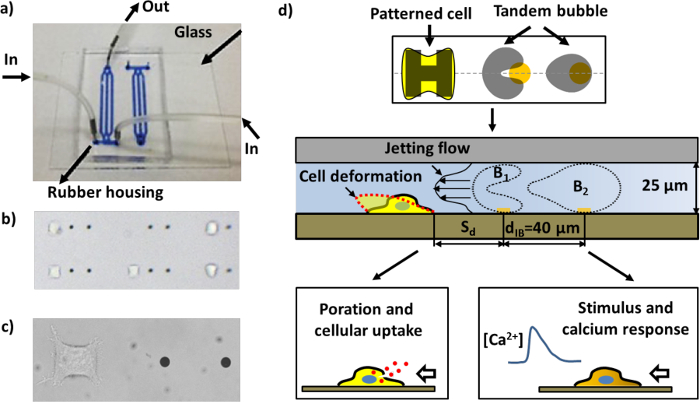
Figure 1: La puce et les schémas des différents dosages microfluidique. a) Une puce microfluidique assemblé avec des canaux rempli d'encre bleue pour la visualisation. b) une région à l' intérieur de la puce microfluidique avec des cellules à motifs et les points d'or (la distance entre les deux points d'or à proximité de 40 um). De nombreuses paires d'unités de travail peuvent être disposés dans un canal. c) l' image Close-up d'une unité de travail unique constitué d'une paire de points d'or et une cellule HeLa adhéré à la région de cellule de motif. d) Représentation schématique du fonctionnement du dispositif. Une seule cellule adhère et se répand sur le "H" île en forme revêtue de fibronectine. Une paire de bulles de cavitation (tandem à bulles) avec opposition de phase d' oscillation sont produites par des faisceaux lumineux de laser pulsé sur les points d'or (voir la figure 4a), conduisant à la génération d'un jet rapide et localisée se déplaçant vers la cellule cible à proximité. La cellule peut être déformé, porée pour l' absorption macromoléculaire, et / ou stimuler une réponse de calcium, en fonction de la distance de sécurité (S d) de la cellule à la bulle en tandem.f = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg" target = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Cette plate-forme peut être combiné avec des dosages de fluorescence et des billes fonctionnalisées fixées à la surface cellulaire pour les effets biologiques induits par cavitation. En particulier, cette plate-forme ouvre la voie à des tests fiables et quantifiables au niveau d'une seule cellule. Jusqu'à présent, nous avons utilisé le dispositif pour l'analyse des bulles d'air en tandem induit la déformation de la membrane cellulaire, la poration de la cellule et l'absorption intracellulaire, la viabilité, l'apoptose et la réponse du calcium intracellulaire. Dans le protocole suivant, nous décrivons le processus de fabrication de puces et de la procédure d'analyse des divers effets biologiques mentionnés ci-dessus. Par ailleurs, les opérations de la puce sont également décrits.
Protocol
Representative Results
Discussion
Analyse unicellulaire, en combinaison avec l' imagerie des cellules vivantes, a grandement amélioré notre compréhension des processus dynamiques et souvent variables dans des cellules individuelles, telles que le développement du phénotype et la réponse immunitaire 23. Contrairement à la culture cellulaire classique dans des boîtes ou flacons, systèmes microfluidiques permettent un contrôle précis du microenvironnement, jusqu'au niveau d'une seule cellule, en temps réel. Par conséquen…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
References
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

