En mikrofluidsystem med Surface mønster for Undersøgelse Kavitation Bubble (r)-Cell Interaktion og de resulterende bioeffekter på Single-celle niveau
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
I dette manuskript, vi først beskrive fremstillingen protokollen for en mikrofluid chip, med guld prikker og fibronectincoatede regioner på samme glassubstrat, at netop styrer genereringen af tandem bobler og individuelle celler mønstrede nærheden med veldefinerede steder og former. Vi viser derefter frembringelsen af tandem bobler ved anvendelse af to pulserende lasere lysende et par guld prikker med et par-mikrosekund tidsforsinkelse. Vi visualisere boble-boble interaktion og jet dannelse ved høj hastighed billedbehandling og karakterisere det resulterende flow felt ved hjælp partikel billede Velocimetri (PIV). Endelig præsenterer vi nogle anvendelser af denne teknik til enkelt-celle analyse, herunder cellemembranen porering med makromolekyle optagelse, lokaliseret membran deformation bestemmes af forskydningerne af vedlagte integrin-bindende perler, og intracellulært calcium respons fra ratiometrisk billeddannelse. Vores resultater viser, at en hurtig og retningsbestemt jetting flow er proindført ved tandem boble interaktion, der kan pålægge en meget lokal forskydningsspænding på overfladen af en celle dyrkes i umiddelbar nærhed. Endvidere kan forskellige biologiske virkninger fremkaldes ved at ændre styrken af jetting flow ved at justere standoff afstand fra cellen til tandem bobler.
Introduction
Der er en voksende erkendelse af, at cellulær heterogenitet, som følge af stokastiske ekspression af gener, proteiner og metabolitter, der findes i en stor celle population og fungerer som et grundlæggende princip i biologi at give mulighed for celle tilpasning og evolution 1. Derfor er det ofte unøjagtige og upålidelige til at bruge befolkningsbaserede bulk-målinger til at forstå funktionen af de enkelte celler og deres samspil. Udvikling af nye teknologier til enkelt-celle analyse er derfor af stor interesse i biologisk og farmakologisk forskning, og kan bruges, for eksempel, for bedre at forstå de centrale signalveje og processer i stamcellebiologi og kræft terapi 2-4. I de senere år har fremkomsten af mikrofluide platforme lettet betydeligt encellede analyse, hvor positionering, behandling og observation af svaret fra individuelle celler er blevet udført med hidtil ukendte analytiske strategier 5.
Kavitation spiller en vigtig rolle i en bred vifte af biomedicinske anvendelser, herunder behandling af kræft med høj intensitet fokuseret ultralyd (HIFU) 6, den ikke-invasiv fragmentering af nyresten ved trykbølge lithotripsi (SWL) 7, lægemiddel eller genafgivelse ved sonoporation 8, og den nyligt rapporterede destruktion af celler eller væv ved hydrodynamisk boble kavitation 9,10. På trods af dette, de dynamiske processer i kavitation boble (r) interaktioner med biologisk væv og celler er ikke blevet forstået. Dette skyldes tilfældighed i kavitation initierings- og boble dynamik fremstillet ved ultralyd, chokbølger, og lokalt hydraulisk tryk; desuden er der en mangel på muliggøre teknikker til at løse de iboende komplekse og hurtige reaktioner af biologiske celler, især på enkeltcelle-niveau.
På grund af disse udfordringer, er det ikke overraskende, at meget få undersøgelser har bin rapporteret at undersøge boble-celle-interaktioner under velkontrollerede eksperimentelle betingelser. F.eks membran porering af individuelle celler fanget i suspension 11 og den impulsive store deformation af humane røde blodceller 12 er blevet påvist under anvendelse af laser-genereret enkelt bobler i mikrofluidkanaler. Sidstnævnte teknik kan imidlertid kun producere meget lille deformation i eukaryote celler på grund af tilstedeværelsen af kernen 13. Desuden er det vanskeligt at overvåge downstream biologiske virkninger ved behandling celler i suspension. I andre undersøgelser har ultralyd excitation af en cellebundet mikroboble (eller ultralydkontrastmidlet) til fremstilling af membran porering og / eller intracellulære calcium reaktioner i enkelte adhærente celler blevet rapporteret 8. Membran porering af enkelte adhærente celler kan også fremstilles ved hjælp af laser-genereret tandem bobler i et tyndt væskelag, som indeholder lys-absorberende Trypan blå opløsning 14, ellermed et oscillerende gasboble genereret af mikrosekund laserimpulser bestråler gennem en optisk absorberende substrat i microchambers 15. Sammenlignet, den optisk absorberende substrat har en fordel i forhold laser-absorberende Trypan blå opløsning, fordi sidstnævnte er toksiske for celler. Endnu vigtigere er, laser-genererede bobler er mere kontrollerbar i form af boble størrelse og placering end akustisk ophidset bobler. Ikke desto mindre, i alle disse tidligere undersøgelser, de celle form, orientering og vedhæftning betingelser blev ikke kontrolleret, der kan have væsentlige påvirke celle respons og biologiske virkninger produceret af mekaniske påvirkninger 16.
For at overvinde disse ulemper i tidligere undersøgelser, har vi for nylig udviklet en eksperimentel system til boble generation, celle mønsterdannelse, boble-boble-celle-interaktioner og real-time bioassays af celle respons i et mikrofluid chip konstrueret ved hjælp af en unik kombination af mikrofabrikation techniques. Tre vigtigste funktioner, der adskiller vores eksperimentelle system fra andre på området, er: 1) mønsterdannelse af mikrometerstore guld prikker på glassubstratet at muliggøre lokaliseret laser absorption for boble generation 17; 2) mønsterdannelse af mikrometerstørrelse øer af ekstracellulær matrix (ECM) for celleadhæsion på det samme substrat at kontrollere både placeringen og geometrien af individuelle celler; og 3) komprimering af dimensionen af boblen-boble-celle interaktion domæne fra 3D til en kvasi-2D plads til at lette i planet visualisering af boble-boble-interaktioner, jetting strømningsfelter, cell deformation og biologiske virkninger, alle fanget i en strømlinet billeddannelse sekvens (figur 1d).
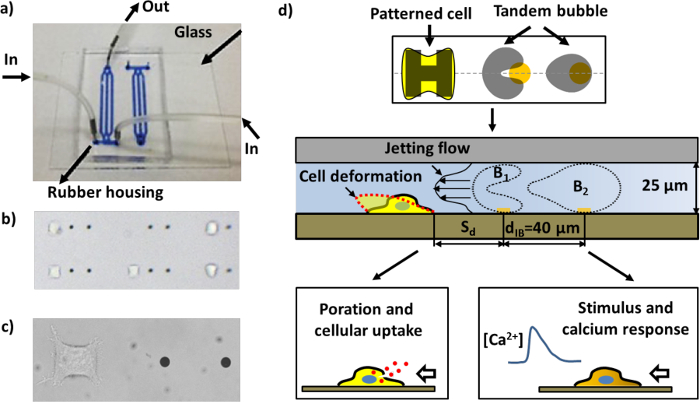
Figur 1: Den mikrofluid chip og Skema af forskellige analyser. a) Et samlet mikrofluid chip med kanaler fyldt med blåt blæk til visualisering. b) En region inde i mikrofluid chip med mønstrede celler og guld prikker (afstanden mellem de to guld prikker i nærhed er 40 um). Mange par af arbejdsenheder kan arrangeres i en kanal. c) Close-up billede af en enkelt arbejdsgruppe bestående af et par guld prikker og en HeLa celle klæbet til den celle-mønster region. d) Skematisk af enhedens funktion. En enkelt celle klæber til og spredes i den "H" -formede ø overtrukket med fibronectin. Et par kavitationsbobler (tandem boble) med anti-fase svingning frembringes ved belysning pulseret laserstråler på guld prikker (se figur 4a), hvilket fører til dannelsen af en hurtig og lokaliseret jet hen imod målcellen nærheden. Cellen kan deformeres, porerede for makromolekylær optagelse, og / eller stimuleret med en calcium respons, afhængigt af standoff afstand (S d), i cellen til tandem boble.f = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg" target = "_ blank"> Klik her for at se en større version af dette tal.
Denne platform kan yderligere kombineres med fluorescens assays og funktionaliserede perler knyttet til celleoverfladen for kavitation-induceret bioeffekter. Især denne platform baner vejen for pålidelige og kvantificerbare analyser på enkelt-celle niveau. Indtil nu har vi anvendt indretningen til analyse af tandem boble-induceret cellemembranen deformation, celle porering og intracellulære optagelse, levedygtighed, apoptose, og intracellulært calcium respons. I den følgende protokol beskriver vi processen med chip fabrikation og proceduren for at analysere de forskellige biologiske virkninger nævnt ovenfor. Desuden er driften af chippen også beskrevet.
Protocol
Representative Results
Discussion
Single-celle analyse, i kombination med live-cell imaging, har i høj grad forbedret vores forståelse af de dynamiske og ofte variable processer i de enkelte celler, såsom fænotype udvikling og immunrespons 23. I modsætning til den konventionelle cellekultur i skåle eller kolber, mikrofluide systemer gør det muligt præcis styring af mikromiljøet, ned til den encellede niveau, i realtid. Derfor fremskridt i mikrofluid teknologi og teknikker har i høj grad forbedret gennemløb og reproducerbarhed af en…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
References
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

