Multi-trinns variabel Høyde Fotolitografi for Valved Multilayer microfluidic enheter
Summary
Multilayer microfluidic devices often involve the fabrication of master molds with complex geometries for functionality. This article presents a complete protocol for multi-step photolithography with valves and variable height features tunable to any application. As a demonstration, we fabricate a microfluidic droplet generator capable of producing hydrogel beads.
Abstract
Microfluidic systems have enabled powerful new approaches to high-throughput biochemical and biological analysis. However, there remains a barrier to entry for non-specialists who would benefit greatly from the ability to develop their own microfluidic devices to address research questions. Particularly lacking has been the open dissemination of protocols related to photolithography, a key step in the development of a replica mold for the manufacture of polydimethylsiloxane (PDMS) devices. While the fabrication of single height silicon masters has been explored extensively in literature, fabrication steps for more complicated photolithography features necessary for many interesting device functionalities (such as feature rounding to make valve structures, multi-height single-mold patterning, or high aspect ratio definition) are often not explicitly outlined.
Here, we provide a complete protocol for making multilayer microfluidic devices with valves and complex multi-height geometries, tunable for any application. These fabrication procedures are presented in the context of a microfluidic hydrogel bead synthesizer and demonstrate the production of droplets containing polyethylene glycol (PEG diacrylate) and a photoinitiator that can be polymerized into solid beads. This protocol and accompanying discussion provide a foundation of design principles and fabrication methods that enables development of a wide variety of microfluidic devices. The details included here should allow non-specialists to design and fabricate novel devices, thereby bringing a host of recently developed technologies to their most exciting applications in biological laboratories.
Introduction
For de siste 15 årene har MicroFluidics som et felt gjennomgått en rask vekst, med en eksplosjon av nye teknologier som muliggjør manipulering av væsker i mikrometer skala 1. Microfluidic systemer er attraktive plattformer for våt laboratorium funksjonalitet fordi de små volumer har potensial til å realisere økt hastighet og følsomhet, mens på samme tid dramatisk øke gjennomstrømningen og redusere kostnadene ved å utnytte stordriftsfordeler to, tre. Multilayer microfluidic systemer har gjort særlig store virkninger i high-throughput biokjemiske analyseprogrammer som enkelt celle analyse 4, 5, 6, enkelt molekyl analyse (f.eks digital PCR 7), protein krystallografi 8, transkripsjonsfaktor bindingsanalyserf "> 9, 10, og cellulær screening 11.
Et sentralt mål for MicroFluidics har vært utviklingen av "lab på en brikke" enheter i stand til å utføre komplekse fluidic manipulasjoner innenfor en enkelt enhet for total biokjemisk analyse 12. Utviklingen av multi-lags myk litografi teknikker har hjulpet realisere dette målet ved å muliggjøre etableringen av on-chip ventiler, miksere, og pumper for aktivt å kontrollere væsker i små volumer 13, 14, 15. Til tross for sine fordeler og demonstrerte applikasjoner, mange av disse teknologiene microfluidic forblir stort sett unharnessed av ikke-spesialist brukere. Utbredt adopsjon har vært utfordrende delvis på grunn av begrenset tilgang til microfabrication anlegg, men også på grunn av mangelfull kommunikasjon av fabrikasjon teknikker. Dette gjelder særlig for flerlags microfluidic enheter med strukturer for ventiler eller komplekse geometrier: mangelen på detaljert, praktisk informasjon om viktige designparametre og fabrikasjon teknikker avskrekker ofte nye forskere fra fatt på prosjekter som involverer design og etablering av disse enhetene.
Denne artikkelen tar sikte på å løse dette kunnskapsgapet ved å presentere et komplett protokoll for å lage flerlags microfluidic enheter med ventiler og variable høyde funksjoner, fra design parametere og beveger seg gjennom alle fabrikasjons trinn. Ved å fokusere på de første fotolitografi trinnene fabrikasjon, utfyller denne protokollen andre MicroFluidics protokoller 16 som beskriver nedstrøms trinn avstøpning enheter fra muggsopp og kjører konkrete eksperimenter.
Microfluidic enheter med monolittisk on-chip ventiler er sammensatt av to lag: et "flow" lag, hvor fluidet av interesse blir manipulert i mikrokanaler og en "kontroll" lag, hvor mikrokanaler inneholdende luft eller vann kan selektivt modulere fluidstrømning i strømningssjiktet 14. Disse to lagene er hver fremstilt på en separat silisiumstøpe master, som senere brukes til polydimetylsiloksan (PDMS) replika støping i en prosess som kalles "myklitografi 17". For å danne en flerlags enhet, er hvert av de PDMS lag støpt på de respektive støpe herrer og deretter justert til hverandre, for derved å danne en sammensatt enhet PDMS med kanaler på hvert lag. Ventiler er dannet ved steder hvor strømnings og styrekanaler som krysser hverandre og er adskilt med bare en tynn membran; trykksetting av styrekanalen avbøyes denne membranen for å tilstoppe strømningskanalen og lokalt fortrenge væske (figur 1).
Aktive on-chip ventiler kan fremstilles på flere måter, avhengig av den ønskede endelige anvendelse. ventilerkan konfigureres enten i en "push down" eller "push-up" geometri, avhengig av om kontrollsjiktet er over eller under det strømnings laget (figur 1) 15. "Push up" geometrier tillate lavere avsluttende trykk og høyere enhets stabilitet mot delaminering, mens "trykk ned" geometrier tillate strømningskanalene å være i direkte kontakt med den bundne substrat, overdragelse fordelen av selektiv funksjonalisering eller mønstring av substratoverflaten for senere funksjonalitet 18 19.
Ventilene kan også være enten med vilje er utett "sil" ventiler eller fullstendig lukkbar, avhengig av tverrsnittsprofilen av strømningskanalen. Sikt ventiler er nyttige for å fange perler, celler eller andre macroanalytes 1, og er fabrikkert ved bruk av typiske negative fotoresister (dvs. SU-8-serien), som hektarve rektangulære profiler. Når en styrekanal er satt under trykk over disse ventil regioner, PDMS membran mellom kontroll- og strømnings lag avbøyer isotropisk inn i den rektangulære profil av ventilen uten å forsegles i hjørnene, hvilket tillater fluidstrømning, men fanger makrokalkpartikler (figur 1). Omvendt er fullt sealable microfluidic ventiler fabrikkert ved å inkludere en liten oppdatering av avrundet fotoresist på ventil steder. Med denne geometri, trykksetting av styrekanalen avbøyer membranen mot den avrundede strømningssjiktet for fullstendig å forsegle kanalen, stoppe fluidstrømmen. Avrundede profiler i flyten laget genereres via smelting og flyt av positiv fotoresist (f.eks AZ50 XT eller SPR 220) etter typiske fotolitografi trinn. Vi har tidligere vist at post-reflow høyder av ventil regioner avhenger av valgt har dimensjoner 21. Denne protokollen demonstrerer fremstillingen av begge ventil geometrier medi en kule syntese-enhet.
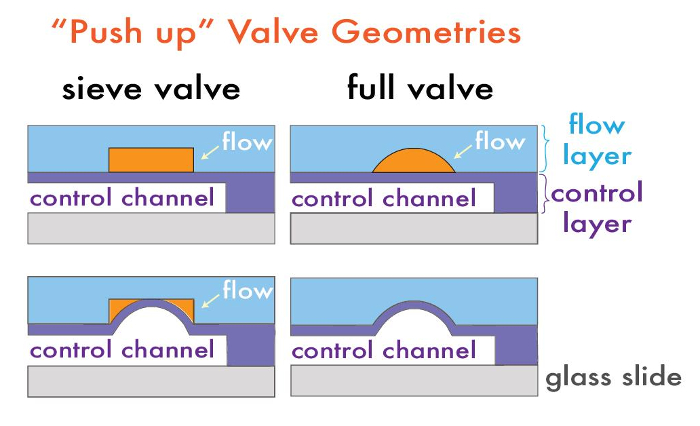
Figur 1: Multilayer microfluidic Valve geometrier. Typiske "Push up" enhets arkitekturer for sil og fullt forseglbare ventiler før (øverst) og etter (nederst) trykksetting. Klikk her for å se en større versjon av dette tallet.
Enheter kan også inkludere komplekse passive funksjoner som kaotiske miksere 13 og on-chip motstander 20 som krever funksjonene i flere forskjellige høyder i én flyt lag. For å oppnå en variabel høyde flyt laget, har ulike grupper benyttet mange metoder inkludert kretskort etsning 22, flerlags PDMS lettelse justering 23 eller flere trinn photolithography 24. Vår gruppe har funnet flere trinn fotolitografi på en enkelt støpehoved for å være en effektiv og reproduserbar metode. For å gjøre dette, er en enkel fotolitografi teknikken med å bygge tykke kanaler med negativ fotoresist (f.eks SU-8-serien photoresists) i lag uten utvikling i mellom påføring av hvert lag ansatt. Hvert lag er spunnet i negativ fotoresist ifølge sin tykkelse ved hjelp av produsentens instruksjoner 25 på silisium mester. Trekk ved denne høyde blir så mønstret på laget ved hjelp av en spesifikk transparent maske (figur 2) som er festet til en glassplate maske og justert til tidligere spunnet lag før eksponering. I flertrinnsfotolitografi, er nøyaktig innretting mellom lag kritisk i å danne en komplett variabel høyde strømningskanal. Etter innretting, hvert lag er underkastet en tykkelse avhengig post-eksponering bake. Uten utvikling, er neste lag similarly mønstret. På denne måte kan høy funksjoner bygges opp på en enkelt strømnings wafer lag-for-lag til ved bruk av flere masker. Ved å hoppe utvikling mellom hvert trinn, kan tidligere fotoresist lag brukes til å generere sammensatte høyde egenskaper (dvs, kan to 25 um lag lage en 50 um funksjon) 24. I tillegg kan kanal gulv funksjoner som kaotisk blande fiskebein sporene 13 gjøres ved hjelp av lag med tidligere utsatt funksjoner. En siste utviklingen skritt fullfører prosessen, noe som skaper en enkelt flyt wafer med funksjoner av variabel høyde (figur 3).
Her blir et komplett protokoll for flertrinnsfotolitografi som inkluderer eksempler på alle prosedyrer som er nødvendige for å fremstille on-chip ventiler og strømningskanaler med flere høyder tilgjengelig. Denne fabrikasjon protokoll er presentert i sammenheng med en flerlags mikrofluid vulst synthesizer som krever ventiler og variable-høyden har for sin funksjonalitet. Denne enheten inkluderer T-kryss for generering av vanndråper i en olje skjede, on-chip motstander å modulere strømningsrater gjennom å kontrollere Poiseuilleschen motstand, en kaotisk mikser for homogenisering dråpe komponenter, og begge fullt tetting og sil ventiler for å aktivere automatiserte arbeidsflyter som involverer flere reagent innganger. Ved hjelp av flertrinnsfotolitografi, er disse funksjonene hver fremstilt på et annet lag ifølge høyde eller fotoresist; følgende lag er konstruert i denne protokoll: (1) Strømnings Round ventil sjikt (55 mikrometer, AZ50 XT) (2) Flow Low sjikt (55 mikrometer, SU-8 2050) (3) Strømnings høy sjikt (85 mikrometer, su- 8 2025, 30 um additiv høyde), og (4) Herringbone spor (125 um, SU-8 2025, 40 um additiv høyde) (figur 3).
Hydrogel perler kan brukes til en rekke applikasjoner, inkludert selektive overflaten funksjon for nedstrøms analyser, narkotika innkapsling, radiotracing og avbildningsanalyser og celle innlemmelse; vi tidligere har brukt en mer kompleks versjon av disse enhetene til å produsere spektralt kodede PEG hydrogel perler inneholder lantanidforbindelser nanophosphors 20. Designene diskutert her er inkludert i tilleggsressurser for eventuelle lab å bruke i sine forskningsinnsats hvis ønskelig. Vi forventer at denne protokollen vil gi en åpen ressurs for spesialister og ikke-spesialister alike interessert i å gjøre multi-layer microfluidic enheter med ventiler eller komplekse geometrier å senke barrieren for å komme i MicroFluidics og øke sjansene for fabrikasjon suksess.
Protocol
Representative Results
Discussion
Dette arbeidet viser en komplett flertrinns fotolitografi protokoll for en flerlags microfluidic enhet med ventiler og variabel høyde geometri som kan være innstilt for enhver applikasjon med enkle modifikasjoner til fabrikasjon parametere basert på våre online-verktøy 26 og produsentens instruksjoner 25. Denne protokollen er ment å avmystifisere flerlags fotolitografi for forskere som ønsker å konstruere microfluidic enheter utover enkle, passive ett-lags muggsopp…
Divulgations
The authors have nothing to disclose.
Acknowledgements
The authors thank Scott Longwell for helpful comments and edits to the manuscript and Robert Puccinelli for device photography. The authors acknowledge generous support from a Beckman Institute Technology Development Grant. K.B. is supported by a NSF GFRP fellowship and the TLI component of the Stanford Clinical and Translational Science Award to Spectrum (NIH TL1 TR 001084); P.F. acknowledges a McCormick and Gabilan Faculty Fellowship.
Materials
| Materials | |||
| Mylar Transparency Masks, 5" | FineLine Plotting | ||
| 5" Quartz Plates | United Silica | Custom | |
| 4" Silicon Wafers, Test Grade | University Wafer | 452 | |
| SU8 2005, 2025, 2050 photoresist | Microchem | Y111045, Y111069, Y111072 | |
| Az50XT | Integrated Micromaterials | AZ50XT-Q | |
| SU8 Developer | Microchem | Y020100 | |
| AZ400K 1:3 Developer | Integrated Micromaterials | AZ400K1:3-CS | |
| Pyrex 150 mm glass dish | Sigma-Aldrich | CLS3140150-1EA | |
| Wafer Petri Dishes, 150 mm | VWR | 25384-326 | |
| Wafer Tweezers | Electron Microscopy Sciences (EMS) | 78410-2W | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane (PFOTS) | Sigma-Aldrich | 448931-10G | |
| 2" x 3" glass slides | Thomas Scientific | 6686K20 | |
| RTV 615 elastomeric base and curing agent PDMS set | Momentive | RTV615-1P | |
| Tygon Tubing, 0.02" O.D. | Fischer Scientific | 14-171-284 | |
| Capillary PEEK tubing, 510 um OD, 125 um ID | Zeus | Custom | 360 um PEEK is readily available by Idex (catalog number: 1571) |
| Cyro 4 mL tube | Greiner Bio-One | 127279 | |
| Epoxy, 30-minute | Permatex | 84107 | |
| Metal Pins, 0.025" OD, .013" ID | New England Small Tube | NE-1310-02 | |
| Poly(ethylene glycol) diacrylate, Mn 700 | Sigma-Aldrich | 455008-100ML | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate photoinitator | Tokyo Chemical Industry Co. | L0290 | We typically synthesize LAP in-house. |
| HEPES | Sigma-Aldrich | H4034-25G | |
| Light mineral oil | Sigma-Aldrich | 330779-1L | |
| Span-80 | Sigma-Aldrich | 85548 | |
| ABIL EM 90 | UPI Chem | 420095 | |
| Name | Company | Catalog Number | Comments |
| Equipment | Equivalent equiptment or homebuilt setups will work equally as well | ||
| Mask Aligner | Karl Suss | MA6 | |
| Profilometer | KLA-Tencor | Alpha-Step D500 | |
| Spin Coater | Laurell Technologies | WS-650-23 | Any spincoater can be used that accepts 100 mm wafers |
| Vacuum Dessicator, Bell-Jar Style | Bel-Art | 420100000 | |
| Oven | Cole-Palmer | WU-52120-02 | |
| UV Spot Curing System with 3 mm LLG option | Dymax | 41015 | UV LEDs, Xenon Arc Lamps, or other UV sources of the same intensity work equally as well |
| MFCS Microfluidic Fluid Control System | Fluidgent | MFCS-EZ | Syringe pumps, custom pneumatics or other control systems can also be used |
| Automated control scripting | MATLAB | ||
| Hotplate | Tory Pines Scientific | HP30 | Any hotplate with uniform heating (i.e. aluminum or ceramic plates) will suffice. |
References
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nat. Rev. Mol. Cell Bio. 16 (9), (2015).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev.Mod. Phys. 77 (3), (2005).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), (2006).
- Kalisky, T., Blainey, P., Quake, S. R. Genomic Analysis at the Single-Cell Level. Ann. Rev. of Genetics. 45 (1), (2011).
- Finkel, N. H., Lou, X., Wang, C., He, L. Peer Reviewed: Barcoding the Microworld. Anal. Chem. 76 (19), (2004).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr. Opin. in Chem. Bio. 16 (3-4), (2012).
- White, A. K., Heyries, K. A., Doolin, C., VanInsberghe, M., Hansen, C. L. High-Throughput Microfluidic Single-Cell Digital Polymerase Chain Reaction. Anal. Chem. 85 (15), (2013).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A Microfluidic Device for Kinetic Optimization of Protein Crystallization and In Situ Structure Determination. J. Am. Chem. Soc. 128 (10), (2006).
- Maerkl, S. J., Quake, S. R. A Systems Approach to Measuring the Binding Energy Landscapes of Transcription Factors. Science. 315 (5809), (2007).
- Fordyce, P. M., Gerber, D., et al. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nat. Biotech. 28 (9), (2010).
- Fan, R., et al. Integrated barcode chips for rapid, multiplexed analysis of proteins in microliter quantities of blood. Nat. Biotech. 26 (12), (2008).
- Kovarik, M. L., Gach, P. C., Ornoff, D. M., Wang, Y. Micro total analysis systems for cell biology and biochemical assays. Anal. Chem. , (2011).
- Stroock, A. D., Dertinger, S. K. W., Ajdari, A., Mezić, I., Stone, H. A., Whitesides, G. M. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Unger, M. A., Chou, H. -. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288 (5463), 113-116 (2000).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic Large-Scale Integration. Science. 298 (5593), (2002).
- Li, N., Sip, C., Folch, A. Microfluidic Chips Controlled with Elastomeric Microvalve Arrays. JoVE. (8), e296 (2007).
- Kim, P., et al. Soft lithography for microfluidics: a review. Biochip. J. 2 (1), 1-11 (2008).
- Studer, V., Hang, G., Pandolfi, A., Ortiz, M., Anderson, W. F., Quake, S. R. Scaling properties of a low-actuation pressure microfluidic valve. J. Appl. Phys. 95 (1), 393-398 (2004).
- Kartalov, E. P., Scherer, A., Quake, S. R., Taylor, C. R., Anderson, W. F. Experimentally validated quantitative linear model for the device physics of elastomeric microfluidic valves. J. Appl. Phys. 101 (6), 064505 (2007).
- Gerver, R. E., Gómez-Sjöberg, R., et al. Programmable microfluidic synthesis of spectrally encoded microspheres. Lab. Chip. 12 (22), 4716-4723 (2012).
- Fordyce, P. M., Diaz-Botia, C. A., DeRisi, J. L., Gómez-Sjöberg, R. Systematic characterization of feature dimensions and closing pressures for microfluidic valves produced via photoresist reflow. Lab. Chip. 12 (21), 4287-4295 (2012).
- Li, C. -. W., Cheung, C. N., Yang, J., Tzang, C. H., Yang, M. PDMS-based microfluidic device with multi-height structures fabricated by single-step photolithography using printed circuit board as masters. The Analyst. 128 (9), 1137-1142 (2003).
- Romanowsky, M. B., Abate, A. R., Rotem, A., Holtze, C., Weitz, D. A. High throughput production of single core double emulsions in a parallelized microfluidic device. Lab. Chip. 12 (4), 802-807 (2012).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. JMM. 16 (2), 276 (2006).
- . Rafael’s Microfluidics Site Available from: https://sites.google.com/site/rafaelsmicrofluidicspage/valve-controllers (2016)
- Wanat, S., Plass, R., Sison, E., Zhuang, H., Lu, P. -. H. Optimized Thick Film Processing for Bumping Layers. Proc. SPIE. , 1281-1288 (2003).

