通过细胞因子转导的基质细胞系注射外源性细胞因子在患者来源的异种移植物中的表达
Summary
这里描述了通过每周腹膜内注射细胞因子转导的基质细胞系,在患者来源的异种移植物(PDX)小鼠中产生外源性细胞因子的方法。该方法扩大了PDX的效用,并提供了许多PDX模型中瞬时或持续的外源细胞因子递送的选择。
Abstract
通过将人细胞移植到免疫缺陷小鼠中来产生患者来源的异种移植(PDX)小鼠。这些模型是研究正常和恶性造血机制的重要工具,是确定许多恶性肿瘤的有效化学疗法的黄金标准。 PDX模型是可能的,因为许多小鼠细胞因子也对人细胞起作用。然而,对于所有细胞因子来说,情况并非如此,包括许多对于研究人类细胞中正常和恶性造血作用至关重要的细胞因子。设计小鼠产生人细胞因子(转基因和敲入模型)的技术在模型的有用性已被证明之前需要大量费用。其他技术是劳动密集型(注射重组细胞因子或慢病毒),在某些情况下需要高水平的技术专长(流体动力学注射DNA)。本报告描述了一种产生具有外源性人类细胞的PDX小鼠的简单方法(TSLP,胸腺基质淋巴细胞生成素) 通过每周腹膜内注射已被转导过表达该细胞因子的基质。使用这种方法提供了实现小鼠循环中人细胞因子生理水平的连续细胞因子产生的体内来源。人细胞因子的血浆水平可以基于注射的基质细胞的数量而变化,并且细胞因子产生可以在实验的任何点开始。该方法还包括类似地产生的细胞因子阴性对照小鼠,但是通过腹膜内注射用对照载体转导的基质。我们以前已经表明,与对照PDX相比,从表达TSLP的PDX收获的白血病细胞表现出更像原始患者样品的基因表达模式。通过这种方法产生的细胞因子产生和细胞因子阴性的PDX小鼠一起提供了一个我们已经成功地用于研究的模型系统TSLP在正常和恶性造血中的作用。
Introduction
患者来源的异种移植物(PDX)是一种强大的体内模型,用于研究“天然”哺乳动物环境中正常和恶性造血细胞的产生。最常见的是,通过将人细胞注射或移植到免疫缺陷小鼠中来产生PDX。使用正常人造血干细胞的PDX生产允许对正常人血液和免疫细胞发育的体内研究。由白血病或其他癌细胞产生的PDX可以研究致癌机制,并在人群中存在的遗传景观和突变范围的背景下鉴定有效的治疗方法。 1因此,PDX是目前翻译生物医学研究的黄金标准,用于识别有效的治疗方法,也是理解癌症进展机制的重要工具。 PDX模型是帮助研究健康差异疾病的重要工具遗传病变或任何疾病,其中患者遗传景观的变化可以显着地促成肿瘤形成和治疗结果。
小鼠 – 人PDX模型是可能的,因为许多小鼠细胞因子在它们在小鼠内部时激活人类细胞的细胞因子受体时充分模拟了它们的人类类似物。例如,白细胞介素-7(IL-7)为人B细胞发育提供了关键信号。 2在这种情况下,小鼠IL-7与人IL-7具有足够的同源性,小鼠细胞因子刺激人B细胞前体中的信号通路。 2,3,4然而,胸腺基质淋巴细胞生成素(TSLP),其中其他细胞因子(IL-3,粒细胞 – 巨噬细胞 – 巨噬细胞集落刺激因子(GM-CSF),干细胞因子(SCF) ,对于正常和恶性人造血细胞的生产来说重要的是,当小鼠和人类细胞因子显示出低同源性时,小鼠细胞因子不会在人细胞上激活它们各自的受体,为了克服这个障碍,已经使用了许多策略在PDX小鼠中设计人类细胞因子的表达,包括注射重组人细胞因子,流体动力注射DNA,慢病毒表达,转基因表达和敲入基因置换7本报告介绍了一种通过基质介导的方法制备人类细胞因子细胞因子递送( 图1 )。
在本文所示的方法中,PDX小鼠被工程化以表达人细胞因子,TSLP,或用作细胞因子阴性对照。表达TSLP的PDX通过每周腹膜内注射已被转导以表达高水平人TSLP的基质细胞来实现。细胞因子阴性PDX“对照”小鼠被类似地设计;虽然控制基质用控制载体转导。该方法在注射TSLP +基质的PDX小鼠中达到人TSLP的正常生理水平。在接受细胞因子阴性基质的PDX小鼠中未观察到可检测的TSLP。我们选择人类基质细胞系HS-27A作为我们的研究,因为它在培养中强壮地生长,并且显示非常低水平的细胞因子产生,其不支持共培养物中分离的祖细胞的增殖。 8对于人TSLP表达,使用来自先前描述的骨架9的先进一代自身灭活慢病毒载体转导基质,并且包括cPPT / cts元件和土拨鼠肝炎后转录调节元件(WPRE)以增加转基因表达。在延伸因子-1的控制下将人TSLP基因构建到该载体中(EF-1)α启动子,以实现强壮,组成型和长期表达。
这种人细胞因子增强的PDX模型的工程包括4个主要步骤。首先,转导的基质在体外扩增 ,并通过酶联免疫吸附测定(ELISA)来评估稳定的高水平细胞因子产生。第二,使用磷酸流式细胞术验证转导的基质细胞产生的人细胞因子的活性(和来自对照基质的细胞因子活性的缺乏)。已知对感兴趣的细胞因子(本例中为TSLP)有反应的细胞系与基质细胞上清液一起温育,并测定细胞因子诱导的磷酸化。第三,将小鼠注射转导的人类基质,然后每周一次通过ELISA评估人细胞因子水平的小鼠血浆。第四,移植人类造血细胞,并在已知靶标上评估人细胞因子的体内功能效应( <em>例如细胞群体)。
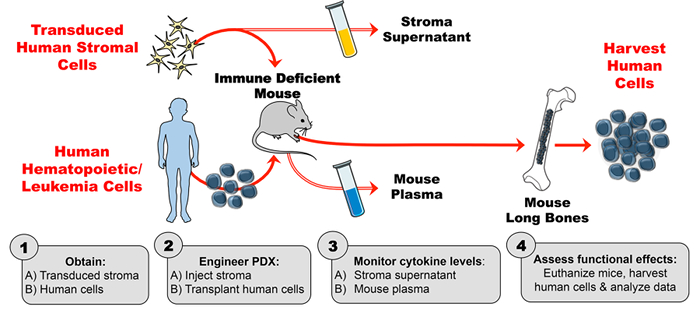
图1:用于在小鼠中产生外源人细胞因子的PDX模型。 ( 1A )设计实验并获得转导的人类基质细胞( 1B )获得人类细胞(造血干细胞,白血病细胞等 )产生PDX(患者来源的异种移植物)小鼠。 ( 2A )根据实验时间表将注射工程基质和( 2B )将人类细胞移植入免疫缺陷小鼠。 ( 3A-B )通过ELISA监测基质上清液和小鼠血浆中的细胞因子浓度。 ( 4 )收获人体细胞并评估PDX中存在的人细胞因子的体内功能效应。 请点击这里以查看该图的较大版本。
与其他在PDX小鼠中递送/产生人细胞因子的方法相比, 通过基质细胞递送人细胞因子提供了优点和缺点。与注射重组人细胞因子相比,基质介导的递送通常较便宜(基质细胞培养的成本低于重组细胞因子的成本)和较少的劳动密集型(每周一次注射,而每周多次注射)。短暂的细胞因子半衰期的问题也被缓解,因为基质不断产生外源细胞因子。 通过流体动力注射DNA递送细胞因子可能比通过基质递送更便宜。然而,它类似地是短暂的,并且可能需要比基质介导递送所需的简单的每周腹膜内注射更多的技术技能。小鼠中的慢病毒基因表达可以提供较少的转录细胞因子递送的方法;然而,在我们手中,生理TSLP水平未达到。另外,这种方法是劳动密集型的,需要连续生产慢病毒载体。转基因或敲入小鼠提供稳定的细胞因子的长期表达,并且可以被设计用于组织特异性表达,这可以是一个优点。另一方面,人类细胞因子基因在PDX小鼠所需的免疫缺陷小鼠背景上的转基因表达在模型的价值建立之前需要大量的资源投入。此外,转基因模型通常不允许改变细胞因子起始的时间或体内细胞因子产生的水平的选择。这些可以通过简单地改变引发基质细胞注射的时间点或注射的基质细胞的剂量来实现基质介导的递送。
基质细胞介导的细胞因子转运在这里详细描述的用于开发PDX以评估TSLP在正常人B细胞发育4,6和高风险B细胞急性淋巴细胞白血病中的作用。该方法提供了替代细胞因子递送方法,用于产生与TSLP以外的人细胞因子相似的模型。该模型还可用于产生初步数据,可以帮助确定细胞因子转基因或细胞因子敲入PDX模型的价值是否值得大量的时间和金钱投资。
Protocol
Representative Results
Discussion
该手稿描述了一种用于工程化PDX来表达外源人细胞因子的简单,快速且相对成本有效的方法。这里描述的策略是基于每周腹膜内注射转染以表达人细胞因子TSLP的基质细胞系。在进行本文描述的方法之前,产生用于表达高水平的感兴趣细胞因子(TSLP)和类似工程化的对照基质的基质。在本文提出的方案中,基质在培养物中扩增,并筛选随时间提供稳定,高水平细胞因子产生的能力(或在对照基质?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work was supported by NIH R21CA162259, NIH R01CA209829, NIH P20 MD006988, NIH 2R25 GM060507, a Hyundai Hope on Wheels Scholar Hope Grant, the Department of Pathology and Human Anatomy, the Department of Basic Sciences, and the Center for Health Disparities and Molecular Medicine at Loma Linda University School of Medicine and by a Grant to Promote Collaborative and Translational Research from Loma Linda University (KJP). The content is solely the responsibility of the authors and does not necessarily represent the official views of the NIH.
Materials
| Wet lab reagents | |||
| T-25 Nunc Cell Culture Treated EasYFlasks, 7 mL capacity, 25cm² culture area | Thermo Scientific / Fisher | 156367 | |
| T-75 Falcon Tissue Culture Treated Flask, 250 mL capacity, 75 cm² culture area & vented cap | Corning Inc. / Fisher | 353136 | |
| T-150 Falcon Tissue Culture Treated Flask, 600 mL capacity, 150 cm² culture area & vented cap | Corning Inc. / Fisher | 355001 | |
| 10 mL serological pipettes | Falcon | 357551 | |
| 15 mL polypropylene conical tubes | Fisher | 05-539-12 | |
| 5 mL round-bottom polystyrene tubes | Falcon | 352054 | |
| 50 mL polypropylene conical tubes | Falcon | 352098 | |
| 2.0 mL cryogenic vials, externally threaded | Corning Inc. / Fisher | 4230659 | |
| 1 mL pipette tips | Fisher | 2707509 | |
| 200 μL pipette tips | Denville Scientific | P3020-CPS | |
| 10 μL pipette tips | Denville Scientific | P-1096-CP | |
| Sterile Disposable Filter Units with SFCA Membrane, Nalgene Rapid-Flow | Fisher | 09-740-28D | |
| 2N H2SO4 | BioLegend | 423001 | |
| Dulbecco’s phosphate-buffered saline (PBS) without calicium and magnesium, 1× | Corning cellgro/ Mediatech | 21-031-CV | |
| Human TSLP ELISA Max Deluxe Set | BioLegend | 434204 | |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies | 7060 | |
| Trypan Blue | Corning | 25-900-Cl | |
| "Trypsin" 1x 0.25% Trypsin 2.21 mM EDTA in HBSS | ThermoFisher | 25-053 | |
| TWEEN 20 BioXtra | Sigma-Aldrich | P-7949 | |
| “R10” cell culture medium, % of total volume (makes 565 mL) | – | – | Lab Recipe |
| RPMI, 88.5% (500 mL) | Mediatech | 10-040-CV | |
| FBS, 9.9% (56 mL) | Mediatech | 35-011-CV | |
| L-Glutamine, 0.99% (5.6 mL) | Mediatech | 25-005-Cl | |
| Penicillin-Streptomycin, 0.50% (2.8 mL) | Mediatech | 30-002-Cl | |
| 2-Mercaptoethanol, 0.10% (560 µL) | MP | 190242 | |
| “R20” cell culture medium, % of total volume (makes 195 mL) | – | – | Lab Recipe |
| RPMI, 76.84% (150 mL) | see above | see above | |
| FBS, 20.49% (40 mL) | see above | see above | |
| 2mM L-glutamine, 1.02% (2 mL) | see above | see above | |
| 1mM Na pyruvate, 1.02% (2 mL ) | see above | see above | |
| Penicillin-Streptomycin, 0.51% (1 mL) | see above | see above | |
| 2-Mercaptoethanol, 0.10% (0.1 M), 0.10% (200 µL) | see above | see above | |
| “Freezing medium”, % of total volume | – | – | Lab Recipe |
| “R10” medium, 45% | see "R10" recipe | – | |
| FBS, 20% | see above | 35-011-CV | |
| DMSO, 10% | Corning | 25-950-CQC | |
| D(-)(+)-Trehalose dihydrate, 5% | Fisher Scientific | BP2687-100 | |
| Name | Company | Catolog Number | Comments |
| Biologics | |||
| "HS-27" HS-27A human stroma line | ATCC | CRL-2496 | |
| "CALL-4" MHH-CALL-4 cell line, human B cell precursor leukemia | DSMZ | ACC 337 | |
| “NSG mice” NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ, male or female, age 6 – 8 weeks | JAX Mice | # 005557 | |
| MUTZ-5 cell line, human B cell precursor leukemia | DSMZ | ACC 490 | |
| Recombinant Human TSLP protein | R&D Systems | 1398-TS-010 | |
| Name | Company | Catolog Number | Comments |
| Flow cytomery antibodies (clone)* | |||
| Anti-mouse CD45 FITC (30F11) | Miltenyi Biotec | 130-102-778 | |
| CD127 PE (MB15-18C9) (alternate name is IL-7Rα) | Miltenyi Biotec | 130-098-094 | |
| CD34 APC (8G12) | BD Biosciences | 340667 | |
| CD45 PE-Cy7 (HI30) | eBioscience | 25-0459 | |
| "FVD" Fixable viability dye eFluor 780 | eBioscience | 65-0865 | |
| Ig κ light chain FITC (G20-193) | BD Pharmingen | 555791 | |
| Ig λ light chain FITC (JDC-12) | BD Pharmingen | 561379 | |
| IgD PE (IA6-2) | BioLegend | 348203 | |
| IgM PE-Cy5 (G20-127) | BD Biosciences | 551079 | |
| pSTAT5 PE, mouse anti-STAT5 (pY694) | BD PhosphoFlow | 612567 | |
| Name | Company | Catolog Number | Comments |
| Other materials & equipment | |||
| Animal Implantable Nano Transponder with Canula | Trovan | ID-100B(1.25) | |
| EMLA lidocaine anesthetic cream (obtain by presciption through animal care facility) | perscription | perscription | |
| BD ½ cc LO-DOSE U-100 Insulin Syringe 28G½ | BD | #329461 | |
| BD Microtainer Tubes with K2EDTA | BD | #365974 | |
| Centrifuge | Beckman Coulter | Alegra X-15R | |
| FisherBrand Capillary Tubes (Heparinized) | Fisher Scientific | 22-260-950 | |
| Hemocytometer | Fisher | 02-671-6 | |
| MACSQuant Analyzer 10 | Miltenyi Biotec | 130-096-343 | |
| Mouse Pie Cage | Braintree Scientific, Inc. | MPC-1 | |
| Mouse Tail Illuminator Restrainer | Braintree Scientific, Inc. | MTI STD | |
| Pistol Grip Implanter | Trovan | IM-300(1.25) | |
| µQuant | Bio-Tek Instruments Inc. | MQX200 | |
| FlowJo flow cytometry analysis software | FlowJo, LLC | Version 10 | |
| *All antibodies are anti-human unless otherwise stated. |
References
- Francis, O. L., Milford, T. A., Beldiman, C., Payne, K. J. Fine-tuning patient-derived xenograft models for precision medicine approaches in leukemia. J Investig Med. 64 (3), 740-744 (2016).
- Parrish, Y. K., et al. IL-7 Dependence in human B lymphopoiesis increases during progression of ontogeny from cord blood to bone marrow. J Immunol. 182 (7), 4255-4266 (2009).
- Johnson, S. E., Shah, N., Panoskaltsis-Mortari, A., LeBien, T. W. Murine and human IL-7 activate STAT5 and induce proliferation of normal human pro-B cells. J Immunol. 175 (11), 7325-7331 (2005).
- Milford, T. A., et al. TSLP or IL-7 provide an IL-7Ralpha signal that is critical for human B lymphopoiesis. Eur J Immunol. 46 (9), 2155-2161 (2016).
- Reche, P. A., et al. Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. J Immunol. 167 (1), 336-343 (2001).
- Francis, O. L., et al. A novel xenograft model to study the role of TSLP-induced CRLF2 signals in normal and malignant human B lymphopoiesis. Haematologica. 101 (4), 417-426 (2016).
- Willinger, T., Rongvaux, A., Strowig, T., Manz, M. G., Flavell, R. A. Improving human hemato-lymphoid-system mice by cytokine knock-in gene replacement. Trends Immunol. 32 (7), 321-327 (2011).
- Graf, L., Iwata, M., Torok-Storb, B. Gene expression profiling of the functionally distinct human bone marrow stromal cell lines HS-5 and HS-27a. Blood. 100 (4), 1509-1511 (2002).
- Follenzi, A., Ailles, L. E., Bakovic, S., Geuna, M., Naldini, L. Gene transfer by lentiviral vectors is limited by nuclear translocation and rescued by HIV-1 pol sequences. Nat Genet. 25 (2), 217-222 (2000).
- Li, M., Husic, N., Lin, Y., Snider, B. J. Production of lentiviral vectors for transducing cells from the central nervous system. J Vis Exp. (63), e4031 (2012).
- Cockrell, A. S., Kafri, T. Gene delivery by lentivirus vectors. Mol Biotechnol. 36 (3), 184-204 (2007).
- Ricardo, R., Phelan, K. Freezing, thawing, and packaging cells for transport. J Vis Exp. (17), (2008).
- Tasian, S. K., et al. Aberrant STAT5 and PI3K/mTOR pathway signaling occurs in human CRLF2-rearranged B-precursor acute lymphoblastic leukemia. Blood. 120 (4), 833-842 (2012).
- Kalaitzidis, D., Neel, B. G. Flow-cytometric phosphoprotein analysis reveals agonist and temporal differences in responses of murine hematopoietic stem/progenitor cells. PLoS One. 3 (11), (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. J Vis Exp. (67), (2012).
- Kovacsics, D., Raper, J. Transient expression of proteins by hydrodynamic gene delivery in mice. J Vis Exp. (87), (2014).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Pearson, T., Greiner, D. L., Shultz, L. D. Chapter 15, Creation of "humanized" mice to study human immunity. Curr Protoc Immunol. , (2008).
- Matheu, M. P., Sen, D., Cahalan, M. D., Parker, I. Generation of bone marrow derived murine dendritic cells for use in 2-photon imaging. J Vis Exp. (17), (2008).
- Scheeren, F. A., et al. Thymic stromal lymphopoietin induces early human B-cell proliferation and differentiation. Eur J Immunol. 40 (4), 955-965 (2010).
- Lee, E. B., et al. Increased serum thymic stromal lymphopoietin in children with atopic dermatitis. Pediatr Allergy Immunol. 21 (2 Pt 2), e457-e460 (2010).

