Estudos de estrutura e função em células-tronco embrionárias de camundongos usando troca de cassete mediada por recombinase
Summary
Proteínas, muitas vezes contêm vários domínios que podem exercer diferentes funções celulares. Gene knock-out (KO) não consideram essa diversidade funcional. Aqui, relatamos uma abordagem de estrutura-função com base na troca de cassete mediada por recombinação (RMCE) em KO células estaminais embrionárias que permite a dissecação molecular de vários domínios funcionais ou variantes de uma proteína.
Abstract
engenharia genética em embriões de ratinho ou células estaminais embrionárias (mESCs) permite o estudo da função de uma dada proteína. As proteínas são os laboriosos da célula e frequentemente consistem em vários domínios funcionais, que podem ser influenciados por modificações pós-traducionais. O esgotamento de toda a proteína em condicional ou constitutiva knock-out ratos (KO) não leva em conta essa diversidade funcional e regulação. Uma linha MESC e um modelo de ratinho derivado, em que um local de acoplamento para FLPe troca cassete mediada por recombinação (RMCE) foi inserida dentro do locus ROSA26 (R26), foi anteriormente relatado. Aqui, nós relatamos em uma abordagem de estrutura-função que permite a dissecção molecular das diferentes funcionalidades de uma proteína de múltiplos domínios. Para este fim, os ratos RMCE-compatível deve ser cruzados com ratinhos KO e mESCs KO então RMCE-compatíveis devem ser isoladas. Em seguida, um painel de construções de salvamento putativos pode ser introduzida no locus de R26 via RMCE targeting. Os cDNAs candidatos de resgate pode ser facilmente inserido entre os locais RMCE do vector de direccionamento utilizando recombinação clonagem. Em seguida, mESCs KO são transfectadas com o vector de direccionamento, em combinação com um plasmídeo de expressão da recombinase FLPe. RMCE reativa o gene de resistência à neomicina promotor-menos nos locais de ancoragem ROSA26 e permite a seleco do evento de direccionamento correcto. Desta forma, a eficiência elevada de segmentação perto de 100% são obtidas, permitindo a inserção de várias construções de salvamento putativos de uma forma semi-elevado rendimento. Finalmente, um grande número de construções de salvamento R26 accionadas podem ser testados quanto à sua capacidade para resgatar o fenótipo que foi observada em mESCs KO parentais. Apresenta-se um estudo de estrutura-função de prova de princípio em catenina p120 (p120ctn) mESCs KO usando diferenciação endoderme em corpos embrióides (EBS) como a leitura fenotípica. Esta abordagem permite a identificação de domínios importantes, vias a jusante putativos, e ponto de doença relevantesmutações que estão subjacentes fenótipos KO para uma determinada proteína.
Introduction
Estima-se que os genomas de mamíferos contêm cerca de 20.000 genes codificadores de proteínas. O splicing alternativo e modificações pós-tradução aumentam ainda mais o repertório de proteínas. As proteínas têm uma estrutura modular de um e muitas vezes conter vários domínios de interacção, que permitem o seu recrutamento para complexos proteicos diferentes e a sua participação em vários processos celulares 2. Um exemplo é a proteína multi-funcional chamado p120ctn. p120ctn é codificada pelo gene Ctnnd1 e consiste de um grande domínio central tatu repetição flanqueado por um N-terminal e uma região C-terminal. O domínio de tatu p120ctn se liga a um domínio justamembranar altamente conservado de caderinas clássicas, que estão envolvidos na adesão célula-célula, mas que também se liga ao repressor transcricional Kaiso. O domínio N-terminal de p120ctn interage com diferentes quinases, fosfatases, pequenas RhoGTPases, e associada a microtúbulos proteins 3. Curiosamente, como um resultado de splicing alternativo, isoformas p120ctn podem ser gerados a partir de quatro codões de iniciação alternativos 4. p120ctn isoforma 1A é a mais longa, uma vez que é traduzida a partir da maioria-5' do codão de iniciação e contém o segmento de comprimento completo N-terminal. Em p120ctn isoformas de 3 e 4, este segmento N-terminal é eliminado parcialmente e completamente, respectivamente. Compreendendo o papel preciso de proteínas (ou isoformas de proteas) e os seus domínios em diferentes funções celulares continua a ser um desafio.
Direccionamento de genes em mESCs permite o estudo da função de uma proteína através da deleco genica do gene correspondente e tem amplamente contribuiu para a identificação de genes e vias developmentally importantes e doenças relevantes. Esta descoberta em engenharia genica inversa foi o resultado de avanços em campos de isolamento MESC e direccionamento de genes devido à recombinação homóloga 5 </s-se>. A recombinação homóloga é um processo no qual fragmentos de ADN são trocadas entre duas porções nucleicos semelhantes ou idênticas depois de cadeia dupla (ds) quebras de ADN. Normalmente, RH é ineficiente porque quebras ADNcd são pouco frequentes. Recentemente, a eficiência do gene dirigida por homologia de segmentação pode ser aumentada usando nucleases específicas do local 6, 7, mas, infelizmente, estes são propensas a efeitos fora do alvo 8. Uma técnica mais fiável para permitir o direccionamento gico é RMCE, que é baseado em sistemas de recombinação específicos do local tais como Cre / loxP ou FLPe / Frt. LoxP e sequência DRF são encontrados no bacteriago P1 e Saccharomyces cerevisiae, respectivamente, e consistem de 34 pb, incluindo uma sequência de pb assimétrica 8 que determina a orientação do local. Por outro lado, a orientação de, por exemplo, dois sítios loxP no interior de um trecho de ADN irá determinar se o ADN floxed torna-se excisado ou inversed após recombinação mediada por Cre 9. Além disso, Cre também pode induzir uma translocação se dois locais estão localizados em diferentes cromossomas. RMCE leva vantagem de locais de recombinação heteroespecíficos que não reagem de forma cruzada e que são incorporados no locus genómico. Na presença de um plasmídeo dador que contém um fragmento de ADN flanqueada pelos mesmos locais heteroespecíficos, a recombinase irá inserir este fragmento de ADN no locus genómico RMCE-compatíveis, porque de translocação duplo simultâneo (Figura 1). Aqui, os clones única correctamente RMCE orientadas podem tornar de resistência a drogas, graças a um promotor no vector de entrada que restaura um "preso", gene de resistência à Neomicina promotor-menos (Neo R) presente no genoma R26 das células de encaixe (Figura 1) 10, 11. Isto resulta numa eficiência muito alta segmentação, muitas vezes perto de 100% 11, </ sup> 12. Em conclusão, a segmentação baseada RMCE é altamente eficiente e pode ser usada para a estrutura-funções estudos; no entanto, requer um local genómico pre-engenharia.
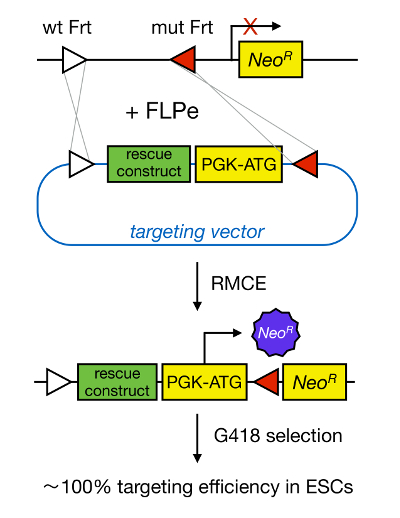
Figura 1. Representação esquemática da orientação para as mediada por RMCE. RMCE permite a troca de segmentos de ADN a partir de um vector de abordagem selectiva de entrada para um local genómico definido se tanto abrigar dois locais DRF heteroespecíficos (representados por triângulos brancos e vermelhos). Além disso, o locus genómico engenharia contém um promotor e um gene truncado de resistência à neomicina (NeoR). Ao fornecer um promotor e do codão de iniciação no fragmento de DNA de entrada, os eventos de recombinação única correcção restaurar a resistência a neomicina, resultando em altas eficiências de segmentação. Por favor clique aqui para ver uma versão maior do tsua figura.
engenharia genoma em mESCs permite a geração de ratinhos RMCE-compatível. Em 1981, dois grupos conseguiram capturar células pluripotentes a partir da massa celular interna (ICM) de blastocistos e em mantê-las em cultura 13, 14. mESCs são capazes de auto-renovação e diferenciação em todos os tipos de células embrionárias e adultos, incluindo a linhagem de células germinativas. Portanto, o direccionamento gico em mESCs permite estudos inverter-genéticas através do desenvolvimento de ratinhos KO constitutivos ou condicional (utilizando o sistema cre / loxP). No entanto, a forma clássica de isolar as células ES de ratinho é muito ineficiente. Várias melhorias importantes têm aumentado grandemente a taxa de sucesso para derivar linhas Mesc, incluindo o uso de um soro de substituição definidos (SR) de meio 15, alternando entre médio MESC contendo soro de bovino fetal e SR (FBS) a 16, e o uso de farmacocompostos lógicas tais como pluripotin ou 2i 17. Pluripotin, uma molécula pequena sintética, permite a propagação de mESCs num estado indiferenciado, na ausência do factor inibidor da leucemia (LIF) e fibroblastos de rato embrionários (MEFs) 18. Finalmente, foi demonstrado que mESCs pode ser isolado com um rendimento muito elevado (perto de 100%) quando um / FBS a meio protocolo alternância SR é combinado com LIF e pluripotin 19, 20. Estes protocolos permitem o isolamento eficiente de mESCs KO RMCE-compatível que pode subsequentemente ser utilizados para estudos estrutura-função.
Este documento descreve um método que permite que um para identificar os domínios de chave ou resíduos dentro de uma proteína que é responsável por processos celulares específicos. Para este fim, uma reserva de tecnologias avançadas que permitem o isolamento eficiente MESC, visando a montagem do vetor, e MESC segmentação era criard. Como tal, os grandes painéis com isoformas de proteas, mutantes de domínio, e efectores a jusante podem ser introduzidos em mESCs KO e podem ser avaliados pela sua capacidade para resgatar o fenótipo in vitro KO.
Protocol
Representative Results
Discussion
Nosso método de isolamento MESC é user-friendly e não requer habilidades avançadas ou equipamentos, tais como a microcirurgia de blastocistos. Assim, esta tecnologia é acessível a uma grande parte da comunidade científica. Qualquer pessoa com experiência básica de cultura celular pode propagar outgrowths ICM e estabelecer mESCs linhas. No entanto, a lavagem e manuseio de blastocistos requer alguma prática. Uma pipeta de boca é usado para transferir os blastocistos e consiste de uma micropipeta, um suporte de …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Agradecemos Jinke D'Hont, Frederique Van Rockeghem, Natalie Farla, Kelly Lemeire e Riet De Rycke por sua excelente suporte técnico. Agradecemos também a EEF Parthoens, Evelien Van Hamme, e Amanda Goncalves do Mecanismo BioImaging Núcleo do Centro de Pesquisa Inflamação por sua assistência especializada. Reconhecemos membros do nosso grupo de pesquisa para discussões valiosas. Este trabalho foi apoiado pela Política belga Science (Belspo Interuniversitário de atração poloneses – Prêmio IAP VII-07 DevRepair; https://devrepair.be), pela Fundação Rainha Elisabeth Medical, Bélgica (GSKE para 2008-2010; http: // www .fmre-gske.be), e pelas acções concertadas de pesquisa (GOA 01G01908) da Universidade de Ghent, Bélgica (http://www.ugent.be/en/ghentuniv). SG é uma pós-bolseiro dos meios de investigação Flandres (FWO-V).
Materials
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20°C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23G needles | Fine-ject | 8697 | |
| 1-ml syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 ml distilled water, autoclave and store at 4°C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment: | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 ml, 10 ml and 25 ml | |||
| 15-ml and 50-ml conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μl) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37°C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media: | |||
| MEF Medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| SR-based mESC medium: | stored at 4°C; warm 30 min at 37°C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR ) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/ml recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium): | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4°C; warm 30 min at 37°C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/ml ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/ml) | Gibco | 15140-122 | |
| streptomycin (100 µg/ml) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
References
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).

