Idrolisi di un Ni-Schiff-Base complessi utilizzando le condizioni adatte per la conservazione di acido-labile gruppi protettori
Summary
Qui, presentiamo un'idrolisi efficiente e successiva protezione Fmoc di un amminoacido isolato da un complesso Ni-Schiff-base. condizioni di idrolisi qui presentati sono adatti per l'uso quando è richiesta la ritenzione di gruppi protettivi acido-labile catena laterale. Questa tecnica può essere adattabile ad una varietà di substrati amminoacidi innaturali.
Abstract
aminoacidi non naturali, aminoacidi contenenti funzionalità in catena laterale non comunemente visto in natura, sono sempre trovati in sequenze peptidiche sintetiche. Sintesi di alcuni aminoacidi non naturali spesso include l'uso di un precursore costituito da una base di Schiff-stabilizzato da un catione nichel. Unnatural catene laterali possono essere installati su un backbone aminoacido che si trova in questo complesso Schiff-base. L'amminoacido non naturale risultante può essere isolato da questo complesso mediante idrolisi della Schiff-base, tipicamente impiegando riflusso in soluzione fortemente acida. Queste condizioni fortemente acide possono rimuovere l'acido-labile catena laterale gruppi protettori necessario per gli amminoacidi non naturali da utilizzare nella sintesi peptidica in fase solida di micro-onde. In questo lavoro, presentiamo un'idrolisi efficiente e successiva protezione Fmoc di un amminoacido isolato da un complesso di base Ni-Schiff. condizioni di idrolisi presentati in questo lavoro sono adatti per la conservazione di s acido-labileide-catena gruppi protettori e può essere adattabili ad una varietà di substrati amminoacidi innaturali.
Introduction
amminoacidi non naturali catene laterali cuscinetto (di SAU) che variano da quelli dei venti naturali amminoacidi presenti in natura hanno trovato utilità in un'ampia gamma di applicazioni. Sintesi di questi SAU, tuttavia, può essere difficile a seconda della struttura delle catene laterali e la stereochimica della spina dorsale aminoacido. Attivazione del legame CH di glicina nel contesto di un complesso Schiff-base di nichel è stato utilizzato per produrre una varietà di derivati di amminoacidi compreso α, acidi p-diammino 1 e il cuscinetto di SAU fluorurato 2 o eterociclici catene laterali. 3
Dopo aggiunta di innaturali catene laterali, funzionalizzati SAU sono tipicamente rimossi dal complesso Schiff-base riflusso in acido cloridrico 4 e vengono successivamente isolato con cromatografia a scambio ionico. Mentre in genere efficace, questo protocollo genera unacidi mino che possono essere adatti per l'uso nella sintesi peptidica in fase solida (SPSS). La natura del SPPS richiede la presenza di gruppi acido-labile catena laterale protezione e la natura fortemente acida di condizioni tipiche Ni-Schiff-base decomposizione impedisce isolamento di SAU con questi gruppi protettivi intatte. A nostra conoscenza, solo un metodo di decomposizione alternativa 'stato segnalato: impiego di acido etilendiamminotetraacetico (EDTA) e idrazina a temperature elevate, 5 condizioni che si può non essere adatto per qualche catena laterale gruppi protettivi come phthalimides.
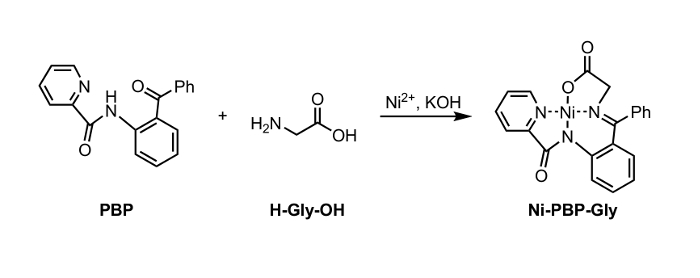
Figura 1: Sintesi di Ni-PBP-Gly da Ni 2+, PBP e glicina (Gly). Si prega di cliccare qui per vedere una versione più grande di questa figura. </a>
Qui, riportiamo un metodo per idrolisi di un complesso Ni-Schiff-base, Ni-PBP-Gly (Figura 1). Questo complesso, derivato da Ni 2+, glicina, e piridina-2-carbossilico (2-benzoil-fenil) -ammide (PBP), 6 ha dimostrato di essere una piattaforma utile per la sintesi di una varietà di SAU ed è facilmente accessibili mediante la via sintetica a due fasi. 7 Sintesi di questo complesso è letteratura precedented resa elevata. 6 I nostri risultati descritti qui di seguito dimostrano l'applicabilità delle condizioni di idrolisi utilizzando EDTA a leggermente acida a condizioni di pH neutro adeguati per l'utilizzo con cuscinetto acido-labile catena laterale di SAU gruppi protettivi. A seguito di idrolisi, la soluzione acquosa risultante può essere isolato e sottoposto immediatamente alle condizioni di protezione Fmoc standard per permettere un aminoacido Fmoc-protetto (Figura 2).
<p class="jove_content" fo: keep-together.within-page = "1">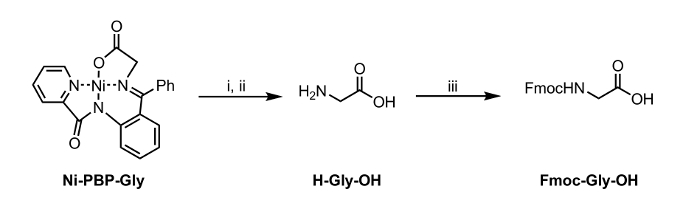
Figura 2: Idrolisi e Fmoc-protezione di un amminoacido Isolato da Ni-PBP-Gly. Condizioni di reazione: i. EDTA (12 equiv), pH 4,5; ii. Etile acetato e lavata aggiustamento a pH 7; iii. Fmoc-OSu (1 equiv), NaHCO 3 (2 equiv). Si prega di cliccare qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il protocollo descritto sopra è utile nella sua capacità di facilitare l'isolamento di una dorsale amminoacido da un complesso Ni-Schiff-base in condizioni di pH blande e successiva protezione Fmoc di questo aminoacido isolato attraverso due passaggi critici. Il primo passo consiste nel mescolare una soluzione in DMF / acqua contenente EDTA per facilitare il distacco del aminoacido dal complesso. Residui sottoprodotti organici complessi o possono essere facilmente rimossi con estrazione. Il secondo passo di questo…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Il finanziamento fornito da Slippery Rock University. Vorremmo ringraziare T. Boron III (Slippery Rock University) e C. Haney (University of Pennsylvania) per le loro intuizioni.
Materials
| Ni-PBP-Gly | Synthesized from published protocol | ||
| DMF | Fisher | D119-4 | |
| EDTA | Fisher | S311-100 | |
| Dichloromethane | Acros | AC610050040 | |
| Sodium Bicarbonate | Fisher | S233-500 | |
| Fmoc-OSu | Chem-Impex | "00147" | |
| Dioxane | Fisher | D111-500 | |
| Hydrochloric Acid | Fisher | A144-500 | |
| Ethyl Acetate | Acros | AC610060040 | |
| Magnesium Sulfate | Fisher | M65-500 | |
| ZEOPrep 60ECO Silica Gel | ZEOChem | ||
| Hexanes | Fisher | 3200250.650.443 | |
| Chromatography Column | |||
| pH Test Strips | |||
| Rotary Evaporator | |||
| 250 mL Separatory Funnel | |||
| 250 mL Round Bottom Flask | |||
| Stir Bar | |||
| Stir Plate |
References
- Wang, J., Shi, T., Deng, G., Jiang, H., Liu, H. Highly Enantio- and Diastereoselective Mannich Reactions of Chiral Ni(II) Glycinates with amino sulfones. Efficient asymmetric synthesis of aromatic α,β-diamino acids. J. Org. Chem. 73 (21), 8563-8570 (2011).
- Wang, J., Lin, D., Zhou, S., Ding, X., Soloshonok, V. A., Liu, H. Asymmetric synthesis of sterically and electronically demanding linear ω,-trifluoromethyl containing amino acids via alkylation of chiral equivalents of nucleophilic glycine and alanine. J. Org. Chem. 76 (2), 684-687 (2011).
- Wang, J., Zhou, S., Lin, D., Ding, X., Jiang, H., Liu, H. Highly diastereo- and enantioselective synthesis of syn-β,-substituted tryptophans via asymmetric Michael addition of a chiral equivalent of nucleophilic glycine and sulfonylindoles. Chem. Commun. 47 (29), 8355-8357 (2011).
- Belokon, Y. N. Highly efficient catalytic synthesis of α,-amino acids under phase-transfer conditions with a novel catalyst/substrate pair. Angew. Chem. Int. Ed. 40 (10), 1948-1951 (2001).
- Zhou, S., Wang, J., Lin, D., Zhao, F., Liu, H. Enantioselective synthesis of 2-substituted-tetrahydroisoquinolin-1-yl glycine derivatives via oxidative cross-dehydrogenative coupling of tertiary amines and chiral nickel(II) glycinate. J. Org. Chem. 78 (22), 11204-11212 (2013).
- Belokon, Y. N. Synthesis of α,-amino acids via asymmetric phase transfer-catalyzed alkylation of achiral nickel(II) complexes of glycine-derived Schiff bases. J. Am. Chem. Soc. 125 (42), 12860-12871 (2003).
- Ueki, H., Ellis, T. K., Martin, C. H., Soloshonok, V. A. Efficient large-scale synthesis of picolinic acid-derived nickel(II) complexes of glycine. Eur. J. Org. Chem. 2003 (10), 1954-1957 (2003).
- Dener, J. M., Fantauzzi, P. P., Kshirsagar, T. A., Kelly, D. E., Wolfe, A. B. Large-scale syntheses of Fmoc-protected non-proteogenic amino acids: useful building blocks for combinatorial libraries. Org. Process Res. Dev. 5 (4), 445-449 (2001).
- Cruz, L. J., Beteta, N. G., Ewenson, A., Albericio, F. "One-pot", preparation of N-carbamate protected amino acids via the azide. Org Process Res. Dev. 8 (6), 920-924 (2004).
- Hart, J. R. . Ullmann’s Encyclopedia of Industrial Chemistry. , (2000).
- Adamson, J. G., Blaskovich, M. A., Groenevelt, H., Lajoie, G. A. Simple and convenient synthesis of tert-butyl ethers of Fmoc-serine, Fmoc-threonine, and Fmoc-tyrosine. J. Org. Chem. 56 (10), 3447-3449 (1991).
- Seyfried, M. S., Lauber, B. S., Luedtke, N. W. Multiple-turnover isotopic labeling of Fmoc- and Boc-protected amino acids with oxygen isotopes. Org. Lett. 12 (1), 104-106 (2010).
- Bonke, G., Vedel, L., Witt, M., Jaroszewski, J. W., Olsen, C. A., Franzyk, H. Dimeric building blocks for solid-phase synthesis of α,-peptide-β,-peptoid chimeras. Synthesis. 2008 (15), 2381-2390 (2008).

