Engenharia de Tecido Tridimensional de Redes de Astrócitos Alinhadas para Recapitular Mecanismos de Desenvolvimento e Facilitar a Regeneração do Sistema Nervoso
Summary
Vamos mostrar o desenvolvimento de feixes Self montados, tridimensionais do somata hamartomas alinhado longitudinalmente e processos dentro de um invólucro de biomaterial romance. Estas engenharia “vida andaimes”, exibindo o diâmetro do mícron-escala ainda estendendo centímetros de comprimento, pode servir como teste-camas para estudar os mecanismos do desenvolvimento neurológico ou facilitar Epilepsias pelo diretor de migração neuronal e/ou axonal Pathfinding.
Abstract
NEUROTRAUMA e neurodegenerativas doença muitas vezes resultam em duração déficits neurológicos devido à capacidade limitada do sistema nervoso central (SNC) a substituir neurônios perdidos e regeneração axonal caminhos. No entanto, durante o desenvolvimento do sistema nervoso, migração neuronal e axonal extensão ocorrem frequentemente ao longo dos caminhos formados por outras células, conhecido como “andaimes de viver”. Buscando para emular esses mecanismos e para a concepção de uma estratégia que contorna o ambiente inibitório do SNC, este manuscrito apresenta um protocolo para fabricar a engenharia de tecidos astrocyte-baseado “andaimes de viver”. Para criar essas construções, utilizamos um esquema de invólucro romance biomaterial para induzir astrócitos de auto-montagem em feixes tridimensionais densas de bipolar somata alinhado longitudinalmente e processos. Primeiro, oco hidrogel microcolunas foram montados, e o lúmen interno foi revestido com colágeno-matriz extracelular. Astrócitos corticais cerebrais dissociados então foram entregues no lúmen da microcoluna cilíndrica e, com um diâmetro interno crítico de < 350 µm, espontaneamente Self-alinhado e contratada para produzir cabos de fibra-like longas que consiste de feixes densos dos processos de astrocyte e fibrilas de colágeno medindo 97% de viabilidade celular e foram quase exclusivamente composta de astrócitos, expressando uma combinação de filamento intermediário proteínas glial fibrilar ácida proteína (GFAP), vimentina e nestin. Estas alinhadas astrocyte redes foram encontradas para fornecer um substrato permissivo para fixação neuronal e alinhado à extensão do axônio. Além disso, essas construções mantenham integridade e alinhamento quando extraído o invólucro de hidrogel, tornando-os adequados para implantação do CNS. Essas construções pré-formadas estruturalmente emulam chave cytoarchitectural elementos de ocorrência natural gliais com base em “vivendo andaimes” em vivo. Como tal, estes andaimes de vida projetada podem servir como teste-camas para estudar desenvolvimento neurológico mecanismos em vitro ou facilitar Epilepsias direcionando a migração neuronal e/ou axonal pathfinding degeneração CNS in vivo a seguir .
Introduction
Sistema nervoso central (SNC) tem uma capacidade limitada para compensar a perda e/ou disfunção dos neurônios e vias axonal que acompanham as condições tais como traumatismo crânio-encefálico (TCE), derrame, medular lesão (SCI) e neurodegenerativas doença1 ,2,3,4,5. Neurogênese no SNC é restrito a um número limitado de áreas no cérebro, impedindo a restauração de neurônios perdidos6,7. Além disso, a regeneração das vias axonal perdidas no SNC é insuficiente devido a falta de orientação dirigida, a presença de inibidores de consequência natural e astrogliosis reativa após danos ao tecido neural2,8, 9,10. Astrócitos normalmente têm diversas funções na assistência neurônios com homeostase iónica, liberação de neurotransmissores, formação de sinapse e neurovasculares acoplamento11. No entanto, seguindo até leve dano ao tecido neural, astrócitos podem sofrer mudanças moleculares, estruturais e funcionais como eles transição para um estado hipertrófica11. Em resposta à severa neurotrauma, estas mudanças resultam na formação de uma cicatriz com uma penumbra contendo migrando astrócitos reativos e um núcleo de lesão que inclui leucócitos vazados da ruptura barreira hemato – encefálica (BBB), microglia, oligodendrócitos e fibroblastos11,12,13. Estes astrócitos reativos atingir uma morfologia de processos filamentosos, desorganizados e exibem expressão aumentada de proteínas de filamento intermediário e proteoglicanos de sulfato de condroitina (CSPGs), que impedem a regeneração neural12. Mesmo que a cicatriz glial inicialmente ajuda a restaurar a integridade BBB e evitar a transmissão da resposta inflamatória ao tecido saudável circundante, serve como uma barreira física e bioquímica contra axônio regeneração12,14 ,15,16. Por exemplo, axônios que encontrar a cicatriz glial exibir cones de crescimento distrófica bulbosa e atrofiado crescimento12. Além disso, a desorganização dos processos hamartomas após lesão impede a extensão de regeneração de axônios17. O resultado destas características inibitório manifesta-se nas deficiências permanentes muitas vezes físicas e neurológicas que os pacientes sofrem após grave neurotrauma, incluindo TBI e Sci.
Independentemente dos extrínsecos desafios funcional regeneração no SNC, axônios demonstraram possuir uma capacidade intrínseca de se regenerar. Por exemplo, a natureza dinâmica dos cones distrófica crescimento em contato com a cicatriz glial sugere que estes finais mantém sua capacidade de estender12. Por conseguinte, acredita-se que um obstáculo principal para a re-crescimento axonal é o ambiente inibitório do CNS pós-lesão e que fornecendo um ambiente mais permissivo via redução de cicatrizes e/ou fornecendo regenerativas pontes sobre a cicatriz seria gliais vantajoso. De fato, estudos anteriores demonstraram que os neurônios do CNS eram capazes de estender axônios através de uma lesão utilizando enxertos de nervo periférico como pontes, que apresentam um ambiente mais favorável para o axônio regeneração12,18, 19. Seguiram-se diversas outras estratégias para explorar essa capacidade regenerativa vestigial. Por exemplo, manipulação de vias de sinalização celular crescimento em vários modelos de lesão resultou na regeneração axonal e cicatriz glial redução10,20,21. Além disso, estudos têm mostrado que o tratamento com chondroitinase ABC, que fende a maioria das cadeias de açúcar em CSPGs, diminui o efeito inibitório de CSPGs secretada por astrócitos reativos22. Apesar de encorajador resultados, essas abordagens não fornecem dirigido a orientação dos cones de crescimento, que pode potencialmente resultar em regeneração aberrante12e também não conta para a perda de neurônios. Abordagens baseadas em célula têm sido utilizadas em tentativas de ultrapassar os efeitos da cicatriz glial e para repor as células perdidas, particularmente os neurônios. Alguns grupos têm os astrócitos reativos em neurônios, enquanto outros transplantamos células progenitoras neurais em lesões de CNS para repovoar a área de lesão e promover o axônio regeneração23,24, 25. no entanto, transplante de células-tronco sozinho é limitado por taxas de sobrevivência baixa integração pobre e modesta de retenção no tecido danificado5. Além disso, estas estratégias baseadas em células não restaurar a longa distância axonal panfletos, especialmente em uma maneira controlada. Portanto, biomateriais em combinação com outras abordagens estão sendo exploradas como veículos de entrega para vários neural e fatores de crescimento e células progenitoras26. Abordagens baseadas em biomaterial apresentam um alto grau de controle de projeto para produzir construções que imitam o haptotaxic físico, específico, e sinais quimiotáxicas presente no microambiente (3D) tridimensional do destino anfitrião tecido27, 28,29,30,31,32,33,34. Reprodução desses sinais ambientais é de suma importância para células transplantadas apresentar morfologia como de um nativo, proliferação, migração e sinalização, entre outras características neurobiológicas29. Apesar dessas propriedades vantajosas, avanço além da tradicional célula semeada biomaterial andaimes é necessário para substituir neurônios perdidos e promover a regeneração axonal longa distância dirigida simultaneamente.
Uma promissora abordagem alternativa baseia-se no tecido neural engenharia “andaimes vivos”, que são distintos de outras abordagens baseadas em célula devido à presença de células neurais vivas com um cytoarchitecture pré-formadas que emula neuroanatomia nativa e/ou mecanismos do desenvolvimento para facilitar a substituição do alvo, reconstrução e regeneração dos circuitos neurais4,35. Considerações para o projeto de vida andaimes incluem os fenótipos e fontes de células neurais, bem como as propriedades mecânicas e/ou físicas e os sinais bioquímicos ditaram pela composição de qualquer acompanhamento de biomateriais35. Após a fabricação em vitro, estes andaimes vivos podem ser implantado no vivo de moléculas de adesão celular presente e Quimiotáticos e neurotrophic sinaliza para regular ativamente a migração de células nervosas e consequência natural do axônio dependendo do estado e progressão dos processos regenerativos35. Células gliais podem servir como base para a cytoarchitecture engenharia de andaimes de vida, desde que estas células mediam diversos mecanismos do desenvolvimento na vivo. Durante o desenvolvimento do cérebro, os neurônios novos dependem de processos basais prorrogados pela glia radial da zona ventricular para a placa de desenvolvimento cortical como andaimes vivos para migração dirigida36,37. Além disso, estendendo o crescimento cones são mostrada para orientar-se por sensoriamento de sinais atraentes e repelentes eliciados células gliais guidepost, and so-called “pioneiro” axônios são sugeridos para alcançar as metas corretas, estendendo-se ao longo de pre-modelado gliais moldes de38,35,39. Assim, as células gliais são necessárias para a orientação do pioneirismo de axônios, que mais tarde servem como baseado no axônio “andaimes de vida” para direcionar a projeção de axônios “seguidor”. Além disso, mecanismos de crescimento mediada por glia foram mostrados para persistir pós-natal, como neuroblastos seguem o fluxo migratório rostral (RMS) para navegar na zona subventricular (SVZ), uma das poucas áreas remanescentes da neurogênese no cérebro adulto, para o bulbo olfatório (OB)40. Estes neuroblastos em RMS migram dentro do tubo glia (figura 1A-1), que é composto por processos hamartomas alinhados longitudinalmente, através de aderências direta célula-célula e localizadas fatores solúveis37, 41. por fim, enquanto danos CNS em causas de mamíferos interrompeu arranjo hamartomas processo formando uma cicatriz glial que impede fisicamente a regeneração axonal17, muitos sistemas não-mamíferos faltam a formação de uma cicatriz glial prejudicial. Em vez disso, as células gliais de espécies não-mamíferos mantenham mais organizado, alinhados a padrões que são usados como guias através da região lesada17,42,43. Por exemplo, em modelos de não-mamíferos SCI, axônios são mostrados para crescer em estreita associação com gliais pontes cruzando a lesão, sugerindo um papel importante para andaimes gliais organizados como substratos, facilitando a regeneração axonal e recuperação funcional ( Figura 1A -2) 42 , 44 , 45. recapitulação das características neuroanatômica e os mecanismos do desenvolvimento/regenerativa descritos acima pode produzir uma nova classe de engenharia baseada em gliais vivos andaimes que simultaneamente pode conduzir a migração neuronal imatura e axonal Pathfinding através de ambientes caso contrário não-permissivo, assim, potencialmente, mitigação dos efeitos da neuronal e degeneração do trato de axônio associado com lesão do CNS e doença.
Nosso grupo de pesquisa anteriormente desenvolveu vários tipos de andaimes de vida para a reconstrução e regeneração dos tracts axonal no SNC e o sistema nervoso periférico (SNP) através de microtecido projetado redes neurais (micro-TNS) e tecido enxertos de nervo engenharia (TENGs), respectivamente,27,46,,47,48. Ambas as estratégias são inerentemente baseia biomimetismo. Micro-TNS são estruturas anatomicamente inspirada projetadas estruturalmente e funcionalmente substituir axonal folhetos conectando distintas populações neuronais do cérebro. TENGs explorar o mecanismo de desenvolvimento da regeneração axonal axônio-facilitada, exemplificado pelo crescimento do axônio “seguidor” ao longo de axônios “pioneiro”, para alcançar o hospedeiro alvo regeneração axonal35,46,48. Nós recentemente capitalizou a versatilidade do andaime a vida técnica usando um esquema similar do encastoamento como micro-TNS e buscando inspiração os mecanismos baseados em glia de presentes durante todo o desenvolvimento. Aqui, nós desenvolvemos construções consistindo de feixes hamartomas alinhados, abrangendo o lúmen colágenas de um hidrogel microcoluna49. Estes andaimes hamartomas vivos são desenvolvidos pelo primeiro preencher um conjunto de agulha de acupuntura-tubo capilar com líquido agarose para criar um hidrogel cilíndrico oco com um diâmetro externo (OD) e o diâmetro interno (ID) correspondente para os diâmetros do tubo e agulha, respectivamente. Na sequência de gelificação de agarose e extração de hidrogel microcoluna do tubo capilar, o interior oco é revestido com tipo eu colágeno para fornecer um ambiente permissivo para a adesão de astrocyte e alinhado à formação de feixe (figura 1B -1). Depois, o lúmen é semeado com astrócitos corticais cerebrais, isolados de filhotes pós-natal (figura 1B-2). Contrariamente ao bidimensional (2D) alinhamento as técnicas que dependem da aplicação de campos elétricos, micropatterned grooves e matriz extracelular da proteína (ECM), padronização, alinhamento astrocyte no cadafalso vivos técnica depende de auto-montagem de acordo com variáveis controláveis como colágeno concentração50,,51,52, densidade celular e curvatura do substrato (coluna ID). Os astrócitos contraem e remodelam o colágeno e adquirem uma morfologia bipolar, alinhado longitudinalmente análoga para os andaimes naturais observados na vivo (figura 1B-3). Com efeito, estamos ativamente perseguindo o uso destas estruturas de cabo, como como substratos físicos para orientação alvo da migração de neurônios imaturos, bem como facilitar a regeneração axonal através do ambiente desfavorável do SNC danificado, particularmente a cicatriz glial mamíferos (Figura 1). Este artigo irá apresentar o método de fabricação detalhada para as microcolunas hamartomas, contraste e imunofluorescência imagens de cytoarchitecture o esperado e uma discussão abrangente sobre as limitações atuais e futuras direções da fase a técnica.
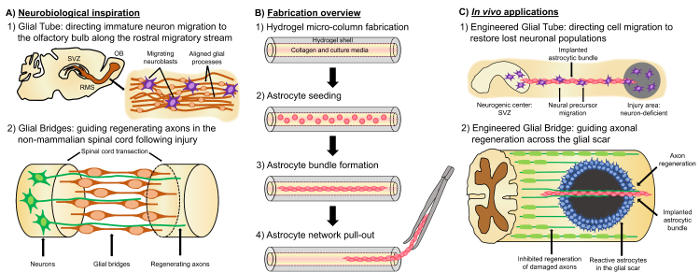
Figura 1: inspiração, protocolo de fabricação e aplicações propostas para as redes de hamartomas alinhadas. (A) neurobiológicos inspiração: neuroblastos (1), originários da zona subventricular neurogênica (SVZ) utilizam o tubo glia alinhado longitudinalmente do fluxo migratório rostral (RMS) para migração dirigida para o bulbo olfatório (OB); (2) não-mamíferos, como os anfíbios e peixes podem sustentar a regeneração após dano no tecido neural em parte devido à formação de uma ponte glia que conecta as extremidades de uma lesão (por exemplo, medula espinhal necrosante) e serve como um andaime para a orientação de regeneração de axônios. (B) visão geral de fabricação: (1) a construção de uma hidrogel de micro-empresas, oco microcoluna com o lúmen revestido com ECM, (2) semeadura do primários astrócitos corticais isolados de filhotes pós-natal, (3) auto-montagem do longitudinalmente orientada pacotes em cultura e (4) extraído do pacote o invólucro de biomaterial para estudos futuros de implantação. (C) na vivo aplicações: (1) estes andaimes de vida podem servir como tubos gliais projetados para a migração de neurônio dirigido de centros neurogênicos repovoar regiões do neurônio-deficiente; (2) recapitulação o mecanismo do desenvolvimento de pioneirismo orientação do axônio e o mecanismo regenerativo das pontes gliais de não-mamíferos pode dotar estes andaimes hamartomas com a capacidade de direcionar a regeneração do axônio através do não-permissivo ambiente da cicatriz glial mamífera. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Quando comparado com o ambiente mais favorável do PNS, o CNS é particularmente limitado em lidar com as consequências prejudiciais de neurotrauma e neurodegeneração. Após um grave insulto ao SNC mamífero, é formada uma cicatriz glial, consistindo de um núcleo de células inflamatórias e fibróticos rodeado por uma densa malha de astrócitos reativos desorganizadas que secretam proteoglicanos inibindo a consequência natural do axônio14. Esta cicatriz atua como uma obstrução física e …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Apoio financeiro foi fornecido pelo National Institutes of Health [U01-NS094340 (Cullen) & F31-NS090746 (Katiyar)], Michael J. Fox Foundation [terapêutico Pipeline programa #9998 (Cullen)], Penn medicina neurociência centro piloto Award (Cullen), Fundação Nacional de ciência [bolsas de pós-graduação pesquisa DGE-1321851 (Struzyna)], departamento de veteranos dos assuntos [RR & D mérito revisão #B1097-eu (Cullen)] e a pesquisa médica do exército dos EUA e Materiel comando [#W81XWH-13-207004 (Cullen) & W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
References
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

