Dreidimensionale Gewebezüchtungen ausgerichtet Astrozyten Netzwerke Nervensystem Regeneration zu rekapitulieren Entwicklungsmechanismen
Summary
Wir präsentieren die Entwicklung des selbst-zusammengebauten, dreidimensionale Bündel longitudinal ausgerichteten astrocytic Somata und Prozesse innerhalb ein neuartiges Biomaterial-Ummantelung. Diese “lebende Gerüste”, präsentiert Mikron-Skala Durchmesser noch Zentimeter in der Länge, Verlängerung dienen als Testumgebungen zu Entwicklungsstörungen Mechanismen zu studieren oder zu erleichtern Neuroregeneration Regie neuronalen Migration und/oder axonalen entwickelt Pathfinding.
Abstract
Neurotrauma und neurodegenerativen Krankheiten führen oft bleibende neurologische Ausfälle aufgrund der begrenzten Kapazität des zentralen Nervensystems (ZNS) zu ersetzen verlorene Neuronen und axonalen Wege zu regenerieren. Jedoch treten während der Entwicklung des Nervensystems, neuronale Migration und axonalen Erweiterung oft entlang von wegen, die von anderen Zellen gebildet, als “lebende Gerüste” bezeichnet. Bestrebt, diese Mechanismen zu emulieren und eine Strategie zu entwerfen, die die hemmende Umwelt des ZNS umgeht, dieses Manuskript stellt ein Protokoll zu fertigen Gewebezüchtungen Astrozyten-basierte “lebenden Gerüste”. Um diese Konstrukte zu erstellen, haben wir ein neuartiges Biomaterial Encasement Schema induzieren Astrozyten, in dichten dreidimensionalen Bündel von bipolaren längs ausgerichtet Somata und Prozessen selbst zusammensetzen beschäftigt. Erste, hohlen Hydrogel Mikro-Spalten wurden zusammengestellt, und im Inneren Lumen mit extrazellulären Kollagen-Matrix beschichtet wurde. Dissoziierte zerebrale kortikale Astrozyten lieferten dann in das Lumen der zylindrischen Mikro-Spalte und mit einem kritischen inneren Durchmesser von < 350 µm, spontan selbst ausgerichtet und beauftragt, lange Faser-wie Kabel bestehend aus dichten Bündel produzieren Astrozyten Prozesse und Kollagen-Fibrillen Messung 97 % Zelle Lebensfähigkeit und wurden fast ausschließlich bestehend aus Astrozyten eine Kombination des intermediate Filament Proteine glial fibrillary sauren Proteins (GFAP), Vimentin, zum Ausdruck zu bringen und nestin. Diese ausgerichtet Astrozyten Netzwerke für neuronalen Anlage zu einem freizügigen Substrat gefunden wurden und Neurit Erweiterung ausgerichtet. Darüber hinaus erhalten diese Konstrukte Integrität und Ausrichtung, wenn die Hydrogel-Ummantelung, eignen sich für die CNS Implantation entnommen. Diese vorgeformten Konstrukte emulieren strukturell wichtigsten Cytoarchitectural Elemente des natürlich vorkommenden Glia-basierte “living Gerüste” in Vivo. Als solche können diese veränderter lebenden Gerüste dienen als Testumgebungen zu Entwicklungsstörungen Mechanismen in Vitro zu studieren oder zu erleichtern Neuroregeneration durch die Leitung der neuronalen Migration und/oder axonalen Wegfindung nach CNS Degeneration in-vivo .
Introduction
Das zentrale Nervensystem (ZNS) hat eine begrenzte Kapazität gegen Verlust und/oder Funktionsstörungen der Nervenzellen und axonalen Signalwege, die Bedingungen wie Schädel-Hirn-Verletzungen (SHT), begleiten Schlaganfall, Rückenmark Verletzungen (SCI) und Neurodegenerative Krankheit1 ,2,3,4,5. Neurogenese im ZNS beschränkt sich auf eine begrenzte Anzahl von Bereichen im Gehirn behindern die Wiederherstellung der verlorenen Neuronen6,7. Darüber hinaus ist Regeneration der verlorenen axonalen Wege im ZNS nicht ausreichend durch das Fehlen einer gezielten Führung, das Vorhandensein von Auswuchs Inhibitoren und reaktive Astrogliosis nach Schäden an Nervengewebe2,8, 9,10. Astrozyten haben in der Regel diverse Funktionen bei der Unterstützung der Neuronen mit Ionen-Homöostase, Neurotransmitter-Clearance, Synapse Bildung und neurovaskuläre Kopplung11. Dennoch können Astrozyten nach auch leichte Schäden an Nervengewebe, molekulare, strukturelle und funktionelle Veränderungen unterziehen, um eine hypertrophe staatliche11Übergang. Als Reaktion auf schwere Neurotrauma führen diese Veränderungen bei der Bildung einer Narbe mit einer Penumbra, Migration von reaktiven Astrozyten und eine Läsion Kern, der Leukozyten von der geplatzten Blut – Hirn-Schranke (BBB), Mikroglia durchgesickert enthält enthält, Oligodendrozyten und Fibroblasten11,12,13. Diese reaktive Astrocyten erreichen eine Morphologie des faserigen, ungeordnete Prozesse und zeigen erhöhte Expression von intermediate Filament Proteine und Chondroitinsulfat Proteoglycans (CSPGs), die neurale Regeneration12behindern. Obwohl die glial Narbe anfangs hilft BBB Integrität wiederherzustellen und Übertragung der Entzündungsreaktion umliegenden gesunden Gewebes zu vermeiden, dient es als biochemische und physikalische Barriere gegen Axon Regeneration12,14 ,15,16. Zum Beispiel Axone, die Begegnung die glial Narbe bauchige dystrophischen Wachstum Kegel anzeigen und verkümmert Wachstum12. Darüber hinaus behindert die Desorganisation der astrocytic Prozesse nach einer Verletzung die Verlängerung der regenerierende Axone17. Das Ergebnis dieser hemmenden Eigenschaften manifestiert sich in der oft dauerhafte körperlichen und neurologischen Beeinträchtigungen, die Patienten nach schweren Neurotrauma leiden, einschließlich TBI und Sci.
Unabhängig von der äußeren Herausforderungen funktionelle Regeneration im ZNS nachweislich die Axone besitzen eine intrinsische Fähigkeit zu regenerieren. Zum Beispiel zufolge die dynamische Natur der dystrophischen Wachstum Kegel in Kontakt mit der glial Narbe diese Endungen behalten ihre Fähigkeit,12zu erweitern. Infolgedessen wird es vermutet, dass als wichtigste Hindernis für axonalen Nachwachsen der hemmenden Umwelt der posttraumatischen CNS und Bereitstellung einer großzügigeren Umgebung über Reduktion glialen Narbenbildung und/oder sofern regenerative Brücken über die Narbe wäre vorteilhaft. In der Tat haben Studien gezeigt, dass ZNS-Neuronen waren in der Lage, die Ausweitung der Axone durch eine Läsion mit peripheren Nerv Transplantationen als Brücken, die ein günstigeres Umfeld für Axon Regeneration12,18zu präsentieren, 19. Mehrere andere Strategien haben verfolgt, um diese verkümmerte Regenerationsfähigkeit zu nutzen. Manipulation der Zelle Wachstum Signalwege in verschiedenen Verletzungen resultieren beispielsweise axonalen Regeneration und glial Narbe Reduktion10,20,21. Darüber hinaus haben Studien gezeigt, dass die Behandlung mit Chrondroitinase ABC, die den Großteil der Zuckerketten in CSPGs zerspaltet, die hemmende Wirkung von CSPGs abgesondert durch reaktive Astrocyten22verringert. Trotz ermutigender Ergebnisse, diese Ansätze bieten keine Führung des Wachstums Zapfen, gerichtet, die potenziell aberrierende Regeneration12führen kann, und auch nicht für den Verlust von Neuronen zu berücksichtigen. Zell-basierte Ansätze wurden genutzt, bei versuchen, die Auswirkungen der glial Narbe zu überwinden und um verlorene Zellen, vor allem Neuronen wieder aufzufüllen. Einige Gruppen haben entdifferenzierten reaktive Astrocyten in Neuronen, während andere neurale Vorläuferzellen in CNS Läsionen zum repopulate Bereich Verletzungen und zur Förderung Axon Regeneration23,24, , verpflanzt haben 25. Stammzelltransplantation allein ist jedoch durch die niedrigen Überlebensraten, mangelhafte Integration und bescheidenen Retention in das geschädigte Gewebe5begrenzt. Darüber hinaus nicht diese Zell-basierte Strategien Fernverkehr axonalen Landstriche, vor allem in einer kontrollierten Weise wiederherzustellen. Daher als Lieferfahrzeuge für verschiedene neuronale Biomaterialien in Kombination mit anderen Ansätzen erforscht und Vorläuferzellen und Wachstum Faktoren26. Biomaterial-basierte Ansätze verfügen über ein hohes Maß an Design-Steuerung, Konstrukte zu produzieren, die die spezifischen körperlichen, Haptotaxic zu imitieren, und chemotaxic Hinweise in der dreidimensionalen (3D) Mikroumgebung der Ziel-Host Gewebe27, 28,29,30,31,32,33,34. Reproduktion von diesen Umweltsignale ist von größter Bedeutung für die transplantierten Zellen, Native-ähnliche Morphologie, Proliferation, Migration und Signaltechnik, unter anderen neurobiologischen Eigenschaften29zu präsentieren. Trotz dieser vorteilhaften Eigenschaften ist Fortschritt jenseits traditioneller Zelle ausgesät Biomaterial Gerüste erforderlich, um gleichzeitig Regie Fernverkehr axonalen Regeneration fördern und ersetzen verlorene Neuronen.
Eine vielversprechende alternative Ansatz basiert auf Nervengewebe entwickelt “lebenden Gerüste”, unterscheidet sich von anderen Zell-basierte Ansätze aufgrund des Vorhandenseins von lebenden Nervenzellen mit einem vorgeformten Cytoarchitecture, die native Neuroanatomie emuliert und/oder Entwicklungsmechanismen gezielte Ersatz, Wiederaufbau und Regenerierung der neuralen Schaltkreis4,35zu erleichtern. Überlegungen für die Gestaltung von lebendigen Gerüste gehören die Phänotypen und Quellen von neuronalen Zellen sowie die mechanische/physikalische Eigenschaften und die biochemische Signale durch die Zusammensetzung der begleitenden Biomaterialien35diktiert. Nach Fertigung in Vitro, diese lebenden Gerüste können implantiert in Vivo vorhanden Zelle Adhäsionsmoleküle und chemotaktische und neurotrophe Signale zum neuronalen Zellwanderung und Axon Auswuchs je nach Zustand aktiv regulieren und Fortschreiten der regenerativen Prozesse35. Gliazellen dienen als Grundlage für die veränderter Cytoarchitecture lebenden Gerüste, da diese Zellen verschiedene Entwicklungsmechanismen in Vivozu vermitteln. Während der Entwicklung des Gehirns setzen neue Neuronen auf basalen Prozesse durch radiale Gliazellen aus der ventrikulären Zone in Richtung der Entwicklung kortikale Platte als lebende Gerüste für gerichtete Migration36,37erweitert. Darüber hinaus erweitern Wachstum sind Zapfen gezeigt, sich zu orientieren, durch Sensierung attraktiv und abweisend Signale ausgelöst durch Wegweiser Glia-Zellen, und sogenannte “Pionierarbeit” Axone werden vorgeschlagen, um die richtigen Ziele zu erreichen, durch die Ausdehnung entlang Pre-gemusterten Glia 35,38,39Gerüste. Gliazellen sind also notwendig, um die Führung des bahnbrechenden Axone, die später als Axon-basierte dienen “lebenden Gerüste” um die Projektion der “Mitläufer” Axone leiten. Darüber hinaus Glia-vermittelten Wachstum Mechanismen haben gezeigt, dass postnatal, fortbestehen folgendermaßen Neuroblasten rostral wandernden Stream (RMS), aus der subventricular Zone (SVZ), einer der wenigen verbliebenen Bereiche der Neurogenese im erwachsenen Gehirn zu navigieren die Riechkolben (OB)40. Diese Neuroblasten in der RMS migrieren innerhalb der Glia Röhre (Abbildung 1A-1), die besteht aus längs ausgerichteten astrocytic Prozesse, über direkten Zell-Zell-Verwachsungen und lokalisiert lösliche Faktoren37, 41. schließlich während CNS Schäden in Säugetieren Ursachen astrocytic Prozess Anordnung bilden eine glial Narbe, die körperlich axonale Regeneration17 gestört behindert, viele nicht-Säugetier-Systemen fehlt die Bildung einer nachteiligen glial Narbe. Vielmehr pflegen Gliazellen des nicht-Säugetier-Arten mehr organisiert, ausgerichtet von Mustern, die als Führer durch die verletzte Region17,42,43verwendet werden. Zum Beispiel nicht-Säugetier-SCI-Modelle, Axone entnehmen Sie bitte weiter in enger Zusammenarbeit mit Glia Brücken über der Läsion, schlägt eine wichtige Rolle für organisierte Glia Gerüste als Erleichterung der axonalen Regeneration und funktionelle Wiederherstellung (Substrate Abbildung 1A -2) 42 , 44 , 45. Reprise der neuroanatomischen Eigenschaften und die Entwicklungs-/regenerative Mechanismen, die oben beschriebenen kann dies zu eine neue Klasse von veränderter Glia-basierte lebenden Gerüste, die unreif neuronalen Migration gleichzeitig fahren können und axonalen Wegfindung durch ansonsten freizügigen Umgebungen, damit potenziell Minderung der Auswirkungen von neuronalen und Axon Trakt Degeneration mit CNS Verletzung und Krankheit verbunden.
Unsere Forschungsgruppe hat bereits mehrere Arten von lebenden Gerüste für den Wiederaufbau entworfen und Regeneration der axonalen Traktate in das ZNS und das periphere Nervensystem (PNS) über Micro-Gewebe entwickelt, neuronale Netze (Mikro-TENNs) und Gewebe Nerv Transplantationen (TENGs) bzw.27,46,47,48entwickelt. Beide Strategien basieren grundsätzlich auf Biomimicry. Mikro-TENNs sind anatomisch inspirierte Strukturen strukturell und funktionell axonalen Traktate verbinden unterschiedliche neuronale Populationen des Gehirns ersetzen soll. TENGs ausnutzen den Entwicklungsbiologie Mechanismus der Axon erleichtert axonalen Regeneration, veranschaulicht durch “Mitläufer” Axon Wachstum entlang “Pionier” Axone, gezielte Host axonalen Regeneration35,46,48zu erreichen. Wir vor kurzem auf die Vielseitigkeit des Gerüstes lebenden aktiviert Technik mit einem ähnlichen Schema Ummantelung als Mikro-TENNs und inspirieren von den Glia-basierte Mechanismen zu präsentieren, während der gesamten Entwicklung. Hier haben wir Konstrukte bestehend aus ausgerichteten astrocytic Bündel überspannt das kollagene Lumen ein Hydrogel Mikro-Spalte49entwickelt. Diese astrocytic lebenden Gerüste werden von ersten füllen eine Kapillare Rohr-Akupunktur Nadel Montage mit flüssige Agarose Erstellen einer hohlen zylindrischen Hydrogel mit einem Außendurchmesser (OD) und Innendurchmesser (ID) entspricht der Durchmesser der entwickelt die Schlauch und Nadel, beziehungsweise. Nach Agarose Gelierung und Extraktion der Hydrogel Mikro-Spalte aus der Kapillare, die innen hohl ist beschichtet mit Typ ich Kollagen, ein Umfeld für Astrozyten Adhäsion permissive liefern und ausgerichtet Bundle Bildung (Abbildung 1 b -1). Danach ist das Lumen mit zerebrale kortikale Astrozyten isoliert vom postnatalen Ratte Welpen (Abbildung 1 b-2) ausgesät. Im Gegensatz zu zweidimensionalen (2D) Ausrichtung Techniken, die auf die Anwendung von elektrischen Feldern, Micropatterned Rillen und extrazelluläre Matrix (ECM) Protein-Strukturierung, Astrozyten Ausrichtung in die lebendige Gerüst stützt sich Technik auf Selbstmontage nach steuerbare Variablen wie Substrat Krümmung (Spalte ID), Zelldichte und Kollagen Konzentration50,51,52. Die Astrozyten Vertrag umzugestalten das Kollagen und erwerben eine bipolare, längs ausgerichtet Morphologie, die analog zu den natürlichen Gerüste in Vivo (Abbildung 1 b-3) beobachtet. In der Tat verfolgen wir aktiv den Einsatz dieser Kabel-ähnliche Strukturen als physische Substrate für gezielte Führung des Migration unreifer Nervenzellen sowie Erleichterung der axonalen Regeneration durch die ungünstigen Umfeld des beschädigten ZNS, insbesondere die Säugetier-glial Narbe (Abbildung 1). Dieser Artikel wird die detaillierte Herstellungsverfahren für die astrocytic Mikro-Spalten präsentieren, phase Kontrast und Immunfluoreszenz Bilder von der erwarteten Cytoarchitecture und eine umfassende Diskussion über die aktuellen Beschränkungen und zukünftige Richtungen von der Technik.
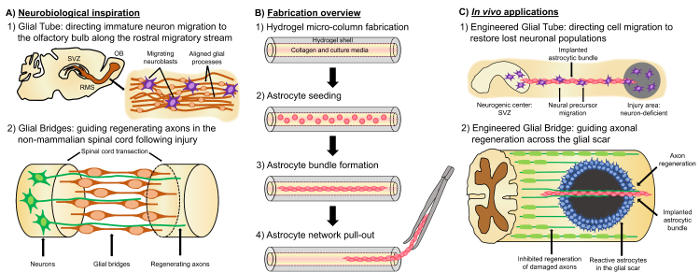
Abbildung 1: Inspiration, Herstellung Protokoll und vorgeschlagenen Anwendungen für die ausgerichteten Astrocytic Netzwerke. (A) neurobiologische Inspiration: (1) Neuroblasten aus der neurogenen subventricular Zone (SVZ) nutzen das längs ausgerichtete Glia Rohr in den rostral wandernden Stream (RMS) für gerichtete Migration in den Riechkolben (OB); (2) nicht-Säugetiere wie Amphibien und Fischen verträgt Regeneration nach Nervengewebe Schäden teilweise durch die Bildung einer Glia Brücke, die verbindet die Enden einer Läsion (z.B. durchtrennten Rückenmark) und dient als Gerüst für die Führung des regenerierende Axone. (B) Herstellung Übersicht: (1) Bau einer Mikrometer Größe, hohlen Hydrogel Mikro-Spalte mit dem Lumen mit ECM, beschichtet (2) Aussaat von primären kortikalen Astrozyten isoliert vom postnatalen Ratte Welpen (3) Selbstmontage der längs-orientierte Bündel in Kultur und (4) Extraktion des Bundles aus Biomaterial-Ummantelung für zukünftige Implantation Studien. (C) In Vivo Anwendungen: (1) diese lebenden Gerüste können dienen als veränderter Glia Rohre für gerichtete Neuron Migration von neurogenen Zentren Neuron-defizienten Regionen; neu aufzufüllen (2) Reprise des developmental Mechanismus von zukunftsweisenden Axon Guidance und der regenerativen Mechanismus der Glia Brücken in nicht-Säugetiere kann diese astrocytic Gerüste mit einer Kapazität von Axon Regeneration über die non-permissive direkte verleihen. Umgebung der Säugetier-glial Narbe. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Im Vergleich zu mehr unterstützendes Umfeld der PNS beschränkt die CNS besonders im Umgang mit den nachteiligen Folgen der Neurotrauma und Neurodegeneration. Nach eine schwere Beleidigung der Säugetier-CNS wird eine glial Narbe gebildet, bestehend aus einem Kern von fibrotischen und entzündlichen Zellen umgeben von einem dichten Geflecht unorganisiert reaktive Astrocyten, die Axon Auswuchs hemmende Proteoglycans14absondern. Diese Narbe wirkt wie ein physischer und biochemischer Hindernis gegen…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Finanziell wurde unterstützt durch die National Institutes of Health [U01-NS094340 (Cullen) & F31-NS090746 (Katiyar)], Michael J. Fox Foundation [therapeutische Pipeline Programm #9998 (Cullen)], Penn Medizin Neuroscience Center Pilot Award (Cullen) National Science Foundation [Graduate Research Fellowships DGE-1321851 (Struzyna)], Department of Veterans Affairs [RR & D Verdienst Bewertung #B1097-ich (Cullen)], und die US Army Medical Research und Materiel Command [#W81XWH-13-207004 (Cullen) & W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
References
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

