Tessutale tridimensionale allineato Astrocyte reti per ricapitolare i meccanismi dello sviluppo e facilitare la rigenerazione del sistema nervoso
Summary
Presenteremo lo sviluppo di auto-assemblati, tridimensionale fasci di somata astrocytic allineati longitudinalmente e processi all’interno di un encasement romanzo biomateriale. Questi ingegnerizzato “ponteggi vivente”, che esibiscono micron-scala diametro ancora estendere centimetri di lunghezza, può servire come banchi di prova per lo studio dei meccanismi dello sviluppo neurologico o facilitare la neurorigenerazione di regia della migrazione neuronale e/o assonale path-finding.
Abstract
Malattia di neurodegenerative e neurotrauma provocare spesso durevole deficit neurologici a causa della limitata capacità del sistema nervoso centrale (CNS) per sostituire i neuroni persi e rigenerare le vie axonal. Tuttavia, durante lo sviluppo del sistema nervoso, della migrazione neuronale ed assonale estensione spesso si verificano lungo le vie formate da altre cellule, indicato come “vita ponteggi”. Cercando di emulare questi meccanismi e per progettare una strategia che elude l’ambiente inibitorio del SNC, questo manoscritto presenta un protocollo per fabbricare tessuti ingegnerizzati basati su astrociti “vivente ponteggi”. Per creare questi costrutti, abbiamo impiegato uno schema di encasement del romanzo biomateriale per indurre gli astrociti di auto-assemblarsi in tridimensionale densi fasci di bipolare somata allineati longitudinalmente e processi. Idrogel in primo luogo, cavo micro-colonne erano riunite, e il lume interno è stato rivestito con collagene-matrice extracellulare. Astrocytes corticali cerebrali dissociato quindi sono state consegnate nel lumen della micro-colonna cilindrica e, a un diametro interno critico di < 350 µm, spontaneamente auto-allineati e contratta per produrre fibra come lunghi cavi composto densi fasci dei processi di astrociti e fibrille di collagene misura 97% vitalità cellulare e sono stati quasi esclusivamente composta da astrociti esprimendo una combinazione del filamento intermedio proteine glial-proteina silicea fibrillare (GFAP), vimentina e nestina. Questi stati allineati Astrocita reti sono state trovate per fornire un substrato permissivo per il fissaggio di un neurone e allineato del neurite estensione. Inoltre, questi costrutti mantengono l’integrità e l’allineamento quando estratti dal encasement di idrogel, che li rende adatti per l’impianto di CNS. Questi costrutti preformati strutturalmente emulano gli elementi chiave cytoarchitectural di biofiltri glial-based “vivere impalcature” in vivo. Come tale, queste impalcature derivati dal vivente possono servire come banchi di prova per studiare neurodevelopmental meccanismi in vitro o facilitare la neurorigenerazione dirigendo la migrazione neuronale e/o pathfinding axonal seguendo la degenerazione di CNS in vivo .
Introduction
Il sistema nervoso centrale (SNC) ha una capacità limitata per contrastare la perdita e/o disfunzione dei neuroni e vie axonal che accompagnano condizioni come la ferita di cervello traumatica (TBI), ictus, malattia di ferita (SCI) e neurodegenerative del midollo spinale1 ,2,3,4,5. Neurogenesi nel SNC è limitata a un numero limitato di aree del cervello, che ostacolano il restauro di neuroni persi6,7. Inoltre, la rigenerazione delle vie axonal perse nello SNC è insufficiente a causa della mancanza di orientamento diretto, la presenza di inibitori di conseguenza e astrogliosi reattiva dopo danno di tessuto neurale2,8, 9,10. Astrociti in genere hanno diverse funzioni nell’assistere i neuroni con omeostasi ionica, neurotrasmettitore gioco, formazione della sinapsi e neurovascular attacco11. Tuttavia, in seguito anche lievi danni al tessuto neurale, astrocytes possono subire variazioni molecolari, strutturali e funzionali come la transizione a un stato ipertrofico11. In risposta a grave neurotrauma, questi cambiamenti provocano la formazione di una cicatrice con una penombra contenente la migrazione astrociti reattivi e un nucleo di lesione che include leucociti trapelati dalla rottura emato – encefalica (BBB), microglia, oligodendrociti e fibroblasti11,12,13. Questi astrociti reattivi raggiungono una morfologia dei processi filamentosi, disorganizzati ed esibiscono l’espressione aumentata di proteine dei filamenti intermedi e proteoglicani Condroitin solfato (CSPG), che ostacolano la rigenerazione neurale12. Anche se inizialmente la cicatrice gliale aiuta a ripristinare l’integrità BBB ed evitare la trasmissione della risposta infiammatoria al tessuto sano circostante, serve come una barriera fisica e biochimica contro assone rigenerazione12,14 ,15,16. Per esempio, gli assoni che incontrano la cicatrice gliale visualizzare dei coni di crescita distrofica bulboso e stentata crescita12. Inoltre, la disorganizzazione dei processi astrocitari dopo lesione impedisce l’estensione della rigenerazione di assoni17. Il risultato di queste caratteristiche inibitorie si manifesta spesso permanenti menomazioni fisiche e neurologiche che pazienti soffrono dopo neurotrauma grave, tra cui TBI e SCI.
Indipendentemente dalle sfide estrinseche funzionale rigenerazione nel SNC, assoni hanno dimostrati di possedere un’intrinseca capacità di rigenerarsi. Per esempio, la natura dinamica dei coni di crescita distrofico a contatto con la cicatrice gliale suggerisce che queste terminazioni mantengono la loro capacità di estendere12. Di conseguenza, si ritiene che un ostacolo principale alla ricrescita assonale è l’ambiente inibitorio del SNC di alberino-ferito e che fornendo un ambiente più permissivo via la riduzione di cicatrici e/o fornendo rigenerative ponti attraverso la cicatrice sarebbe glial vantaggioso. Infatti, studi precedenti hanno dimostrato che i neuroni CNS erano capaci di estendere gli assoni attraverso una lesione usando gli innesti di nervi periferici come ponti, che presentano un ambiente più favorevole per assone rigenerazione12,18, 19. Parecchie altre strategie sono state perseguite per sfruttare questa capacità rigenerativa vestigiale. Ad esempio, manipolazione delle vie di segnalazione cellulare crescita in vari modelli di lesione ha provocato la rigenerazione assonale e cicatrice gliale riduzione10,20,21. Inoltre, gli studi hanno indicato che il trattamento con chondroitinase ABC, che scinde la maggior parte delle catene dello zucchero in CSPG, diminuisce l’effetto inibitorio di CSPG secernuto da astrociti reattivi22. Nonostante incoraggianti i risultati, questi approcci non forniscono diretto orientamento dei coni di crescita, che può potenzialmente causare rigenerazione aberrante12e inoltre non tengono conto della perdita di neuroni. Approcci basati su cellule sono stati utilizzati nei tentativi per superare gli effetti della cicatrice gliale e per ricostituire le cellule perse, in particolare i neuroni. Alcuni gruppi hanno dedifferenziate di astrociti reattivi nei neuroni, mentre gli altri sono trapiantate cellule progenitrici neurali in lesioni dello SNC di ripopolare la zona ferita e promuovere assone rigenerazione23,24, 25. Tuttavia, trapianto di cellule staminali è limitato dalla bassa sopravvivenza, scarsa integrazione e conservazione modesta nel tessuto danneggiato5. Inoltre, queste strategie basate sulle cellule non riescono a ripristinare a distanza axonal tratti, soprattutto in un modo controllato. Di conseguenza, biomateriali in combinazione con altri approcci stanno esplorande come veicoli di consegna per vari neurale e fattori di crescita e cellule progenitrici26. Approcci basati su biomateriali presentano un elevato grado di controllo di progettazione per la produzione di costrutti che imitano le specifiche fisiche, haptotaxic, e chemotaxic spunti presentano nel microambiente tridimensionale (3D) di destinazione host tessuto27, 28,29,30,31,32,33,34. Riproduzione di questi segnali ambientali è preminente per cellule trapiantate a presentare nativo-come la morfologia, la proliferazione, migrazione e segnalazione, tra le altre caratteristiche neurobiologiche29. Nonostante queste proprietà vantaggiose, avanzamento oltre tradizionale delle cellule seminate biomateriale ponteggi è necessaria per promuovere la rigenerazione assonale interurbano diretta e sostituire i neuroni persi contemporaneamente.
Un promettente approccio alternativo si basa su tessuto neurale ingegnerizzato “ponteggi vivente”, che sono distinti da altri approcci basati su cellule a causa della presenza di cellule neurali viventi con un cytoarchitecture preformato che emula neuroanatomia nativo e/o meccanismi per facilitare la sostituzione mirata, la ricostruzione e la rinascita di circuiti neurali4,35. Considerazioni per la progettazione di ponteggi viventi includono i fenotipi e le fonti di cellule neurali, come pure le proprietà fisiche e meccaniche e i segnali biochimici dettata dalla composizione di qualsiasi accompagnamento di biomateriali35. Dopo il montaggio in vitro, queste impalcature vivente possono essere impiantato in vivo di molecole di adesione cellulare presente e chemiotattica e neurotrophic segnali per regolare attivamente la migrazione delle cellule neurali e crescita assonale a seconda dello stato e progressione dei processi rigenerativi35. Le cellule gliali possono servire come base per i derivati dal cytoarchitecture di vita ponteggi poiché queste cellule mediano vari meccanismi in vivo. Durante lo sviluppo cerebrale, nuovi neuroni si basano su processi basali esteso da glia radiale dalla zona ventricolare verso la piastra corticale in via di sviluppo come vivente impalcature per migrazione diretto36,37. Inoltre, estendendo la crescita coni sono mostrato a orientarsi rilevando segnali attraenti e repellenti suscitati dalle cellule gliali guidepost e cosiddetto “pionieristico” assoni sono consigliati per raggiungere gli obiettivi corretti estendendo lungo pre-modellato glial ponteggi di35,38,39. Così, le cellule gliali sono necessari per la Guida di avanguardia di assoni, che più tardi servono come assone-based “ponteggi vivente” per dirigere la proiezione degli assoni “seguace”. Inoltre, meccanismi di crescita mediata da cellule gliali sono stati indicati a persistere dopo la nascita, come neuroblasti seguono migratori rostrale (RMS) per spostarsi dalla zona subventricolare (SVZ), una delle poche regioni di neurogenesi nel cervello adulto, per il bulbo olfattivo (OB)40. Questi neuroblasti nel RMS migrano all’interno del tubo glial (Figura 1A-1), che è costituito da processi astrocitari allineati longitudinalmente, tramite le adesioni cellula-cellula diretto e localizzato fattori solubili37, 41. Infine, mentre danno dello SNC in cause di mammiferi perturbato disposizione astrocytic processo formando una cicatrice gliale che fisicamente impedisce la rigenerazione assonale17, molti sistemi di mammiferi mancano la formazione di una cicatrice gliale dannosa. Piuttosto, le cellule gliali di specie di mammiferi mantengono più organizzato, allineato modelli che vengono utilizzati come guide attraverso la regione feriti17,42,43. Per esempio, nei modelli SCI non derivanti da mammiferi, assoni sono mostrati a crescere in stretta associazione con glial ponti che attraversano la lesione, suggerendo un ruolo importante per ponteggi glial organizzati come substrati facilitando la rigenerazione assonale e recupero funzionale ( Figura 1A -2) 42 , 44 , 45. ricapitolazione delle caratteristiche neuroanatomiche e i meccanismi dello sviluppo/rigenerativo descritti sopra può produrre una nuova classe di derivati dal vivere glial basato su impalcature che contemporaneamente possono guidare immatura migrazione neuronale ed assonale path-finding attraverso ambienti altrimenti non permissivi, quindi potenzialmente mitigare gli effetti di un neurone e la degenerazione del tratto dell’assone associato con lesione dello SNC e malattia.
Il nostro gruppo di ricerca ha già progettato più tipi di ponteggi vivente per la ricostruzione e rigenerazione di axonal tratti nel sistema nervoso centrale e sistema nervoso periferico (PNS) tramite micro-tessuto ingegnerizzato reti neurali (micro-teen) e tessuto innesti ingegnerizzati del nervo (TENGs), rispettivamente27,46,47,48. Entrambe le strategie dipendono intrinsecamente biomimetica. Micro-teen sono strutture anatomicamente ispirato alla strutturalmente e funzionalmente sostituire axonal tratti collegamento distinte popolazioni neuronali del cervello. TENGs sfruttare il meccanismo inerente allo sviluppo di assone-facilitato la rigenerazione assonale, esemplificato dalla crescita assonale “seguace” lungo gli assoni “pioniere”, per raggiungere la destinazione host la rigenerazione assonale35,46,48. Abbiamo recentemente sfruttato la versatilità dello scaffold vivente tecnica mediante uno schema simile di encasement come micro-teen e in cerca di ispirazione dai meccanismi basati su cellule gliali presenti nel corso dello sviluppo. Qui, abbiamo sviluppato costrutti costituito da fasci astrocytic allineati che abbracciano il lume collageno di un idrogel micro-colonna49. Queste impalcature astrocytic viventi sono state sviluppate da primo riempimento un gruppo di ago di agopuntura-tubo capillare con agarosio liquido per creare un idrogel cavo cilindrico con un diametro esterno (OD) e il diametro interno (ID) corrispondenti ai diametri della tubo ed ago, rispettivamente. A seguito dell’agarosi gelificazione ed estrazione di idrogel micro-colonna dal tubo capillare, interno cavo è rivestito con tipo I collagene per fornire un ambiente permissivo per adesione di astrociti e allineato bundle formazione (Figura 1B -1). In seguito, il lumen è seminato con i astrocytes corticali cerebrali isolati da cuccioli del ratto postnatale (Figura 1B-2). Contrariamente alle tecniche bidimensionali (2D) allineamento che si basano sull’applicazione di campi elettrici, bioerodibili scanalature e matrice extracellulare della proteina (ECM) patterning, allineamento di astrociti nell’impalcatura di vita tecnica si basa sulla auto-assemblaggio secondo variabili controllabili come substrato curvatura (ID di colonna), la densità delle cellule e collagene concentrazione50,51,52. Gli astrociti contraggono e rimodellano il collagene e di acquisiscono una morfologia bipolare, allineati longitudinalmente analoga per i ponteggi naturali osservati in vivo (Figura 1B-3). Infatti, stiamo attivamente perseguendo l’uso di questi cavo-come le strutture come substrati fisici per un orientamento mirato di migrazione neuroni immaturi, nonché facilitare la rigenerazione assonale attraverso l’ambiente sfavorevole del danneggiato snc, in particolare la cicatrice gliale mammiferi (Figura 1). Questo articolo verrà presentare il metodo di fabbricazione dettagliato per le micro-colonne astrocytic, contrasto e immunofluorescenza immagini della citoarchitettura previsto e per una discussione esaustiva sulle limitazioni attuali e future direzioni di fase i tecnica.
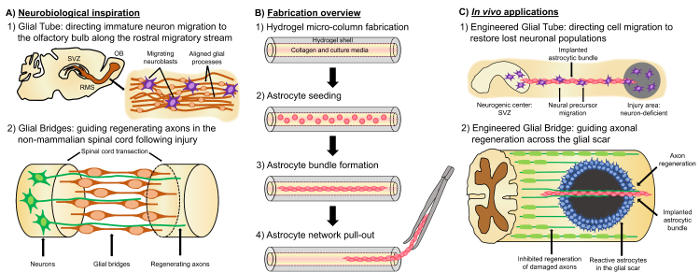
Figura 1: ispirazione, protocollo di fabbricazione e applicazioni proposte per le reti di Astrocytic allineate. Ispirazione neurobiologica (A): (1) neuroblasti provenienti dalla zona subventricular neurogena (SVZ) utilizzano il tubo glial allineato longitudinalmente in rostrale migratori (RMS) per la migrazione diretto verso il bulbo olfattivo (OB); (2) Non-mammiferi come anfibi e pesci possono sostenere la rigenerazione dopo tessuto neurale in parte i danni dovuti alla formazione di un ponte glial che collega le estremità di una lesione (ad es. transected del midollo spinale) e serve come impalcatura per la Guida di assoni di rigenerazione. (B) Panoramica di fabbricazione: (1) costruzione di un’idrogel micron di dimensioni medie, cavo micro-colonna con il lume rivestito con ECM, (2) semina di astrociti corticali primari isolati da cuccioli del ratto postnatale, (3) auto-assemblaggio di longitudinalmente orientati verso il fasci di cultura ed estrazione (4) del fascio dal encasement del biomateriale per gli studi futuri dell’impianto. (C) applicazioni In vivo : (1) Queste impalcature vivente possono servire come tubi gliali ingegnerizzati per migrazione neuronale diretto da neurogene centri per ripopolare le regioni del neurone-carenti; (2) ricapitolazione del meccanismo dello sviluppo di avanguardia di orientamento dell’assone e il meccanismo rigenerativo di glial ponti in non-mammiferi può dotare queste impalcature astrocitari con la capacità di dirigere la rigenerazione assonale attraverso il non permissivi ambiente della cicatrice gliale dei mammiferi. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Rispetto per l’ambiente più favorevole del PNS, il CNS è notevolmente ridotto a gestire le conseguenze pregiudizievoli di neurotrauma e neurodegenerazione. Dopo un grave insulto al sistema nervoso centrale dei mammiferi, si forma una cicatrice gliale, costituito un nucleo di cellule infiammatorie e fibrotiche circondata da un denso reticolo di astrociti reattivi disorganizzati che secernono assone escrescenza-inibizione proteoglicani14. Questa cicatrice agisce come un’ostruzione fisica e biochim…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Il sostegno finanziario è stato fornito dal National Institutes of Health [U01-NS094340 (Cullen) & F31-NS090746 (Katiyar)], Michael J. Fox Foundation [terapeutico Pipeline programma #9998 (Cullen)], Penn medicina Neuroscience Center Pilot Award (Cullen), National Science Foundation [Graduate Research Fellowships DGE-1321851 (Struzyna)], Department of Veterans Affairs [RR & D merito recensione B1097 #-ho (Cullen)] e l’US Army Medical Research e Materiel Command [n #W81XWH-13-207004 (Cullen) & W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
References
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

