Трехмерные ткани спроектированы в соответствие экзоцитоз сетей для пилки развития механизмов и содействия регенерации нервной системы
Summary
Мы витрина развития собственн-собранные, трехмерные связки продольно соответствие Астроцитарная somata и процессов в рамках Роман биоматериала оболочки. Эти инженерии «живые леса», экспонируется микрон шкала диаметр еще расширение сантиметров в длину, могут служить в качестве тест кровать изучения механизмов психомоторного развития или облегчить neuroregeneration направляющие нейронной миграции и/или аксональное Поиск пути.
Abstract
Нейротравма и нейродегенеративные заболевания часто приводят к прочному неврологического дефицита из-за ограниченных возможностей центральной нервной системы (ЦНС) для замены потерянных нейронов и регенерировать аксональное пути. Однако во время развития нервной системы, нейронной миграции и аксональной расширение часто происходят вдоль путей, образованный другие клетки, называют «живые леса». Стремясь подражать Эти механизмы и разработать стратегию, которая обходит среды ингибирующих ЦНС, эта рукопись представляет протокол для изготовления тканей спроектированы на основе экзоцитоз «живые леса». Для создания этих конструкций, мы используем схему оболочки Роман биоматериала, чтобы побудить астроциты самостоятельно собрать в плотной трехмерные жгуты биполярного продольно по краю somata и процессов. Во-первых, полые гидрогеля микро столбцы были собраны, и внутренний просвет был покрыт коллагена внеклеточного матрицы. Диссоциированных мозговой коры астроциты затем были доставлены в просвете цилиндрических микро колонки и в критических внутренний диаметр < 350 мкм, спонтанно самостоятельно выровнены и контракт производить долго волоконно как кабели, состоящий из плотных пучков экзоцитоз процессов и фибрилл коллагена измерения 97% клеток жизнеспособность и были практически исключительно состоит из астроцитов, выражая сочетание промежуточного накаливания белки глиальных фибриллово кислой белка (СВМС), виментин и Нестин. Это соответствие экзоцитоз сетей были найдены для предоставления разрешительной субстрата для нейронов вложения и по краю neurite расширение. Кроме того эти конструкции сохранять целостность и выравнивание при извлечении из гидрогеля оболочки, что делает их пригодными для имплантации ЦНС. Эти предварительно конструкции структурно подражать cytoarchitectural ключевые элементы естественным глиальных на основе «живые леса» в естественных условиях. Таким образом эти инженерии жизни леса могут служить в качестве тест кровать учиться психомоторного развития механизмов в пробирке или облегчить neuroregeneration, направляя нейронной миграции и/или аксональное пути после ЦНС дегенерации в естественных условиях .
Introduction
Центральной нервной системы (ЦНС) имеет ограниченные возможности противодействовать потери и/или дисфункции нейронов и аксональной пути, которые сопровождают условий, таких как черепно-мозговой травмы (ЧМТ), инсульт, травме (ТСТ) и нейродегенеративных заболеваний спинного1 ,–2,–3,–4,–5. Нейрогенез в ЦНС ограничивается ограниченное количество областей в мозге, препятствует восстановлению утраченных нейронов6,7. Кроме того восстановление утраченных аксональное путей в ЦНС недостаточно из-за отсутствия направленного указаний, присутствие ингибиторов нарост и реактивной astrogliosis после повреждения нервной ткани2,8, 9,10. Астроциты, как правило, имеют различные функции в деле оказания помощи нейронов с ионного гомеостаза, Распродажа нейромедиатора, формирования синапсов и нервно-сосудистых муфты11. Тем не менее после даже умеренные повреждения нервной ткани, астроциты могут пройти молекулярные, структурные и функциональные изменения, как они переход к гипертрофических состояние11. В ответ на серьезные нейротравма эти изменения приводят к формированию шрам с полутень, содержащие перенос реактивной астроциты и поражения ядро, которое включает в себя лейкоциты, утечка из расколовшегося гематоэнцефалический барьер (ГЭБ), микроглии, Олигодендроциты и фибробласты11,12,13. Эти реактивные астроциты достичь морфология нитевидные, неорганизованное процессов и демонстрируют увеличение выражение промежуточного накаливания белков и протеогликаны хондроитин сульфат (CSPGs), которые препятствуют нейронная регенерация12. Несмотря на то, что глиальный рубец первоначально помогает восстановить целостность BBB и избежать передачи воспалительной реакции на окружающие здоровые ткани, он служит физических и биохимических барьер против регенерации аксона12,14 ,,1516. Например аксоны которых сталкиваются глиальный рубец отображения луковичных дистрофические роста шишки и сдерживали рост12. Кроме того дезорганизация Астроцитарная процессов после травмы препятствует расширение регенерировать аксоны17. Итоги этих характеристик тормозной проявляется в часто постоянного физические и неврологические расстройства, которые пациенты страдают после тяжелой нейротравма, включая ЧМТ и SCI.
Независимо от того, внешние задачи, стоящие перед функциональным регенерации в ЦНС аксоны было показано, обладают внутреннюю способность к регенерации. Например динамический характер дистрофические роста конусов при контакте с глиальный рубец свидетельствует о том, что эти окончаний сохраняют свою способность расширять12. Следовательно считается, что основным препятствием для аксональное re рост является среды ингибирующих после травмы ЦНС и что предоставление более питательную среду через сокращение глиальных рубцов и/или предоставление восстановительной мосты через шрам будет выгодно. Действительно предыдущие исследования показали, что нейронов ЦНС способны расширения аксоны через поражения с помощью периферических нервов графтов как мосты, которые создают более благоприятные условия для axon регенерации12,18, 19. Ряд других стратегий предпринимались эксплуатировать этот рудиментарный регенеративной способностью. К примеру манипуляции клеток роста сигнальных путей в различных моделях травмы привело к аксональное регенерации и глиальных Шрам сокращения10,,2021. Кроме того исследования показали, что лечение с chondroitinase ABC, который расщепляет большинство цепочки сахара в CSPGs, уменьшает эффект CSPGs, выделяемый реактивной астроциты22. Несмотря на обнадеживающие результаты, эти подходы не дают направлен руководством конусы роста, которые потенциально может приводить к аномальным регенерации12, а также не учитывают потери нейронов. Подходы на основе клеток были использованы в попытках преодолеть последствия глиальный рубец и пополнить потерянные клеток, особенно нейронов. Некоторые группы Дедифференцированная реактивной астроциты в нейроны, в то время как другие пересажены нейронных прогениторных клеток в поражениях ЦНС населить области травмы и поощрять аксона регенерации23,24, 25. Однако, трансплантация стволовых клеток только ограничивается низкой выживаемости, плохое интеграции и скромный удержания в поврежденной ткани5. Кроме того эти стратегии на основе клеток удастся восстановить междугородной аксональное участки, особенно в контролируемым образом. Таким образом биоматериалов в сочетании с другими подходами в настоящее время изучаются как средства доставки для различных нейронных и клеток-предшественников и роста факторы26. Подходы на основе биоматериала имеют высокую степень управления дизайн для производства конструкций, которые имитируют конкретные физические, haptotaxic, и chemotaxic сигналы в трехмерной (3D) микроокружения целевого узла ткани27, 28,29,30,,3132,,3334. Воспроизведение этих экологических сигналов имеет первостепенное значение для пересаженные клетки представить родной как морфология, распространения, миграции и сигнализации, среди других нейробиологических характеристики29. Несмотря на эти выгодные свойства улучшению за пределами традиционных клеток посеян биоматериала подмостей требуется одновременно направлены междугородной аксональное регенерации и заменить потерянные нейронов.
Обещая альтернативный подход основан на нервной ткани инженерии «живые леса», которые отличаются от других подходов, основанных на ячейки, из-за присутствия живых нервных клеток с предварительно cytoarchitecture, что эмулирует родной нейроанатомия и/или развития механизмов для облегчения целевых замена, восстановление и регенерация нейронной схемы4,35. Соображения по проектированию жизни леса включают фенотипы и источники нервные клетки, а также механические/физические свойства и биохимические сигналы продиктовано состав любых сопровождающих биоматериалов35. После изготовления в пробирке, эти живые леса может быть имплантирован в естественных условиях настоящего молекул клеточной адгезии и эозинофилов и нейротрофическими сигналы активно регулировать миграцию нервных клеток и аксон нарост в зависимости от государства и прогрессирование регенераторные процессы35. Глиальные клетки может служить основой для инженерных cytoarchitecture жизни леса, так как эти клетки посредником различные механизмы развития в естественных условиях. Во время развития мозга новые нейроны полагаются на базальную процессы, продлен на радиальной глии из желудочков зоны к развивающихся корковых пластины как живые леса для миграции направлены36,37. Кроме того расширение роста шишки показано ориентироваться по зондирования привлекательным и репелленты сигналы с ориентиром глиальных клеток и так называемые «первопроходца» аксоны предлагается достичь правильной цели, расширяя вдоль заранее узорной глиальных помостами35,,3839. Таким образом, глиальные клетки необходимы для руководства первопроходца аксонов, которые впоследствии служат как на основе аксон «живые леса» в прямой проекции «последователь» аксоны. Кроме того, механизмы роста глии опосредованной было показано постнатально, сохраняются как нейробласты следовать ростральной миграционных потока (RMS) для перехода из субвентрикулярной зоны (SVZ), один из немногих оставшихся областей нейрогенез взрослого мозга, обонятельные луковицы (OB)40. Эти нейробласты в RMS мигрируют в глиальных трубки (рис. 1а-1), который состоит из продольно в соответствие Астроцитарная процессов, через прямой ячеек спаек и локализованные растворимых факторов37, 41. Наконец, хотя повреждения ЦНС в млекопитающих причин нарушается механизм Астроцитарная процесса формирования глиальных шрам, который физически препятствует аксональное регенерации17, многие системы не млекопитающих не хватает формирования глиальных наносит шрам. Скорее глиальные клетки не млекопитающих видов поддерживать более организованной, соответствие шаблонов, которые используются в качестве руководства через пострадавшего региона17,42,43. Например в моделях SCI не млекопитающих, аксоны показываются расти в тесном сотрудничестве с глиальных мосты, пересекая поражения, предлагая важную роль для организованных глиальных леса как субстратов, содействия аксональное регенерации и восстановления функций ( Рисунок 1A -2) 42 , 44 , 45. перепросмотре нейроанатомический функций и развития/восстановительных механизмов, описанных выше может принести новый класс инженерии глиальных основе жизни леса, которые могут одновременно управлять незрелых нейронной миграции и аксональной Поиск пути через иначе либеральной среды, тем самым потенциально смягчения последствий нейронов и аксон тракта дегенерации, связанные с ЦНС травмы и болезни.
Наша исследовательская группа ранее разработала несколько типов живых подмости для восстановления и регенерации аксональное участки в ЦНС и периферической нервной системы (ПНС) через микро ткани спроектирован нейронных сетей (микро TENNs) и ткани графтов инженерии нерва (TENGs), соответственно27,46,47,48. Обе стратегии по существу основаны на biomimicry. Микро-TENNs являются анатомически вдохновил сооружения, предназначенные для структурно и функционально заменить аксональное участки, подключение различных нейрональных популяций головного мозга. TENGs использовать механизму развития аксон способствовали аксональное регенерации, подтверждается «последователь» аксон роста вдоль аксоны «Пионер», для достижения целевой хост аксональное регенерации35,46,48. Мы недавно капитализируются на универсальность живых эшафот техника с использованием аналогичной схемы оболочки как микро TENNs и ищет вдохновение от механизмов на основе глии представить на протяжении развития. Здесь мы разработали конструкции, состоящей из унифицированных Астроцитарная связки, охватывающих коллагеновых люмен гидрогеля микро колонки49. Эти леса Астроцитарная жизни, разработанные Первое заполнение сборку капиллярной трубки иглоукалывание иглы с жидким агарозы для создания полые цилиндрические гидрогеля с внешнего диаметра (OD) и внутренний диаметр (ID) соответствующих диаметров трубки и иглы, соответственно. После геля агарозы и извлечение микро столбце гидрогеля с капиллярной трубки, полые интерьер является покрытием с типом коллаген предоставлять среде разрешительных для экзоцитоз адгезии и соответствие комплекта формирования (рис. 1B -1). После этого просвет заполняется с мозговой коры астроциты, изолированы от послеродового крыса щенков (Рисунок 1B-2). Вопреки двухмерный (2D) выравнивания методы, которые полагаются на применение электрических полей, micropatterned канавки и внеклеточного матрикса (ECM) белка кучность, экзоцитоз выравнивания в жизни леса способ полагается на самостоятельной сборки по данным контролируемых переменных, таких как субстрат кривизны (столбец ID), плотность ячеек и коллаген концентрации50,51,52. Астроциты контракт и перестроить коллагена и приобрести биполярный, продольно соответствие морфологии, аналог природных лесов, наблюдается в vivo (рис. 1B-3). Действительно мы активно осуществляем использование этих кабель подобных структур как физические субстратов для целенаправленного руководства миграции незрелых нейронах, а также содействия аксональное регенерации в неблагоприятной окружающей среде повреждения ЦНС, особенно млекопитающих глиальный рубец (рис. 1 c). Эта статья представит подробные изготовления для Астроцитарная микро колонки, фаза контраст и иммунофлюоресценции изображения ожидаемого cytoarchitecture и всеобъемлющее обсуждение текущих ограничений и будущие направления деятельности техника.
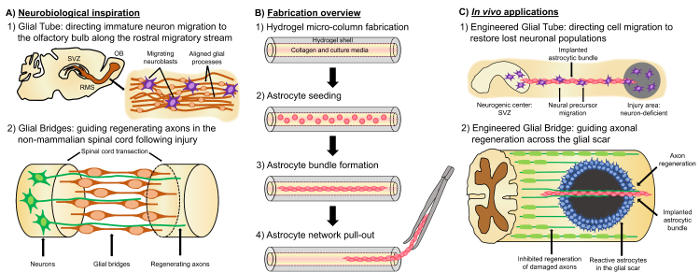
Рисунок 1: вдохновение, изготовление протокол и предлагаемых приложений для выровненного Астроцитарная сетей. (A) нейробиологических вдохновение: (1) нейробласты возникая от нейрогенный субвентрикулярной зоны (SVZ) использовать продольно унифицированных глиальных трубки в ростральной миграционных потока (RMS) для направленного миграции к обонятельной луковицы (OB); (2) Non млекопитающих, таких как амфибий и рыб могут поддерживать регенерации после нервной ткани ущерб отчасти за счет формирования глиальных мост, который соединяет заканчивается поражением (например пересекал спинного мозга) и служит леску для руководства регенерирующее аксоны. (B) Обзор изготовления: (1) строительство микро столбца микронного размера, полые гидрогеля с люмен, покрытые ECM, (2) заполнение первичной коры астроциты, изолированы от послеродового крыса детенышей, (3) самосборки продольно ориентированных связки в культуре и (4) добыча комплект из оболочки биоматериала для исследования будущей имплантации. (C) в естественных условиях применения: (1) эти живые леса могут служить инженерии глиальных трубы для направленного нейрон миграции из нейрогенный центров, чтобы населить нейрон недостаточным регионов; (2) резюме развития механизма новаторской руководство аксона и регенеративной механизм глиальных мостов в не млекопитающих может наделить эти Астроцитарная леса с способностью прямой регенерации аксона через не разрешительной окружающей среды млекопитающих глиальный рубец. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
По сравнению с более благоприятной среды ПНС, ЦНС в обработке негативные последствия нейротравма и нейродегенеративные особенно ограничено. После серьезным оскорблением млекопитающих ЦНС глиальный рубец образуется, состоящий из основного фиброзных и воспалительных клеток, окруженн…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Финансовая поддержка была оказана национальных институтов здравоохранения [U01-NS094340 (Каллен) & F31-NS090746 (Katiyar)], Майкл Джей Фокс фонд [Лечебный конвейер программа #9998 (Каллен)], Пенн медицины нейробиологии центра пилот Award (Каллен), Национальный научный фонд [выпускник исследовательских стипендий DGE-1321851 (Struzyna)], Департамент по делам ветеранов [ОР & D заслуги обзор #B1097-я (Каллен)] и США армия медицинских исследований и техники команда [#W81XWH-13-207004 (Каллен) & W81XWH-15-1-0466 (Каллен)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
References
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

