Ingeniería tisular tridimensional alineado astrositos redes para recapitular los mecanismos del desarrollo y facilitar la regeneración del sistema nervioso
Summary
Nos muestra el desarrollo de los paquetes uno mismo-montado, tridimensionales de somata astrocytic longitudinalmente alineado y procesos dentro de un protector nuevo biomaterial. Estos diseñados “andamios de vida”, que diámetro de la escala del micrón pero extiende centímetros de longitud, puede servir como bancos de pruebas para estudiar los mecanismos del desarrollo neurológico o facilitar la Neurorregeneración por dirige la migración neuronal y axonal pathfinding.
Abstract
Neurotrauma y neurodegenerative de la enfermedad a menudo resultan en duradero déficit neurológico debido a la limitada capacidad del sistema nervioso central (SNC) para reemplazar las neuronas perdidas y regenerar caminos axonales. Sin embargo, durante el desarrollo del sistema nervioso, la migración neuronal y la extensión axonal ocurren a menudo por caminos formados por otras células, conocido como “andamios de vida”. Buscando emular estos mecanismos y diseñar una estrategia que evita el entorno inhibidor del SNC, este manuscrito presenta un protocolo para fabricar ingeniería tisular basada en astrositos “andamios de vida”. Para crear estas construcciones, se empleó un esquema protector de nuevo biomaterial inducir astrocitos uno mismo-montar en densos paquetes tridimensionales de somata bipolar alineados longitudinalmente y procesos. Hidrogel en primer lugar, hueco micro-columnas estaban reunidos, y la luz interior estaba recubierta con matriz extracelular colágeno. Astrocitos corticales cerebrales disociados luego fueron entregados en el lumen de la micro-columna cilíndrica y un diámetro interior crítico de < 350 μm, espontáneamente auto alineado y contratado para producir largas de fibra como cables consisten en paquetes densos de los procesos de astrositos y fibrillas de colágeno de medición 97% viabilidad celular y eran casi exclusivamente compuesta por astrocitos expresan una combinación del filamento intermedio proteínas glial fibrilar proteína ácida (GFAP), vimentina y nestin. Estos alinean astrositos redes fueron encontradas para proporcionar un substrato permisivo para conexión neuronal y alineación la extensión del neurite. Por otra parte, estas construcciones mantienen integridad y alineación cuando extrae del protector de hidrogel, haciéndolas adecuadas para la implantación de la CNS. Estas construcciones preformadas estructuralmente emulan citoarquitectónica clave elementos de origen natural basada en glial “andamios de vida” en vivo. Como tal, estos andamios de ingeniería de la vida pueden servir como bancos de pruebas para estudiar los mecanismos del desarrollo neurológico en vitro o facilitar la Neurorregeneración dirigiendo la migración neuronal y axonal pathfinding tras degeneración CNS en vivo .
Introduction
Sistema nervioso central (SNC) tiene una capacidad limitada para contrarrestar la pérdida o disfunción de las neuronas y vías axonales que acompañan las condiciones tales como lesión cerebral traumática (TBI), movimiento, médula espinal lesión (SCI) y neurodegenerative enfermedad1 ,2,3,4,5. Neurogénesis en el SNC se limita a un número limitado de áreas en el cerebro, dificultando la restauración de las neuronas perdidas6,7. Además, la regeneración de caminos perdidas axonales en el SNC es insuficiente debido a la falta de orientación dirigida, la presencia de inhibidores de la consecuencia y astrogliosis reactiva después de daño al tejido neural2,8, 9,10. Los astrocitos tienen diversas funciones para ayudar a las neuronas con la homeostasis de iones, separación de neurotransmisores, formación de sinapsis y neurovasculares acoplamiento11. Sin embargo, siguiendo incluso leves daños de tejido neural, astrocytes pueden sufrir cambios moleculares, estructurales y funcionales en su transición a un estado hipertrófico11. En respuesta al neurotrauma grave, estos cambios resultan en la formación de una cicatriz con una penumbra que contienen astrocitos reactivos migrando y un núcleo de la lesión que incluye leucocitos se filtró desde el rota barrera blood – brain (BBB), microglia, oligodendrocitos y fibroblastos11,12,13. Estos astrocitos reactivos logran una morfología de procesos filamentosos, desorganizados y presentan aumento de la expresión de proteínas de filamentos intermediarios y proteoglicanos de sulfato del chondroitin (CSPGs), que impiden la regeneración de los nervios12. A pesar de la cicatriz glial inicialmente ayuda a restaurar la integridad de la BBB y evitar la transmisión de la respuesta inflamatoria al tejido sano circundante, sirve como una barrera física y bioquímica contra axon regeneración12,14 ,15,16. Por ejemplo, axones que encuentran la cicatriz glial mostrar los conos de crecimiento distrófico con bulbo y retraso de crecimiento12. Además, la desorganización de los procesos astrocytic después de la lesión impide la extensión de regenerar axones17. El resultado de estas características inhibitorias se manifiesta en las debilitaciones físicas y neurológicas a menudo permanente que los pacientes sufren después de neurotrauma grave, incluyendo TBI y la médula espinal.
Independientemente de los retos extrínsecos de regeneración funcional en el SNC, axones han demostrado poseer una capacidad intrínseca de regeneración. Por ejemplo, la naturaleza dinámica de los conos de crecimiento distrófico en contacto con la cicatriz glial sugiere que estas terminaciones conservan su capacidad para ampliar a12. En consecuencia, se cree que un obstáculo principal para el crecimiento axonal es el entorno inhibidor del SNC después de la lesión y proporciona un ambiente más permisivo a través de reducción de la cicatrización glial o proporcionar puentes regenerativas a través de la cicatriz sería ventajoso. De hecho, estudios anteriores han demostrado que las neuronas de la CNS fueron capaces de extender axones a través de una lesión mediante injertos de nervios periféricos como puentes, que presentan un entorno más favorable para la regeneración de axón12,18, 19. Varias otras estrategias han sido llevadas a cabo para explotar esta capacidad regenerativa vestigial. Por ejemplo, manipulación de vías de señalización de crecimiento celular en varios modelos de lesión ha dado lugar a la regeneración axonal y disminución de cicatriz glial10,20,21. Además, los estudios han demostrado que el tratamiento con Condroitinasa ABC, que hiende la mayoría de las cadenas de azúcar en CSPGs, disminuye el efecto inhibitorio de CSPGs segregada por los astrocitos reactivos22. A pesar de alentador resultados, estos métodos no proporcionan dirigida orientación de conos de crecimiento, que potencialmente puede resultar en la regeneración aberrante12y también no tienen en cuenta para la pérdida de neuronas. Enfoques basados en la célula se han utilizado en tentativas de superar los efectos de la cicatriz glial y para reponer las células perdidas, particularmente de las neuronas. Algunos grupos han dedifferentiated astrocitos reactivos en las neuronas, mientras que otros han trasplantado células progenitoras neurales en lesiones CNS para repoblar la zona de lesión y promover axon regeneración23,24, 25. sin embargo, la célula de vástago trasplante solo está limitado por las tasas de supervivencia bajas, pobre integración y retención modesta en el tejido dañado5. Además, estas estrategias basadas en células incapaces de restaurar zonas interurbana axonal, especialmente en forma controlada. Por lo tanto, biomateriales en combinación con otros enfoques se están estudiando como vectores para varios nervios y factores de crecimiento y células progenitoras26. Enfoques basados en el biomaterial cuentan con un alto grado de control del diseño para producir construcciones que imitan a la haptotaxic física, específica, y chemotaxic señales presentan en el microambiente (3D) tridimensional del destino anfitrión tejido27, 28,29,30,31,32,33,34. Reproducción de estas señales ambientales es de suma importancia para las células trasplantadas presentar nativo-como morfología, proliferación, migración y señalización, entre otras características neurobiológicas29. A pesar de estas propiedades ventajosas, avance más allá de la tradicional células sembradas biomaterial andamios es necesario simultáneamente promover la regeneración axonal larga distancia dirigida y reemplazar las neuronas perdidas.
Un prometedor enfoque alternativo se basa en el tejido neural ingeniería “andamios de vida”, que son distintos de otros enfoques basados en la célula debido a la presencia de células neuronales vivas con una Citoarquitectura preformado que emula neuroanatomía nativa o desarrollo mecanismos que faciliten la sustitución específica, reconstrucción y regeneración de los circuitos neuronales4,35. Consideraciones para el diseño de matrices de soporte de vida incluyen los fenotipos y las fuentes de las células neuronales, así como las propiedades físico mecánicas y las señales bioquímicas dictaron por la composición de cualquier adjunto de biomateriales35. Después de la fabricación en vitro, estos andamios de vida pueden ser implantados en vivo quimiotácticos y moléculas de adhesión celular presentes y neurotróficos señales para regular activamente migración de células neuronales y consecuencia del axón dependiendo del estado y progresión de procesos regenerativos35. Las células gliales pueden servir como base para la ingeniería Citoarquitectura de andamios de la vida ya que estas células median varios mecanismos del desarrollo en vivo. Durante el desarrollo del cerebro, las neuronas nuevas dependen de procesos basals extendidos por glia radial desde la zona ventricular hacia la placa cortical en vías de desarrollo como andamios de vida migración dirigida36,37. Además, extender crecimiento conos son muestra a orientarse detectando señales atractivas y repulsivo provocadas por las células gliales hito y supuesto “pioneras” axones son sugeridas para alcanzar los objetivos correctos por que se extiende a lo largo de los estampados glial Andamios de38,35,39. Así, las células gliales son necesarias para la dirección del pionero axons, que luego sirven como base de axon “andamios de vida” para dirigir la proyección de axones “seguidor”. Por otra parte, mecanismos de crecimiento mediada por la glía han demostrado persistencia postnatal, como neuroblastos siguen la corriente migratoria rostral (RMS) para poder navegar desde la zona subventricular (SVZ), una de las pocas áreas restantes de la neurogénesis en el cerebro adulto, la bulbo olfatorio (OB)40. Estos neuroblastos en el RMS migran dentro del tubo de glial (figura 1A-1), que se compone de procesos astrocytic alineadas longitudinalmente, mediante adhesiones célula-célula directa y localizada de factores solubles37, 41. por último, mientras que el daño del CNS en causas de mamíferos interrumpió arreglo astrocytic proceso formando una cicatriz glial que físicamente impide la regeneración axonal17, muchos sistemas no mamíferos carecen de la formación de una cicatriz glial perjudicial. Más bien, las células gliales de las especies de animales no mamíferos mantienen más organizado, alineados los patrones que se utilizan como guías a través de la región lesionada17,42,43. Por ejemplo, en modelos de animales no mamíferos SCI, se muestran axones que crecen en estrecha asociación con puentes gliales cruzar la lesión, lo que sugiere un papel importante para andamios gliales organizados como sustratos facilitando la regeneración axonal y recuperación funcional ( Figura 1A -2) 42 , 44 , 45. recapitulación de las características neuroanatómicas y los mecanismos del desarrollo/regenerativa descritos anteriormente puede producir una nueva clase de andamios de ingeniería vida glial base que puede conducir al mismo tiempo la migración neuronal inmadura y axonal pathfinding a través de entornos no permisiva, de tal modo potencialmente mitigar los efectos de neuronal y degeneración de la zona de axón asociado a enfermedad y lesión del CNS.
Nuestro grupo de investigación previamente ha diseñado varios tipos de matrices de soporte de vida para la reconstrucción y regeneración del tracto axonal en el SNC y sistema nervioso periférico (SNP) a través de micro-tejido ingeniería de redes neuronales (micro-adolescentes) y tejido Ingeniería injertos del nervio (TENGs), respectivamente27,46,47,48. Ambas estrategias están basados inherentemente en biomimética. Micro-adolescentes son estructuras anatómicamente inspiración estructural y funcionalmente sustituye extensiones axonales conectar distintas poblaciones neuronales del cerebro. TENGs explotan el mecanismo del desarrollo de la regeneración axonal facilitado por axon, ejemplificado por el crecimiento del axon de “seguidor” a lo largo de axones de “pionero”, para lograr la regeneración axonal de host destino35,46,48. Nos recientemente aprovechó la versatilidad de la matriz de soporte de vida técnica mediante un esquema similar de protector como micro-adolescentes y buscando inspiración en los mecanismos basados en la glia presentes en todo el desarrollo. Aquí, hemos desarrollado construcciones consisten en paquetes astrocytic alineados que atraviesan el lumen colagenoso de una micro columna de hidrogel49. Estos andamios vida astrocíticos son desarrollados por el primer llenado de un conjunto de agujas de acupuntura de tubo capilar con agarosa líquida para crear un hidrogel cilíndrico hueco con un diámetro exterior (OD) y diámetro interno (ID) correspondiente a los diámetros de la tubo y aguja, respectivamente. Gelificación de agarosa y extracción de la hidrogel micro-columna de tubo capilar, el hueco interior es revestido con tipo y colágeno para suministrar un entorno permisivo para la adherencia de astrositos y alineado paquete formación (figura 1B -1). Luego, la luz es sembrada con astrocitos corticales cerebrales aislados de crías de rata postnatal (figura 1B-2). Contrariamente a las técnicas bidimensionales (2D) alineación que se basan en la aplicación de campos eléctricos, micropatterned surcos y matriz extracelular proteína (ECM) patrones, alineación de astrositos en el andamio de la vida técnica depende de uno mismo-Asamblea de acuerdo a las variables controlables como curvatura de sustrato (columna ID), la densidad celular y la concentración de colágeno50,51,52. Los astrocitos contratan y remodelan el colágeno y adquieran una morfología bipolar, alineados longitudinalmente análoga a las matrices de soporte naturales en vivo (figura 1B-3). De hecho, estamos persiguiendo activamente el uso de estas estructuras de cable como sustratos físicos específicos guía de migración de las neuronas inmaduras, así como facilitar la regeneración axonal a través del ambiente desfavorable del SNC dañado, particularmente la cicatriz glial mamífera (figura 1). Este artículo se presenta el método de fabricación detallado para las columnas de micro astrocytic, fase imágenes de contraste, inmunofluorescencia y de la Citoarquitectura esperado y una amplia discusión sobre las limitaciones actuales y direcciones futuras de la técnica.
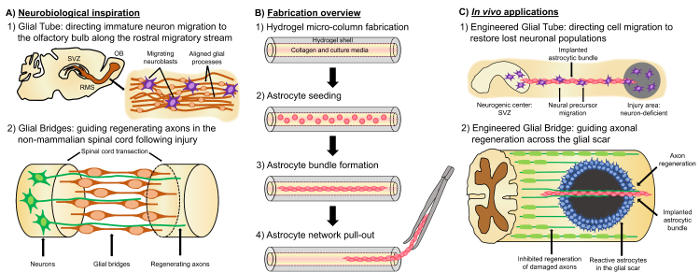
Figura 1: inspiración, protocolo de fabricación y aplicaciones propuestos para las redes Astrocytic alineadas. (A) inspiración neurobiológica: neuroblastos (1) origina la neurogénica zona subventricular (SVZ) utilizan el tubo glial longitudinalmente alineado en la corriente migratoria rostral (RMS) para la migración dirigida hacia el bulbo olfatorio (OB); (2) no de mamíferos como peces y anfibios pueden sostener la regeneración después de tejido neural dañar en parte debido a la formación de un puente glial que conecta los extremos de una lesión (por ejemplo médula espinal transected) y sirve como un andamio para la dirección de regeneración de axones. (B) Resumen de fabricación: (1) construcción de una micro columna hidrogel de tamaño micrométrico, hueco con recubierta de ECM, la luz de la (2) siembra de astrocitos corticales primarios aislados de crías de rata postnatal, (3) uno mismo-Asamblea de longitudinalmente orientados paquetes en la cultura y (4) extracción del paquete del encasement del biomaterial para estudios de implantación futura. (C) In vivo usos: (1) estos andamios de vida pueden servir como tubos gliales ingeniería para la migración de la neurona dirigida de centros neurogénicas a repoblar las regiones deficientes en neurona; (2) Resumen del mecanismo del desarrollo de pioneras orientación axón y el mecanismo regenerativo de puentes gliales en los mamíferos no puede dotar a estos andamios astrocytic con capacidad de dirigir la regeneración del axón a través de la no-permisivo medio ambiente de la cicatriz glial mamífera. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
En comparación con el entorno más propicio del PNS, el SNC se ve particularmente limitado en el manejo de las consecuencias perjudiciales de neurotrauma y neurodegeneración. Después de un grave insulto al SNC mamífero, se forma una cicatriz glial, consistente en un núcleo de células inflamatorias y fibróticas rodeado por una densa red de astrocitos reactivos desorganizados que secretan axón inhibidor consecuencia proteoglicanos14. Esta cicatriz actúa como una obstrucción física y bioqu…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Apoyo financiero fue provisto por los institutos nacionales de salud [U01-NS094340 (Cullen) y F31-NS090746 (Katiyar)], Michael J. Fox Foundation [9998 de # terapéutica de la programa de tubería (Cullen)], Penn medicina Neurociencias centro piloto Premio (Cullen), Fundación Nacional de ciencia [investigación becas DGE-1321851 (Struzyna)], Departamento de Veterans Affairs [RR & D mérito revisión #B1097-I (Cullen)] y la investigación médica del ejército de Estados Unidos y comando del material [#W81XWH-13-207004 (Cullen) y W81XWH-15-1-0466 (Cullen)].
Materials
| Acupuncture needle (300 µm diameter) | Lhasa Medical | HS.30×40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Microliter glass capillary tube (701 µm) | Fisher | 21-170J | The diameter may be varied according to the desired size for the micro-column shell. |
| Microcap bulb dispenser | Fisher | 21-170J | Bulb comes with the microcap tubes. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | |
| Micro-spatula | Fisher | S50821 | |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (Dnase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| Dulbecco's Modified Eagle Medium (DMEM) with Ham's F-12 Nutrient Mixture | Gibco | 11330-032 | Store at 4 ºC. |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11195 | Store at -20ºC. |
| Postnatal day 0 or day 1 Sprague Dawley rat pups | Charles River | Strain 001 | |
| Neurobasal embryonic neuron basal medium | Invitrogen | 21103049 | Store at 4ºC and warm at 37 ºC before use. |
| B-27 serum free supplement | Invitrogen | 12587010 | Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| G5 astrocytic supplement | Invitrogen | 17503012 | |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Incubator | Fisher | 13 998 076 | |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Glass cover slip | Fisher | 12-548-5M | |
| Nail polish | Electron Microscopy Sciences (EMS) | 72180 | |
| Fluoromont mounting medium | Southern Biotech | 0100-01 | |
| Poly-L-lysine | Sigma | P4707 | |
| Phosphate buffered saline | Fisher | BP3994 | |
| Triton X-100 | Sigma | T8787 | |
| Normal horse serum | Gibco | 16050-122 | |
| Rabbit anti-glial acidic fibrillary protein (GFAP) primary antibody | Millipore | AB5804 | Store at -20ºC. |
| Mouse anti-beta-tubulin III primary antibody | Sigma | T8578 | Store at -20ºC. |
| Rabbit anti-collagen I primary antibody | Abcam | ab34710 | Store at -20ºC. |
| Rabbit anti-vimentin | Millipore | AB3400 | Store at -20ºC. |
| Mouse anti-nestin | Millipore | AB5326 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 568 secondary antibody | Invitrogen | A10042 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| Calcein AM | Sigma | C1359 | 4 mM in anhydrous DMSO |
| Ethidium homodimer-1 | Life Technologies | E1169 | 2 mM in DMSO/H2O 1:4 (v/v) |
| Dimethyl sulfoxane (DMSO) | Sigma | 276855 | |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
References
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Huebner, E. A., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Kyungsuk, K., Liu, K., et al. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN / mTOR Pathway. Science. 322 (5903), 963-966 (2008).
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nat. Neurosci. 18 (7), 942-952 (2015).
- Cregg, J. M., DePaul, M. A., Filous, A. R., Lang, B. T., Tran, A., Silver, J. Functional regeneration beyond the glial scar. Exp. Neurol. 253, 197-207 (2014).
- Buffo, A., Rolando, C., Ceruti, S. Astrocytes in the damaged brain: Molecular and cellular insights into their reactive response and healing potential. Biochem. Pharmacol. 79 (2), 77-89 (2010).
- Silver, J., Miller, J. H. Regeneration beyond the glial scar. Nat. Rev. Neurosci. 5 (2), 146-156 (2004).
- Toy, D., Namgung, U. Role of Glial Cells in Axonal Regeneration. Exp. Neurobiol. 22 (2), 68-76 (2013).
- Sofroniew, M. V. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. 32 (12), 638-647 (2009).
- East, E., de Oliveira, D. B., Golding, J. P., Phillips, J. B. Alignment of astrocytes increases neuronal growth in three-dimensional collagen gels and is maintained following plastic compression to form a spinal cord repair conduit. Tissue Eng. Part A. 16 (10), 3173-3184 (2010).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System "Bridges" after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- Fry, E. J., Chagnon, M. J., López-Vales, R., Tremblay, M. L., David, S. Corticospinal tract regeneration after spinal cord injury in receptor protein tyrosine phosphatase sigma deficient mice. Glia. 58 (4), 423-433 (2010).
- Lin, B., Xu, Y., Zhang, B., He, Y., Yan, Y., He, M. -. C. MEK inhibition reduces glial scar formation and promotes the recovery of sensorimotor function in rats following spinal cord injury. Exp. Ther. Med. 7 (1), 66-72 (2014).
- Bradbury, E. J., Carter, L. M. Manipulating the glial scar: Chondroitinase ABC as a therapy for spinal cord injury. Brain Res. Bull. 84 (4-5), 306-316 (2011).
- Vadivelu, S., Stewart, T. J., et al. NG2+ Progenitors Derived From Embryonic Stem Cells Penetrate Glial Scar and Promote Axonal Outgrowth Into White Matter After Spinal Cord Injury. Stem Cells Transl. Med. 4, 401-411 (2015).
- Nishimura, Y., Natsume, A., et al. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant. 22 (12), 2187-2201 (2013).
- Guo, Z., Zhang, L., Wu, Z., Chen, Y., Wang, F., Chen, G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer’s disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Cullen, D. K., Wolf, J. A., Vernekar, V., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain tissue. Nat. Protoc. 10 (9), 1362-1373 (2015).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Stiles, J., Jernigan, T. L. The basics of brain development. Neuropsychol. Rev. 20 (4), 327-348 (2010).
- Kaneko, N., Marín, O., et al. New neurons clear the path of astrocytic processes for their rapid migration in the adult brain. Neuron. 67 (2), 213-223 (2010).
- Hidalgo, A., Booth, G. E. Glia dictate pioneer axon trajectories in the Drosophila embryonic CNS. Development. 127 (2), 393-402 (2000).
- Chotard, C., Salecker, I. Neurons and glia: Team players in axon guidance. Trends Neurosci. 27 (11), 655-661 (2004).
- Wang, C., Liu, F., et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res. 21 (11), 1534-1550 (2011).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487 (4), 407-427 (2005).
- Zukor, K. A., Kent, D. T., Odelberg, S. J. Meningeal cells and glia establish a permissive environment for axon regeneration after spinal cord injury in newts. Neural Dev. 6, (2011).
- Reier, P. J. Penetration of grafted astrocytic scars by regenerating optic nerve axons in xenopus tadpoles. Brain Res. 164 (1-2), 61-68 (1979).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Goldshmit, Y., Sztal, T. E., Jusuf, P. R., Hall, T. E., Nguyen-Chi, M., Currie, P. D. Fgf-Dependent Glial Cell Bridges Facilitate Spinal Cord Regeneration in Zebrafish. J. Neurosci. 32 (22), 7477-7492 (2012).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Alexander, J. K., Fuss, B., Colello, R. J. Electric field-induced astrocyte alignment directs neurite outgrowth. Neuron Glia Biol. 2 (2), 93-103 (2006).
- Hsiao, T. W., Tresco, P. A., Hlady, V. Astrocytes alignment and reactivity on collagen hydrogels patterned with ECM proteins. Biomaterials. 39, 124-130 (2015).
- Alekseeva, T., Katechia, K., Robertson, M., Riehle, M. O., Barnett, S. C. Long-term neurite orientation on astrocyte monolayers aligned by microtopography. Biomaterials. 28 (36), 5498-5508 (2007).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Conway, A., Schaffer, D. V. Biomaterial microenvironments to support the generation of new neurons in the adult brain. Stem Cells. 32 (510), 1220-1229 (2014).
- Barry, D., McDermott, H. Differentiation of radial glia from radial precursor cells and transformation into astrocytes in the developing rat spinal cord. Glia. 50 (3), 187-197 (2005).
- Pertusa, M., Garcia-Matas, S., Rodriguez-Farre, E., Sanfeliu, C., Cristofol, R. Astrocytes aged in vitro show a decreased neuroprotective capacity. J. Neurochem. 101 (3), 794-805 (2007).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Balgude, A. P., Yu, X., Szymanski, A., Bellamkonda, R. V. Agarose gel stiffness determines rate of DRG neurite extension in 3D cultures. Biomaterials. 22 (10), 1077-1084 (2001).
- Smeal, R. M., Tresco, P. A. The influence of substrate curvature on neurite outgrowth is cell type dependent. Exp. Neurol. 213 (2), 281-292 (2008).
- Smeal, R. M., Rabbitt, R., Biran, R., Tresco, P. A. Substrate curvature influences the direction of nerve outgrowth. Ann. Biomed. Eng. 33 (3), 376-382 (2005).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Katiyar, K. S., Winter, C. C., Struzyna, L. A., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regen. Med. , (2016).
- McCarthy, K. D., De Vellis, J. Preparation of Separate Astroglial and Oligodendroglial Cell Cultures from Rat Cerebral Tissue. J. Cell Biol. 85, 890-902 (1980).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Kim, S. U., Stern, J., Kim, M. W., Pleasure, D. E. Culture of purified rat astrocytes in serum-free medium supplemented with mitogen. Brain Res. 274 (1), 79-86 (1983).
- Morrison, R. S., de Vellis, J. Growth of purified astrocytes in a chemically defined medium. Proc. Natl. Acad. Sci. U. S. A. 78 (11), 7205-7209 (1981).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Dev. Biol. 90 (2), 383-398 (1982).
- Hsiao, T. W., Swarup, V. M., Kuberan, B., Tresco, P. A., Hlady, V. Astrocytes specifically remove surface-adsorbed fibrinogen and locally express chondroitin sulfate proteoglycans. Acta Biomater. 9 (7), 7200-7208 (2013).
- Phillips, J. B., Bunting, S. C. J., Hall, S. M., Brown, R. A. Neural tissue engineering: a self-organizing collagen guidance conduit. Tissue Eng. 11 (9), 1611-1617 (2005).
- Cullen, D. K., Simon, C. M., LaPlaca, M. C. Strain rate-dependent induction of reactive astrogliosis and cell death in three-dimensional neuronal-astrocytic co-cultures. Brain Res. 1158, 103-115 (2007).
- Filous, A. R., Miller, J. H., Coulson-Thomas, Y. M., Horn, K. P., Alilain, W. J., Silver, J. Immature astrocytes promote CNS axonal regeneration when combined with chondroitinase ABC. Dev. Neurobiol. 70 (12), 826-841 (2010).
- Johansson, S., Strömberg, I. Guidance of dopaminergic neuritic growth by immature astrocytes in organotypic cultures of rat fetal ventral mesencephalon. J. Comp. Neurol. 443 (3), 237-249 (2002).
- Jiang, Z., Han, Y., Cao, X. Induced pluripotent stem cell (iPSCs) and their application in immunotherapy. Cell. Mol. Immunol. 11 (1), 17-24 (2014).
- Wang, L., Cao, J., et al. Immunogenicity and functional evaluation of iPSC-derived organs for transplantation. Cell Discov. 1, (2015).
- Wolmer-Solberg, N., Cederarv, M., Falci, S., Odeberg, J. Human neural stem cells and astrocytes, but not neurons, suppress an allogeneic lymphocyte response. Stem Cell Res. 2 (1), 56-67 (2009).

