Система гидропонной совместной культивации для одновременного и систематического анализа молекулярных взаимодействий растений и микробов и сигнализации
Summary
Описанная гидропонная система кокультивации поддерживает интактные растения с металлическими сетчатыми экранами и кокультивирует их бактериями. Растительные ткани, бактерии и секретируемые молекулы затем могут быть отдельно собраны для последующих анализов, одновременно позволяя исследовать молекулярные реакции как хозяев растений, так и взаимодействующих микробов или микробиомов.
Abstract
Экспериментальная разработка, имитирующая естественные взаимодействия с растениями-микробами, очень важна для определения сложных процессов передачи сигналов микроорганизмов растений. Arabidopsis thaliana – Agrobacterium tumefaciens Обеспечивает отличную модельную систему для изучения бактериального патогенеза и взаимодействия растений. Предыдущие исследования взаимодействия растений -Агробактерий в значительной степени опирались на культуры суспензий растительных клеток, искусственное ранение растений или искусственную индукцию микробных факторов вирулентности или защиту растений синтетическими химическими веществами. Однако эти методы отличаются от естественной сигнализации в planta , где растения и микробы распознают и реагируют в пространственных и временных манерах. В этой работе представлена гидропонная система кокультивации, в которой интактные растения поддерживаются сетками из металлической сетки и кокультивируются Agrobacterium . В этой системе кокультивации нет синтетического фитогормона или химического вещества, которое индуцирует micrБожественная вирулентность или защита растений дополняются. Гидропонная система кокультивации очень похожа на естественные взаимодействия растений и микробов и сигнализирует гомеостаз в пласте . Корни растений можно отделить от среды, содержащей Agrobacterium , и сигналы и реакции как хозяев растений, так и взаимодействующих микробов можно исследовать одновременно и систематически. В любой момент времени / интервал растительные ткани или бактерии могут собираться отдельно для различных анализов «омикшей», демонстрируя силу и эффективность этой системы. Гидропонная система кокультивации может быть легко адаптирована для изучения: 1) обратная сигнализация различных систем растений-микробов, 2) сигнализация между хозяином растения и несколькими видами микроорганизмов ( т.е. микробными консорциумами или микробиомами), 3) как связаны питательные вещества и химические вещества В сигнале растений-микробов и 4) как микробы взаимодействуют с хозяевами растений и способствуют устойчивости растений к биотическому oR абиотические стрессы.
Introduction
Микроорганизмы, связанные с растениями, играют важную роль в биогеохимическом циклировании, биоремедиации, смягчении последствий изменения климата, роста растений и здоровья и устойчивости растений к биотическим и абиотическим стрессам. Микроорганизмы взаимодействуют с растениями как непосредственно через контакт стенки стенки растения, так и косвенно через химическую секрецию и сигнализацию 1 , 2 , 3 . В качестве сидячих организмов растения разработали прямые и косвенные механизмы противодействия инфекции патогенами. Прямые защитные средства включают структурную защиту и экспрессию защитных белков, тогда как косвенная защита включает в себя вторичное производство метаболитов растений и привлечение организмов, антагонистических к вторгающимся патогенам 4 , 5 . Вырожденные корневым экссудатом, выделениями, слизи, мусигелем и лизатами изменяют физико-химические свойства ризосферы для привлечения или отталкиванияМикробов к их хозяевам 6 . Химический состав секреции корней является видоспецифичным, тем самым выступая в качестве селективного фильтра, который позволяет некоторым микроорганизмам, способным распознавать такие соединения, процветать в ризосфере 6 . Таким образом, совместимые микробные виды могут стимулироваться для активации и усиления их ассоциаций либо в пользу, либо в ущерб хозяину растения 1 .
Понимание взаимодействия растений и микробов в ризосфере является ключевым фактором повышения производительности растений и функционирования экосистем, поскольку большинство микробных и химических воздействий происходит в корневой структуре и почвенно-воздушном интерфейсе 2 , 6 , 7 , 8 . Тем не менее, изучение взаимодействия подземных растений и микробов и ответных реакций было проблемой из-за его интригующей Сложный и динамичный характер и отсутствие подходящих экспериментальных моделей с естественной структурой корней и морфологией растений в условиях жестко контролируемого роста. В качестве одного из наиболее интенсивно изучали фитопатогенов, Agrobacterium заражает широкий ассортимент растений с сельскохозяйственной и садоводческой значение, в том числе вишни, яблони, груши, виноград и розы 9. Agrobacterium – важный модельный организм для понимания взаимодействия растений с патогенами и является мощным инструментом в трансформации растений и инженерии растений 10 , 11 , 12 , 13 , 14 .
Молекулярное растение-взаимодействие Agrobacterium хорошо изучено в течение нескольких десятилетий, а современное понимание патогенности Agrobacterium обширно 9 ,F "> 11 , 15 , 16. Патогенность Agrobacterium в значительной степени объясняется его развитыми возможностями восприятия сигналов, полученных из растений, что приводит к тонкой модуляции его программы вирулентности и связи между клетками, так называемому восприятию кворума 17 . Программа вирулентности Agrobacterium регулируется несколькими сигналами, доступными в ризосфере, и включает в себя два набора 2-компонентных систем, систему ChvG / I и систему VirA / G. Кислотные условия в ризосфере активируют транскрипцию chvG / I , virA / G , И несколько других генов, участвующих в патогенезе Agrobacterium , включая virE0 , virE1 , virH1 , virH2 и гены системы секреции типа VI (T6SS) 18. Фенольные соединения растительного происхождения, включая ацетозиригон (4'-гидрокси-3 ', 5 '-диметоксиацетофенон), активировать VIrA / G 2-компонентная система через механизмы сигнализации фосфорилирования 19 . Затем VirA / G активирует весь регулятор vir , что приводит к переносу и интеграции бактериального фрагмента ДНК размером 20 кБ, называемого передаточной ДНК (Т-ДНК) из его индуцирующей опухоль (Ti) плазмиды в ядро растения 16 . Т-ДНК несет гены, ответственные за синтез растительных гормонов индол-3-уксусной кислоты (IAA) ( iaaM и iaaH ) и цитокинина ( ipt ), и один раз экспрессируется в растительных клетках, образуется большое количество этих фитогормонов. Это приводит к аномальной пролиферации тканей и развитию опухоли растений, известной как болезнь коронального желчного пузыря, что является хронической и нерегулярной проблемой для растений 9 , 11 , 20 . IAA также действует совместно с салициловой кислотой и гамма-аминомасляной кислотой, чтобы подавить вирулентность Agrobacterium или уменьшить Agrobacteriu М кворум (QS) 17 , 21 , 22 . Чтобы противостоять этой репрессии, Т-ДНК также несет гены для биосинтеза опиона, который активирует чувствительность кворума Agrobacterium, чтобы способствовать патогенности Agrobacterium, а также служит источником питательных веществ для патогена 22 , 23 .
Несмотря на полное глубокое понимание взаимодействия Agrobacterium- plant и результирующей передачи Т-ДНК в хозяин растения, сложные сигнальные события на начальной стадии взаимодействия менее понятны. Это частично связано с ограничениями обычных подходов к исследованию сигнализации Agrobacterium- plant. Культуры суспензии клеток растений и искусственное рандование, специфичное для конкретного участка, обычно используются для изучения молекулярных взаимодействий с микроорганизмами 24 ,Ef "> 26 , 27. Однако клеточные суспензии не имеют типичной морфологии растений, в частности, суспензионные клетки растений не имеют корневых структур и корневых экссудатов, которые очень важны для активации микробного хемотаксиса и вирулентности 28 , 29. Содержание морфологии растений И корневая структура была устранена искусственно ранившимися растениями, что облегчает сайт-специфическую инфекцию, что приводит к обнаружению индуцированных генов, связанных с защитой растений, в непосредственно инфицированной растительной ткани 30 , 31. Однако искусственное ранение значительно отличается от патогенной инфекции в природе , В частности, поскольку ранение приводит к накоплению жасмоновой кислоты (JA), которое системно препятствует передаче сигналов естественного растения и защите 26. Кроме того, синтетические химикаты обычно используются для искусственного стимулирования реакции хозяина растенийИли вирулентности патогена. Хотя возможно добавление таких химических соединений, отражающих концентрацию в плазме, такое добавление не учитывает диффузию корневых экссудатов постепенно в окружающую ризосферу, которая генерирует хемотаксический градиент, определяемый микробами 28 , 32 . Учитывая ограничения обычных подходов к изучению взаимодействий растений и микробов, точность и глубина полученных данных могут быть затруднены и ограничены, а знания, полученные из обычных подходов, могут не переводить непосредственно в planta . Многие аспекты сигнальной передачи растений – Agrobacterium еще не полностью поняты, особенно на ранней стадии взаимодействия, когда симптомы болезни еще не развиты.
Чтобы изменить ограничения обычных подходов, эта работа представляет собой недорогую, жестко контролируемую и гибкую гидропонику cКоторая позволяет исследователям глубже проникнуть в сложные сигнальные и ответные пути на начальном этапе взаимодействия молекулярных растений с микробами. Гидропоника широко используется для изучения питательных веществ растений, корневых экссудатов, условий роста и воздействия металлической токсичности на растения 33 , 34 . Существует несколько преимуществ гидропонных моделей, в том числе небольшие пространственные требования, доступность различных растительных тканей, жесткий контроль над питательными / экологическими условиями и борьба с вредителями / болезнями. Гидропонические системы также менее ограничивают рост растений по сравнению с методами агара / фитогара, которые обычно ограничивают рост через 2-3 недели. Важно отметить, что содержание цельнозерновых структур способствует естественной корневой секреции, необходимой для микробного хемотаксиса и индукции вирулентности 8 , 29 . Система descriПостель здесь проще и менее трудоемко, чем альтернативы 33 , 34 . Он использует меньше деталей и не требует каких-либо инструментов, кроме стандартных ножниц. Он использует металлическую сетку (в отличие от нейлона 33 ) в качестве сильной поддержки роста растений и простой метод аэрации в стерильных условиях путем встряхивания для поддержки роста микроорганизмов. Кроме того, система может использовать металлическую сетку различных размеров для поддержки роста растений, в которой размещаются разнообразные виды растений, не ограничивая ширину их корней.
В представленной здесь системе гидропонной кокультивации растения выращивают в стерильной гидропонной системе, где корни растений выделяют органические соединения, поддерживающие рост инокулированных бактерий. В этой системе кокультивации никакие искусственные химические вещества, такие как растительные гормоны, защитный элиситор или вызывающие вирулентность химические вещества, не дополняются, что отражает естественную клетку-сигнальный гомеостаз во время взаимодействия растений с микробами. С помощью этой гидропонной системы кокультивации можно было одновременно определить экспрессию гена в корневой ткани Arabidopsis thaliana Col-0 при инфицировании Agrobacterium , а также активацию генов Agrobacterium при кокультивации с Arabidopsis . Кроме того, было продемонстрировано, что эта система подходит для изучения присоединения Agrobacterium к корням растений, а также к профилю секреторного корня растения, при кокуляции (инфекции) Agrobacterium ( рис. 1 ).
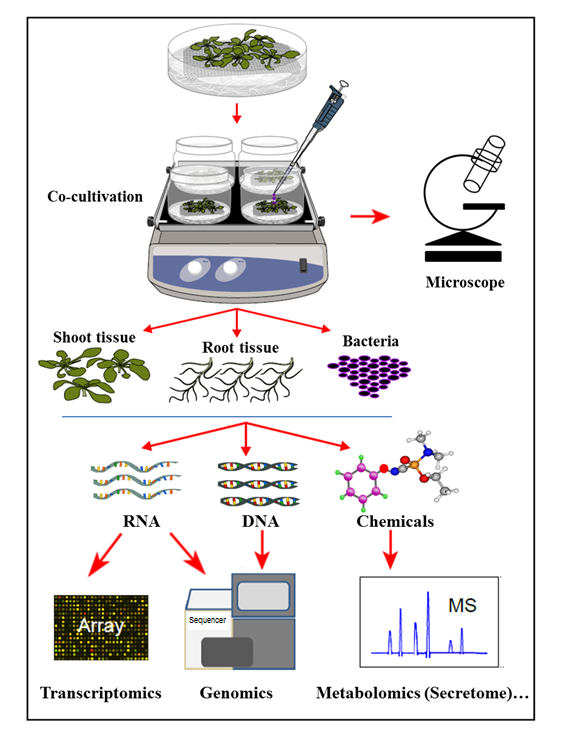
Рисунок 1: Обзор системы гидропонной кокультивации с анализом проб. Растения выращивают поверх сетки (побеги над сеткой), причем корни погружаются в гидропонную среду, которая затем инокулируется бактериями fИли сокультура. Затем растительные ткани и бактерии разделяют для одновременных экстракций и анализов. Эта цифра была изменена из ссылки 35 .
Protocol
Representative Results
Discussion
Учитывая постепенный характер секреции корней, концентрация вызывающих вирулентность химических веществ, продуцируемых в planta, и их влияние на динамические взаимодействия растений и микробов происходят в пространственных и временных градиентах. В этой системе гидропонной совме…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Мы хотели бы поблагодарить Брайана Веселовского и Александра У. Истмана за помощь и полезную дискуссию. Мы также хотели бы поблагодарить доктора. Юджин Нестер, Лингруй Чжан, Хайтао Шен, Юхай Цуй и Грег Торн за помощь, полезные обсуждения и критическое чтение рукописи. Это исследование было профинансировано сельским хозяйством и агропродовольственной Канадой, Growing Forward-AgriFlex (RBPI № 2555) и проектом «Рост вперед II» № 1670, проведенным авторами в рамках их обязанностей. Это исследование было также частично профинансировано Советом по исследованиям естественных наук и инженерных исследований Канады (NSERC) RGPIN-2015-06052, присуждаемым ZC Yuan.
Materials
| plant seeds (Arabidopsis thaliana Col-0) | Arabidopsis Biological Resource Centre | CS7000 | https://abrc.osu.edu/order-stocks |
| bacteria (Agrobacterium tumefaciens C58) | University of Washington | N/A | |
| labeled bacteria | in-house | optional, depends on downstream analyses | |
| vortex | (various) | ||
| microcentrifuge tubes | (various) | ||
| microcentrifuge | (various) | ||
| 5% sodium hypochlorite | (various) | ||
| double distilled water | (various) | ||
| autoclave | (various) | ||
| micropipette | (various) | ||
| 70 % ethanol | (various) | ||
| Murashige and Skoog (MS) basal salts | Sigma-Aldrich | M5524 | |
| sucrose | (various) | ||
| MES | (various) | ||
| B5 vitamin mix | Sigma-Aldrich | G1019 | |
| phytoagar | (various) | ||
| deep Petri dishes | (various) | ||
| stainless steel mesh | Ferrier Wire Goods Company Ltd | N/A | grade: 304; mesh count: 40 × 40; wire DIA: 0.01 |
| micropore tape, 1 inch | 3M | 1530-1 | |
| diurnal growth chamber | (various) | ||
| cylindrical glass tanks, 100 × 80 mm | Pyrex | 3250 | other sizes can be used, in which case liquid content may need adjustment |
| flow hood | (various) | ||
| forcepts | (various) | ||
| yeast extract | (various) | ||
| tryptone | (various) | ||
| MgSO4 | (various) | ||
| shaking incubator | (various) | ||
| spectrophotometer | (various) | ||
| NaCl | (various) | ||
| shaker | (various) | ||
| scissors | (various) | optional, depends on downstream analyses | |
| fluorescence microscope | (various) | optional, depends on downstream analyses | |
| microscope slides and cover slips | (various) | optional, depends on downstream analyses | |
| nail polish | (various) | optional, depends on downstream analyses | |
| Bacterial RNA extraction kit | (various) | optional, depends on downstream analyses | |
| plant RNA extraction kit (RNeasy Plant Mini Kit) | Qiagen | 74903 or 74904 | optional, depends on downstream analyses |
| material and equipment for RT-qPCR | (various) | optional, depends on downstream analyses | |
| material and equipment for microarray analysis | (various) | optional, depends on downstream analyses | |
| liquid nitrogen | (various) | optional, depends on downstream analyses | |
| mortar and pestle | (various) | optional, depends on downstream analyses | |
| 0.2 µm pore filter | (various) | optional, depends on downstream analyses | |
| 50 mL conical tubes | (various) | optional, depends on downstream analyses | |
| freeze dryer | (various) | optional, depends on downstream analyses | |
| sealable test tubes | (various) | optional, depends on downstream analyses | |
| ethyl acetate | (various) | optional, depends on downstream analyses | |
| nitrogen gas | (various) | optional, depends on downstream analyses | |
| material and equipment for HPLC | (various) | optional, depends on downstream analyses | |
| material and equipment for ESI-TOF-MS | (various) | optional, depends on downstream analyses |
References
- Lambers, H., Mougel, C., Jaillard, B., Hinsinger, P. Plant-microbe-soil interactions in the rhizosphere: An evolutionary perspective. Plant Soil. 321 (1), 83-115 (2009).
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: The microbial ecology of the rhizosphere. Nat. Rev. Microbiol. 11 (11), 789-799 (2013).
- Somers, E., Vanderleyden, J., Srinivasan, M. Rhizosphere bacterial signalling: A Love Parade beneath our feet. Crit. Rev. Microbiol. 30 (4), 205-240 (2004).
- Barah, P., Winge, P., Kusnierczyk, A., Tran, D. H., Bones, A. M. Molecular signatures in Arabidopsis thaliana in response to insect attack and bacterial infection. PLoS ONE. 8 (3), (2013).
- Zhang, J., Zhou, J. -. M. Plant immunity triggered by microbial molecular signatures. Mol. Plant. 3 (5), 783-793 (2010).
- Paterson, E., Gebbing, T., Abel, C., Sim, A., Telfer, G. Rhizodeposition shapes rhizosphere microbial community structure in organic soil. New Phytol. 173 (3), 600-610 (2006).
- Hartmann, A., Schmid, M., van Tuinen, D., Berg, G. Plant-driven selection of microbes. Plant Soil. 321 (1-2), 235-257 (2008).
- Micallef, S. A., Shiaris, M. P., Colon-Carmona, A. Influence of Arabidopsis thaliana accessions on rhizobacterial communities and natural variation in root exudates. J. Exp. Bot. 60 (6), 1729-1742 (2009).
- Burr, T., Otten, L. Crown gall of grape: Biology and disease management. Annu. Rev. Phytopathol. 37, 53-80 (2001).
- Clough, S. J., Bent, A. F. Floral dip: A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana. Plant J. 16 (6), 735-743 (1998).
- Binns, A. N., Costantino, P., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. The Agrobacterium oncogenes. The Rhizobiaceae. , (1998).
- Gheysen, G., Angenon, G., Van Montagu, M., Lindsey, K. Agrobacterium-mediated plant transformation: a scientifically intriguing story with significant applications. Transgenic Plant Research. , (1998).
- Valvekens, D., Von Montagu, M. V., Van Lijsebettens, M. Agrobacterium tumefaciens-mediated transformation of Arabidopsis thaliana root explants by using kanamycin selection. Proc. Natl. Acad. Sci. USA. 85 (15), 5536-5540 (1988).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283 (1999).
- Chilton, M. D., et al. Stable incorporation of plasmid DNA into higher plant cells: The molecular basis of crown gall tumorigenesis. Cell. 11 (2), 263-271 (1977).
- Gelvin, S. B. Agrobacterium in the genomics age. Plant Physiol. 150 (4), 1665-1676 (2009).
- Subramoni, S., Nathoo, N., Klimov, E., Yuan, Z. -. C. Agrobacterium tumefaciens responses to plant-derived signaling molecules. Front. Plant Sci. 5, 322 (2014).
- Yuan, Z., Liu, P., Saenkham, P., Kerr, K., Nester, E. W. Transcriptome profiling and functional analysis of Agrobacterium tumefaciens reveals a general conserved response to acidic conditions (pH 5.5) and a complex acid-mediated signaling involved in Agrobacterium-plant interactions. J. Bacteriol. 190 (2), 494-507 (2008).
- Stachel, S. E., Messens, E., Van Montagu, M., Zambryski, P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens. Nature. 318 (6047), 624-629 (1985).
- Memelink, J., de Pater, B. S., Hoge, J. H. C., Schilperoort, R. A. T-DNA hormone biosynthetic genes: Phytohormones and gene expression in plants. Dev. Genet. 8 (5-6), 321-337 (1987).
- Yuan, Z. -. C., et al. The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. USA. 104 (28), 11790-11795 (2007).
- Yuan, Z. -. C., Haudecoeur, E., Faure, D., Kerr, K. F., Nester, E. W. Comparative transcriptome analysis of Agrobacterium tumefaciens in response to plant signal salicylic acid, indole-3-acetic acid and γ-amino butyric acid reveals signalling cross-talk and Agrobacterium-plant co-evolution. Cell. Microbiol. 10 (11), 2339-2354 (2008).
- Li, P. L., Farrand, S. K. The replicator of the nopaline-type Ti plasmid pTiC58 is a member of the repABC family and is influenced by the TraR-dependent quorum-sensing regulatory system. J. Bacteriol. 182 (1), 179-188 (2000).
- Atkinson, M. M., Huang, J., Knopp, J. A. Hypersensitivity of suspension-cultured tobacco cells to pathogenic bacteria. Phytopathology. 75 (11), 1270-1274 (1985).
- Veena, ., Jiang, H., Doerge, R. W., Gelvin, S. B. Transfer of T-DNA and Vir proteins to plant cells by Agrobacterium tumefaciens induces expression of host genes involved in mediating transformation and suppresses host defense gene expression. Plant J. 35 (2), 219-236 (2003).
- León, J., Rojo, E., Sanchez-Serrano, J. J. Wound signalling in plants. J. Exp. Bot. 52 (354), 1-9 (2001).
- Ditt, R. F., Kerr, K. F., de Figueiredo, P., Delrow, J., Comai, L., Nester, E. W. The Arabidopsis thaliana transcriptome in response to Agrobacterium tumefaciens. Mol. Plant Microbe In. 19 (6), 665-681 (2006).
- Mandimba, G., Heulin, T., Bally, R., Guckert, A., Balandreau, J. Chemotaxis of free-living nitrogen-fixing bacteria towards maize mucilage. Plant Soil. 90 (1-3), 129-139 (1986).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiol. 148 (3), 1547-1556 (2008).
- Lee, C. W., et al. Agrobacterium tumefaciens promotes tumor induction by modulating pathogen defense in Arabidopsis thaliana. Plant Cell. 21 (9), 2948-2962 (2009).
- Reymond, P., Weber, H., Damond, M., Farmer, E. E. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell. 12 (5), 707-720 (2000).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front. Plant Sci. 5, 252 (2014).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14 (1), 69 (2014).
- Conn, S. J., et al. Protocol: Optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9 (1), 4 (2013).
- Nathoo, N. . Identification of putative plant defense genes using a novel hydroponic co-cultivation technique for studying plant-pathogen interaction. , (2015).
- Shaner, N. C., Campbell, R. E., Steinbach, P. A., Giepmans, B. N., Palmer, A. E., Tsien, R. Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol. 22 (12), 1567-1572 (2004).
- Wise, A. A., Liu, H., Binns, A. N. Nucleic acid extraction from Agrobacterium strains. Methods Mol. Bio. 343, 67-76 (2006).
- Nolan, T., Hands, R. E., Bustin, S. A. Quantification of mRNA using real-time RT-PCR. Nat. Protoc. 1 (3), 1559-1582 (2006).
- Salter, M. G., Conlon, H. E. Extraction of plant RNA. Methods Mol. Bio. 362, 309-314 (2007).
- Bao, Y., Wang, S., Yang, X., Li, T., Xia, Y., Meng, X. Metabolomic study of the intervention effects of Shuihonghuazi Formula, a Traditional Chinese Medicinal formulae, on hepatocellular carcinoma (HCC) rats using performance HPLC/ESI-TOF-MS. J. Ethnopharmacol. 198, 468-478 (2017).
- Korves, T. M., Bergelson, J. A developmental response to pathogen infection in Arabidopsis. Plant Physiol. 133 (1), 339-347 (2003).
- Lyons, R., Rusu, A., Stiller, J., Powell, J., Manners, J. M., Kazan, K. Investigating the association between flowering time and defense in the Arabidopsis thaliana-Fusarium oxysporum interaction. PLoS ONE. 10 (6), e0127699 (2015).
- Badri, D. V., Weir, T. L., vander Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: Plant-microbe interactions. Curr. Opin. Biotechnol. 20 (6), 642-650 (2009).
- Baerson, S. R., et al. Detoxification and transcriptome response in Arabidopsis seedlings exposed to the allelochemical benzoxazolin-2(3H)-one. J. Biol. Chem. 280 (23), 21867-21881 (2005).

