In Vivo EPR beoordeling van pH, pO2, Redox Status, en concentraties van fosfaat en glutathion in de communicatie van de Tumor
Summary
Low-veld (L-band, 1,2 GHz) elektron paramagnetisch resonantie met behulp van oplosbare nitroxyl en trityl sondes is voor beoordeling van fysiologisch belangrijke parameters in de communicatie van de tumor in muismodellen van borstkanker aangetoond.
Abstract
Dit protocol demonstreert de mogelijkheden van lage-veld elektron paramagnetisch resonantie (EPR)-op basis van technieken in combinatie met functionele paramagnetisch sondes kwantitatieve informatie te verstrekken over de chemische tumor communicatie (TME), met inbegrip van p O2, pH, redox status, concentraties van interstitiële anorganisch fosfaat (Pi), en intracellulaire glutathion (GSH). In het bijzonder, een toepassing van een onlangs ontwikkelde oplosbare multifunctionele trityl sonde biedt onovertroffen gelegenheid voor in vivo gelijktijdige metingen van pHen pO2 Pi E xtracellular ruimte (hoop sonde). De metingen van drie parameters met behulp van één sonde voorzien in hun correlatie analyse onafhankelijk van de distributie van de sonde en het tijdstip van de metingen.
Introduction
Een sleutelrol van de TME in de progressie van kanker en therapie is steeds meer gewaardeerd1. Onder belangrijke fysiologische parameters van de TME in stevige tumors, weefsel hypoxie2, acidose3,4, hoge verminderen capaciteit5, verhoogde concentraties van intracellulaire GSH6,7, en interstitiële Pi8 zijn goed gedocumenteerd. Noninvasive in vivo pO2, pH, Pi, GSH en redox evaluaties unieke inzicht verwerven in de biologische processen in TME en voorschot tools voor pre-klinische screening van anti-kanker medicijnen en TME-gerichte therapeutische strategieën helpen. Een redelijke radiofrequentie indringingsdiepte in weefsels door magnetische resonantie beeldvorming (MRI) en lage-veld EPR gebaseerde technieken maakt ze de meest geschikte benaderingen voor noninvasive beoordeling van deze TME-parameters. MRI berust grotendeels op imaging water protonen en wordt veel gebruikt in de klinische instellingen om anatomische omzetting te leveren maar mist functionele resolutie. De metingen van de fosfor-31 nucleaire magnetische resonantie (31P-NMR) van extracellulaire Pi concentratie en pH op basis van een signaal van endogene fosfaat potentieel aantrekkelijk zijn voor TME karakterisering, maar zijn meestal gemaskeerd door meerdere malen hogere intracellulaire Pi concentraties9,10. In tegenstelling tot dit, EPR metingen gebaseerd op spectroscopie en beeldvorming van speciaal ontworpen paramagnetisch sondes om functionele omzetting te leveren. Opmerking dat exogene EPR sondes een voordeel ten opzichte van exogene hebben NMR sondes te wijten aan de veel hogere intrinsieke gevoeligheid van EPR en afwezigheid van endogene achtergrond EPR signalen. De recente ontwikkeling van een dubbele functie-nitroxyl voor pH en redox sonde11 en multifunctionele trityl sonde12 onovertroffen mogelijkheden biedt voor in vivo gelijktijdige metingen van verschillende TME parameters en hun correlatie analyse onafhankelijke sonde distributie en tijdstip van de meting. Om onze kennis zijn er geen andere methoden beschikbaar voor het gelijktijdig in vivo fysiologisch belangrijke chemische TME parameters in levende onderwerpen, zoals pO2pHe, Pi, redox en GSH te beoordelen.
Sondes voor In Vivo Functionele metingen:
Figuur 1 toont chemische structuren van de paramagnetisch sondes gebruikt voor toegang tot TME parameters, waaronder sondes voor deeltjes en oplosbaar. Hoge functionele gevoeligheid, stabiliteit in levend weefsel, en minimale toxiciteit zijn een paar voordelen waardoor deeltjes sondes over oplosbare sondes voor in vivo EPR oxymetrie de voorkeur. Bijvoorbeeld, zwevende sondes toegenomen retentietijden op de site van weefsel implantaat in vergelijking met oplosbare sondes waardoor longitudinale meting van weefsel pO2 weken. Aan de andere kant, oplosbare sondes deeltjes sondes overtreffen door middel van ruimtelijke-resolved metingen met behulp van EPR gebaseerde beeldvormende technieken evenals waardoor gelijktijdige analyses van veelvoudige functionaliteit (pO2, pH, Pi, redox, en GSH).
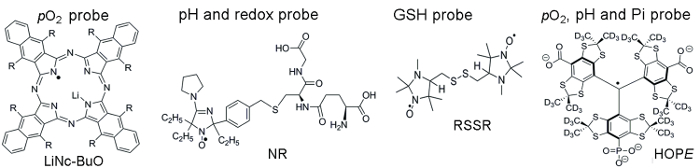
Figuur 1. Chemische structuren van de paramagnetisch sondes die TME beoordeling assay monteren. Dit omvat de zwevende pO2 sonde, LiNc-BuO (R = – O (CH2)3CH3), en oplosbaar sondes: dubbele functie pH en redox sonde, NR; GSH-gevoelige sonde, RSSR; en multifunctionele pO2, pH en Pi sonde van de extracellulaire communicatie, de hoop sonde. De synthese van deze sondes is beschreven in de verstrekte referenties 11,12. Klik hier voor een grotere versie van dit cijfer.
Protocol
Representative Results
Discussion
De gepresenteerde methoden toestaan voor noninvasive in vivo beoordeling voor de kritische parameters van de chemische TME, namelijk pO2, pH, redox status en concentraties van interstitiële Pi en intracellulaire GSH. Magnetische resonantie technieken, zoals MRI en lage-veld EPR, zijn de methoden van keuze voor noninvasive in vivo profilering van deze TME-parameters. MRI visualiseert anatomische structuren maar mist functionele gevoeligheid. In tegenstelling tot MRI bieden EPR techni…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dit werk werd slechts gedeeltelijk ondersteund door de NIH grants CA194013, CA192064 en U54GM104942. De WVCTSI is erkend voor start-up VVK, AB, en onderzoekingen. De auteurs bedanken Dr. M. Gencheva en K. Steinberger voor de hulp bij de illustratieve experimenten. De inhoud is uitsluitend de verantwoordelijkheid van de auteurs en vertegenwoordigt niet noodzakelijk de officiële standpunten van de NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
References
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

