Réactions de Cascade enzymatique pour la synthèse des aminoalcools chiraux de L-lysine
Summary
Aminoalcools chiraux sont des molécules polyvalents pour une utilisation comme échafaudages en synthèse organique. A partir de L-lysine, synthétiser des aminoalcools par une réaction enzymatique cascade combinant diastéréosélective Cabay oxydation catalysée par dioxygénase suivie d’un clivage de la portion d’acide carboxylique de l’acide aminé hydroxyle correspondant par un décarboxylase.
Abstract
Aminés alcools sont des composés polyvalents avec un large éventail d’applications. Par exemple, ils ont servi comme échafaudages chiraux en synthèse organique. Leur synthèse par classiques de chimie organique nécessite souvent des processus de synthèse à plusieurs étapes fastidieuses, avec contrôle difficile du résultat stéréochimique. Nous présentons un protocole enzymatiquement synthétiser des alcools aminés à partir de la L-lysine facilement disponible en 48 h. Ce protocole combine deux réactions chimiques qui sont très difficiles à mener en synthèse organique classique. Dans la première étape, la régio – et diastéréosélective l’oxydation d’une liaison C-H non activée de la lysine chaîne latérale est catalysée par une dioxygénase ; un deuxième régio – et diastéréosélective d’oxydation catalysée par une dioxygénase regiodivergent peut conduire à la formation des 1, 2-diols. Dans la dernière étape, le groupe carboxylique de l’acide aminé alpha est clivé par une décarboxylase de phosphate de pyridoxal (PLP) (DC). Cette étape décarboxylante affecte uniquement le carbone alpha de l’acide aminé, en conservant le centre stéréogène hydroxy substitué en position bêta/gamma. Les aminoalcools qui en résultent sont donc optiquement enrichis. Le protocole a été appliqué avec succès à la synthèse de quatre aminoalcools semipreparative-échelle. Surveillance des réactions a été réalisée par chromatographie liquide haute performance (HPLC) après dérivatisation par 1-fluoro-2, 4-dinitrobenzène. Simple purification par extraction en phase solide (SPE) accordée les aminoalcools avec d’excellents rendements (93 % de > 95 %).
Introduction
Malgré les avantages offerts par biocatalyse, l’intégration des étapes biocatalytiques de voies synthétiques ou itinéraires biocatalytiques totales reste essentiellement limitée aux résolutions cinétiques enzymatiques. Ces itinéraires ont été largement utilisés dans un premier temps en synthèse asymétrique de chimio-enzymatique, mais biocatalyse offre beaucoup plus de possibilités dans le groupe fonctionnel interconversions avec grande stéréosélectivité1,2,3 . En outre, comme réactions biocatalytiques sont déroulent dans des conditions similaires, il est donc possible d’effectuer des réactions de la cascade dans un seul récipient fashion4,5.
Aminoalcools chiraux sont des molécules polyvalents pour une utilisation comme auxiliaires ou des échafaudages en synthèse organique6. La portion d’alcool aminé est fréquemment trouvée dans les métabolites secondaires et dans les ingrédients pharmaceutiques actifs (API). Β-aminoalcools primaires sont facilement disponibles auprès des acides α-aminés correspondantes par synthèse chimique conventionnelle, mais l’accès à γ-aminoalcools chiraux ou aminoalcools secondaires nécessite souvent fastidieux parcours synthétiques ainsi que de sensibles contrôle de la stéréochimie7,8,9,10. En raison de sa grande stéréosélectivité, biocatalyse peut fournir une voie de synthèse supérieure à ces briques chiraux11,12,13,14.
Nous avons déjà indiqué la synthèse des mono – et di-hydroxy-L-lysines par diastéréosélective hydroxylation enzymatique catalysée par dioxygénases du fer (II) / dépendante de le α-cétoacide famille oxygénase (αKAO) (Figure 1)15. En particulier, à partir de L-lysine, le KDO1 dioxygénase catalyse la formation du (3S) – dérivé hydroxylé (1), tandis que les 4R– dérivé (2) est formé par la réaction avec KDO2 dioxygénase. Hydroxylations successives regiodivergent par KDO1 et KDO2 conduisent à la formation des (3R, 4R) – dihydroxy – L-lysine (3) sous forme optiquement pure. Cependant, la gamme limitée de substrat de ces enzymes empêche leur grande utilisation en synthèse chimique, en particulier dans l’hydroxylation des amines simples, une portion d’acide carboxylique en position α du groupe amino est essentielle pour l’activité16.
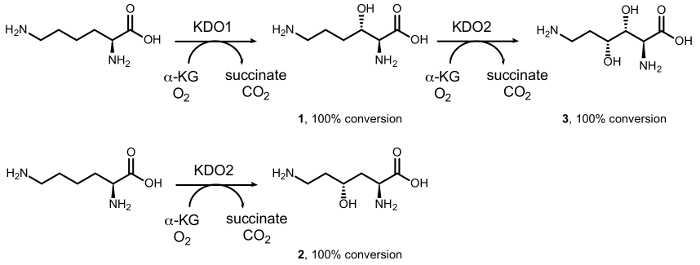
Figure 1 : conversions biocatalytiques de L-lysine. Conversion en (3S) – hydroxy – L-lysine (1) catalysée par la KDO1 dioxygénase ; (4R)– hydroxy – L-lysine (2) catalysée par KDO2 dioxygénase ; et 3R, 4R– dihydroxy – L-lysine (3) par réaction en cascade catalysée successivement par KDO1 et KDO2 dioxygénases. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Décarboxylation est une réaction commune au métabolisme17. En particulier, les acides aminés DCs (EC 4.1.1) sont exemptes de cofacteur (pyruvoyl-dépendante) ou enzymes PLP-dépendantes et catalyser la décarboxylation des acides aminés dans les polyamines correspondants chez les bactéries et supérieur organismes18,19 , 20 , 21 , 22. les mono – et dihydroxy composés (Figure 3) 4–7, 10–11 correspondent aux hydroxylés cadavérine, la diamine obtenue par décarboxylation de la L-lysine. La cadavérine est une composante clée pour l’industrie chimique, plus précisément, c’est un composant de polymères polyamide et polyuréthane. Par conséquent, production bio de cette diamine provenant de ressources renouvelables a attiré l’attention comme une alternative à la route à base de pétrole, et divers micro-organismes ont été conçus à cet effet. Dans ces voies métaboliques, lysine DC (PMA) est l’enzyme clé. PMA est une enzyme dépendante du PLP, appartenant à la famille alanine racémase (AR) structurel23. Les contrôleurs de domaine de PLP-dépendantes (PLP-DCs) sont connus pour être fortement axée sur le substrat. Cependant, quelques enzymes possèdent la capacité de la promiscuité légère, étant actif vers acides aminés aussi bien L-lysine et L-ornithine, comme par exemple la PMD à partir de Selenomonas rumirantium (LDCSrum), qui a des constantes cinétiques similaires pour lysine et ornithine décarboxylation24,25. Ce substrat étendu spécificité fait cette enzyme un bon candidat pour la décarboxylation des mono – et di-hydroxy-L-lysine. En outre, pour trouver DCs active vers les dérivés hydroxyles de lysine, nous avons examiné le contexte génomique des gènes codant les enzymes αKAO. En effet, dans les génomes procaryotes les gènes codant les enzymes impliquées dans la biosynthèse des même sont généralement conjointement localisés dans des groupes de gènes. Le gène KDO2 (à partir de Chitinophaga pinensis) a été trouvé Co localisé avec un gène codant putatif PLP-DC (Figure 2). En revanche, aucun gène codant la DC n’a été trouvé en analysant le contexte génomique de la dioxygénase KDO1. La protéine PLP-DC de c. pinensis (DCCpin) fut donc choisie comme un candidat prometteur pour catalyser l’étape de la décarboxylation de la réaction en cascade.
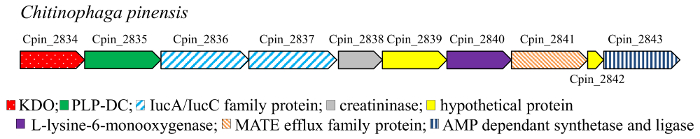
Figure 2 : contexte génomique du gène KDO2 dans c. pinensis. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Par conséquent, nous avons conçu des réactions enzymatiques cascade dioxygénases et DCs pour réaliser la synthèse d’alcools aliphatiques chiraux β – et γ-amino acides aminés (Figure 3). Comme indiqué précédemment, l’oxydation de C-H, catalysée par la αKAO introduit le centre stéréogène substituant hydroxy avec diastéréosélectivité total ; la chiralité Cβ/γ est préservée dans l’étape décarboxylante, qui affecte uniquement le carbone Cα des acides aminés portion16.
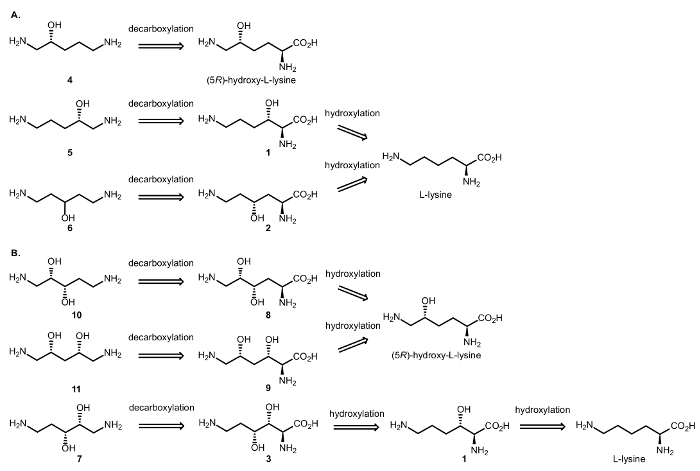
Figure 3 : analyse rétrosynthétique. Retrosynthesis (A) de β – et γ-aminoalcools (R) – 1, 5 – diaminopentan-2-ol (4) (5R) – hydroxy – L-Lysine et le (S) – 1, 5 – diaminopentan-2-ol (5) et 1, 5-diaminopentan-3-ol (6) de L-lysine. (B) Retrosynthesis de β, γ et β, δ-amino diols (2S, 3S) – 1, 5 – diaminopentane-2, 3-diol (10) et (2R, 4S) – 1,5 – diaminopentane-2, 4-diol (11) à partir de (5R)- hydroxy-L-lysine et 2R, 3R– 1,5 – diaminopentane-2, 3-diol (7) à partir de L-lysine. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
À partir de L-lysine et ses 5R-dérivé hydroxylé, nous rapportons ici un deux/trois étape, un pot, procédure enzymatique combinant dioxygénases et PLP-DCs pour obtenir la cible aminoalcools. Avant la synthèse à l’échelle du laboratoire des molécules cibles, la méthode a été développée à l’échelle analytique pour ajuster les conditions de réaction, par exemple, les concentrations de l’enzyme, nécessaires pour permettre la conversion complète de produits de départ ; Nous présentons cette procédure aussi bien.
Protocol
Representative Results
Discussion
Dérivés et des aminoalcools chiraux ont un large éventail d’applications, allant des auxiliaires chiraux pour la synthèse organique à la thérapie pharmaceutique. Synthèse en plusieurs étapes de fabrication d’aminoalcools par synthèse organique classique sont nombreux, mais peut ne pas être efficace à cause de mesures de protection/déprotection fastidieux ainsi qu’un contrôle sensible de la stéréochimie16. Une approche BIOCATALYTIQUE qui distribue avec les mesures de protection…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Les auteurs remercient Véronique de Berardinis pour discussion fructueuse et Alain Perret, Christine Pellé et Peggy Sirvain pour le support technique.
Materials
| HEPES | Sigma Aldrich | H3375 | |
| L-lysine hydrochloride | Sigma Aldrich | L5626 | |
| (5S)-hydroxy-L-lysine | Sigma Aldrich | GPS NONH | Out sourcing |
| α-ketoglutaric acid | Sigma Aldrich | 75892 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Ammonium Iron(II) sulfate hexahydrate | Acros | 201370250 | |
| Pyridoxal phosphate (PLP) | Sigma Aldrich | 82870 | |
| 3,4-dimercaptobutane-1,2-diol (DTT) | Sigma Aldrich | D0632 | |
| 1-fluoro-2,4-dinitrobenzene (DNFB) | Sigma Aldrich | D1529 | |
| Ethanol | VWR | 20825.290 | |
| Sodium hydrogen carbonate | Sigma Aldrich | 71631 | |
| HCl 37% | Sigma Aldrich | 435570 | |
| HCl 0.1M | Fluka | 35335 | |
| Acetonitrile HiPerSolv CHROMANORM for LC-MS | VWR | 83640.320 | |
| 2,2,2-trifluoroacetic acid | VWR | 153112E | |
| Ammonia 28% | VWR | 21182.294 | |
| Methanol HiPerSolv CHROMANORM for LC-MS | VWR | 83638.32 | |
| Formic acid | Acros | 270480010 | |
| Phosphoric acid 85% | Acros | 201145000 | |
| Deuterium oxide | Acros | 320,710,075 | |
| NaOH | Sigma Aldrich | S5881 | |
| C18 HPLC column | Phenomenex | 00F-4601-Y0 | |
| Accela UHPLC System | ThermoFisher Scientific | ||
| Accela PDA detector | ThermoFisher Scientific | ||
| 4mm syringe filters – 0,22µm – PVDF | Merck | SLGVR04NL | |
| Single-use tuberculin syringe with ml graduation, Luer tip | VWR | HSWA5010.200V0 | |
| Cation exchange resin 100-200 mesh | Sigma Aldrich | 217506 | |
| Mixed mode cation-exchange solid-phase extraction cartridge 6 mL | Waters | 186000776 | |
| Extraction manifold | Waters | WAT200609 | |
| Rotary evaporator | Büchi | 531-0103 | |
| Lyophilizer alpha 1-2 LDplus | Christ | L083302 | |
| Micropipette 20 µL | Eppendorf | 3121000031 | |
| Micropipette 100 µL | Eppendorf | 3121000074 | |
| Micropipette 500 µL | Eppendorf | 3121000112 | |
| Micropipette 1000 µL | Eppendorf | 3121000120 | |
| 300 MHz spectrometer | Bruker | ||
| 2 mL microtube | CLEARLine | CL20.002.0500 | |
| 50 mL conical-bottom centrifuge tube | Fischer Scientific | 05-539-8 | |
| 25 mL round-bottom flask 14/23 | Fischer Scientific | 10353331 | |
| 100 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL erlenmeyer flask | Fischerbrand | 15496143 |
References
- Nestl, B. M., Hammer, S. C., Nebel, B. A., Hauer, B. New Generation of Biocatalysts for Organic Synthesis. Ang. Chem. Int. Ed. 53 (12), 3070-3095 (2014).
- Reetz, M. T. Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Turner, N. J., O’Reilly, E. Biocatalytic retrosynthesis. Nat. Chem. Biol. 9 (5), 285-288 (2013).
- Oroz-Guinea, I., Garcia-Junceda, E. Enzyme catalysed tandem reactions. Curr. Opin. Chem. Biol. 17 (2), 236-249 (2013).
- Ricca, E., Brucher, B., Schrittwieser, J. H. Multi-Enzymatic Cascade Reactions: Overview and Perspectives. Adv. Syn. Catal. 353 (13), 2239-2262 (2011).
- Ager, D. J., Prakash, I., Schaad, D. R. 1,2-Amino Alcohols and Their Heterocyclic Derivatives as Chiral Auxiliaries in Asymmetric Synthesis. Chem. Rev. 96 (2), 835-876 (1996).
- Abiko, A., Masamune, S. An improved, convenient procedure for reduction of amino acids to aminoalcohols: Use of NaBH4-H2SO4. Tet. Lett. 33 (38), 5517-5518 (1992).
- McKennon, M. J., Meyers, A. I., Drauz, K., Schwarm, M. A convenient reduction of amino acids and their derivatives. J. Org. Chem. 58 (13), 3568-3571 (1993).
- Singh, P., Samanta, K., Das, S. K., Panda, G. Amino acid chirons: a tool for asymmetric synthesis of heterocycles. Org. Biomol. Chem. 12 (33), 6297-6339 (2014).
- Colomer, I., et al. Aminomethylhydroxylation of alkenes: Exploitation in the synthesis of scaffolds for small molecule libraries. Bioorg. Med. Chem. 23 (11), 2736-2740 (2015).
- Steinreiber, J., et al. Synthesis of Aromatic 1,2-Amino Alcohols Utilizing a Bienzymatic Dynamic Kinetic Asymmetric Transformation. Adv. Syn. Catal. 349 (8-9), 1379-1386 (2007).
- Steinreiber, J., et al. Overcoming Thermodynamic and Kinetic Limitations of Aldolase-Catalyzed Reactions by Applying Multienzymatic Dynamic Kinetic Asymmetric Transformations. Ang. Chem. Int. Ed. 46 (10), 1624-1626 (2007).
- Kohls, H., et al. Selective Access to All Four Diastereomers of a 1,3-Amino Alcohol by Combination of a Keto Reductase- and an Amine Transaminase-Catalysed Reaction. Adv. Syn. Catal. 357 (8), 1808-1814 (2015).
- Sehl, T., Maugeri, Z., Rother, D. Multi-step synthesis strategies towards 1,2-amino alcohols with special emphasis on phenylpropanolamines. J. Mol. Cat. B: Enzymatic. 114, 65-71 (2015).
- Martinez, S., Hausinger, R. P. Catalytic Mechanisms of Fe(II)- and 2-Oxoglutarate-dependent Oxygenases. J. Biol. Chem. 290 (34), 20702-20711 (2015).
- Baud, D., et al. Synthesis of Mono‐and Dihydroxylated Amino Acids with New α‐Ketoglutarate‐Dependent Dioxygenases: Biocatalytic Oxidation of C-H Bonds. ChemCatChem. , (2014).
- Suzuki, H., Kurihara, S., Kusano, T., Suzuki, H. Ch. 4. Polyamines. 4, 47-59 (2015).
- Kind, S., Wittmann, C. Bio-based production of the platform chemical 1,5-diaminopentane. Appl. Microbiol. Biotechnol. 91 (5), 1287-1296 (2011).
- Schneider, J., Wendisch, V. F. Biotechnological production of polyamines by bacteria: recent achievements and future perspectives. Appl. Microbiol. Biotechnol. 91 (1), 17-30 (2011).
- Qian, Z. -. G., Xia, X. -. X., Lee, S. Y. Metabolic engineering of Escherichia coli for the production of cadaverine: A five carbon diamine. Biotechnol. Bioeng. 108 (1), 93-103 (2011).
- Shin, J. H., Lee, S. Y. Metabolic engineering of microorganisms for the production of L-arginine and its derivatives. Microb. Cell. Fact. 13, (2014).
- Nguyen, A., Schneider, J., Reddy, G., Wendisch, V. Fermentative Production of the Diamine Putrescine: System Metabolic Engineering of Corynebacterium Glutamicum. Metabolites. 5 (2), 211 (2015).
- Kidron, H., Repo, S., Johnson, M. S., Salminen, T. A. Functional Classification of Amino Acid Decarboxylases from the Alanine Racemase Structural Family by Phylogenetic Studies. Mol. Biol. Evol. 24 (1), 79-89 (2007).
- Takatsuka, Y., Onoda, M., Sugiyama, T., Muramoto, K., Tomita, T., Kamio, Y. Novel Characteristics of Selenomonas ruminantium Lysine Decarboxylase Capable of Decarboxylating Both L-Lysine and L-Ornithine. Biosci. Biotechnol. Biochem. 63 (6), 1063-1069 (1999).
- Takatsuka, Y., Tomita, T., Kamio, Y. Identification of the Amino Acid Residues Conferring Substrate Specificity upon Selenomonas ruminantium Lysine Decarboxylase. Biosci. Biotechnol. Biochem. 63 (10), 1843-1846 (1999).
- Baud, D., et al. Biocatalytic Approaches towards the Synthesis of Chiral Amino Alcohols from Lysine: Cascade Reactions Combining alpha-Keto Acid Oxygenase Hydroxylation with Pyridoxal Phosphate- Dependent Decarboxylation. Adv. Syn. Catal. 359 (9), 1563-1569 (2017).
- Ilisz, I., Berkecz, R., Peter, A. Application of chiral derivatizing agents in the high-performance liquid chromatographic separation of amino acid enantiomers: a review. J. Pharm. Biomed. Anal. 47 (1), 1-15 (2008).
- . Organic Chemistry. Nuclear Magnetic Resonance (NMR) Spectroscopy Available from: https://www.jove.com/science-education/5680/nuclear-magnetic-resonance-nmr-spectroscopy (2017)
- Hibi, M., Ogawa, J. Characteristics and biotechnology applications of aliphatic amino acid hydroxylases belonging to the Fe(II)/alpha-ketoglutarate-dependent dioxygenase superfamily. Appl. Microbiol. Biotechnol. 98 (9), 3869-3876 (2014).
- Hüttel, W. Biocatalytic Production of Chemical Building Blocks in Technical Scale with α-Ketoglutarate-Dependent Dioxygenases. Chem. Ing. Tec. 85 (6), 809-817 (2013).
- Kourist, R., Guterl, J. -. K., Miyamoto, K., Sieber, V. Enzymatic Decarboxylation-An Emerging Reaction for Chemicals Production from Renewable Resources. ChemCatChem. 6 (3), 689-701 (2014).
- Lee, J., Michael, A. J., Martynowski, D., Goldsmith, E. J., Phillips, M. A. Phylogenetic diversity and the structural basis of substrate specificity in the beta/alpha-barrel fold basic amino acid decarboxylases. J. Biol. Chem. 282 (37), 27115-27125 (2007).
- Porter, J. L., Rusli, R. A., Ollis, D. L. Directed Evolution of Enzymes for Industrial Biocatalysis. ChemBiochem. 17 (3), 197-203 (2016).

