تشريح مجمعات البروتين متعدد الإشارات بالتكامل Bimolecular انجذاب تطهير (بيكاب)
Summary
ويصف هذه المخطوطة البروتوكول “تنقية تقارب التكامل بيموليكولار” (بيكاب). يسهل هذا الأسلوب رواية عزلة محددة وتوصيف البروتين المصب أي اثنين من البروتينات المتفاعلة، بينما استبعاد الأمم المتحدة الرصاصية البروتينات الفردية، فضلا عن مجمعات شكلت مع الشركاء ملزمة المتنافسة.
Abstract
الجمعية العامة من البروتين المجمعات إليه مركزية الكامنة وراء تنظيم العديد من الخلايا مما يشير إلى الممرات. كان تركيز رئيسي لبحوث الطب الأحيائي هو فك رموز كيف تتصرف هذه المجمعات البروتين الحيوي لدمج إشارات من مصادر متعددة من أجل توجيه استجابة بيولوجية معينة، وكيف يصبح حرر هذا في العديد من المرض الإعدادات. على الرغم من أهمية هذه الآلية الرئيسية للكيمياء الحيوية، هناك نقص في التقنيات التجريبية التي يمكن أن تيسر deconvolution محددة وحساسة من هذه المجمعات إشارات متعددة الجزيئية.
هنا هو معالجة هذا القصور من خلال المزيج من مقايسة البروتين التكامل مع نانوبودي الخاصة بالمطابقة، التي كنا قد وصف Bimolecular التكامل انجذاب تطهير (بيكاب). ويسهل هذا الأسلوب رواية عزلة محددة وتوصيف البروتين المتلقين للمعلومات من أي زوج من البروتينات المتفاعلة، باستبعاد الأمم المتحدة الرصاصية البروتينات الفردية والمجمعات التي شكلت مع الشركاء ملزمة المتنافسة.
تقنية بيكاب قابلة للتكيف لمجموعة واسعة من الاختبارات التجريبية المصب، ويسمح درجة عالية من الدقة التي توفرها هذه التقنية أكثر دقة التحقيقات في ميكانيكا الجمعية البروتين المعقدة مما هو ممكن حاليا باستخدام تقنيات تنقية النسب القياسية.
Introduction
الجمعية البروتين المعقدة عملية رئيسية في الحفاظ على خصوصية الزمانية المكانية للتنبيه العديد من مسارات1،2. في حين أن من المسلم به على نطاق واسع الطبيعة الحاسمة لهذا الدور التنظيمي، هناك نقص في التقنيات التجريبية المتاحة للتدقيق في هذه المجمعات. تركز معظم الدراسات إينتيراكتوميكس عند التفاعل مع البروتينات الفردية، أو في إثراء متسلسلة من المكونات الفردية المعقدة. هنا نقدم تقنية لعزل ديمر البروتين محددة بينما استثناء مويتيس الفردية من البروتينات مكون فضلا عن مجمعات شكلت مع تنافس ربط الشركاء3. وطلبنا هذا الأسلوب “تنقية تقارب التكامل بيموليكولار” (بيكاب)، كما أنه مزيج من التكامل البروتين الموجود سابقا جزء مقايسة، “بيموليكولار Fluorescence التكامل” (بيفك)، مع استخدام رواية نانوبودي الخاصة بتكيف المؤتلف نحو التجارة والنقل ومشتقاته (انظر الجدول للمواد)-
مقايسة تكامل يفتت بروتين نموذجي يعتمد على التعبير عن البروتينات “الطعم” و “فريسة” تنصهر لفصل أجزاء من الصحفيين مثل لوسيفراس4، β-جالاكتوسيداسي5أو البروتينات الفلورية الخضراء (بروتينات فلورية خضراء)6 ( الشكل 1A). من خلال تفاعل البروتينات الطعم وفريسة، تشجع تقسيم المجالات مراسل على ريفولد في بنية وظيفية، مما يتيح التفاعل بين الطعم وفريسة البروتينات إلى تصور أو كمياً. بيكاب تم تكييفها من نسخة من هذا الأسلوب الذي استخدم من الشظايا من البديل بروتينات فلورية خضراء فينوس. فحوصات البروتين الفلورسنت التكامل هي طريقة شائعة لتصور تفاعلات البروتين البروتين في خلية حية، ولكن حتى الآن كانت محدودة لهذا وظيفة واحدة7. بيكاب يمثل خطوة هامة إلى الأمام في هذا الصدد، كما أن هذا الأسلوب ليس فقط يسمح للتصور، ولكن أيضا العزلة والاستجواب للتفاعل البروتين البروتين الناتج.
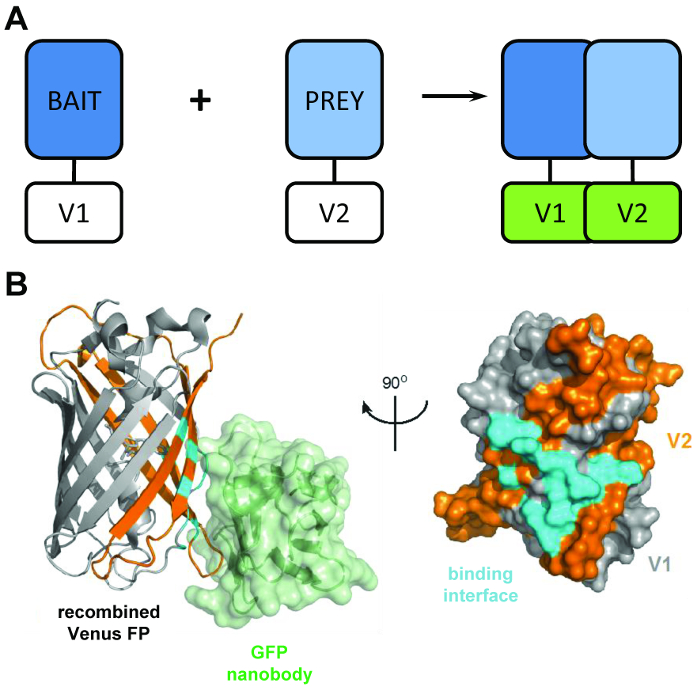
رقم 1: الرئيسية الهيكلية الكامنة وراء هذا الأسلوب بيكاب. (أ) تخطيطي توجز الرئيسي وراء إظهار التكامل bimolecular fluorescence البروتينات ‘الطعم’ و ‘فريسة’ المعلمة مع الطرفي ن V1 أو V2 ج-الطرفية أجزاء من البروتين فينوس كاملة الطول. (ب) التحليل الهيكلي (السماوي) واجهة التفاعل بين التجارة والنقل نانوبودي (الأخضر) ومعاد فينوس، وعرض موقف V1 (رمادي) والشظايا V2 (برتقالي) (PDB الانضمام 3OGO). وهذا الرقم هو إعادة نشر فرومكروتشير et al.3 Reprinted بإذن من AAAS. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
بيكاب أسلوب يجعل استخدام اثنين الشظايا غير الفلورية فينوس (المسمى V1 و V2) التي اقترانه بدرجة منخفضة من تقارب ما لم يحدث تفاعل بين شركائها الانصهار. وفي هذه الحالة، ريفولد المجالات تقسيم اثنين في الهيكل بيتا للبرميل الفنية فلوروفوري (الشكل 1B)6. الابتكار الرئيسي من بيكاب يأتي من الأخذ نانوبودي بروتينات فلورية خضراء المؤتلف، الذي يعترف حانمه ثلاثي الأبعاد على β-البرميل للتجارة والنقل (ومتغيرات مثل فينوس) التي فقط موجودة في فلوروفوري بشكل صحيح معاد ومطوية ( الشكل 1B)8. من الأهمية بمكان نانوبودي التجارة والنقل لا يرتبط أي من أجزاء الزهرة الفردية. وهذا يسهل عزل dimers البروتين فقط بعد البروتينات اثنين قد شكلت مجموعة معقدة من بمحض إرادتهم، مما يؤدي إلى نتائج أكثر تمثيلاً من تلك التي اكتسبت من الأساليب التي تجعل استخدام من التفاعلات التي يسببها كيميائيا، والقسري9.
بيكاب هو تقنية قوية أن يركز تحديداً على مجمعات البروتين المتعددة، التي يمكن أن يحتمل أن تكون جنبا إلى جنب مع عدد من التطبيقات المتلقين للمعلومات لتحسين مستوى فهمنا للدور الذي تلعبه هذه المجمعات في توصيل الإشارة . وهو يشمل أيضا ميزة هامة للسماح للتصور لتفاعلات البروتين في الموقع. وحتى الآن، أثبتت بيكاب كوسيلة فعالة لتحليل إينتيراكتومي من مستقبلات التيروزين كيناز (راديو وتلفزيون كوسوفو) dimers3، ولكن قدرة التكيف مع هذا الأسلوب يعني أن يتم اعتماده في سياق التفاعل البروتين تقريبا أي.
Protocol
Representative Results
Discussion
بيكاب وسيلة قوية لعزل dimers البروتين محددة مع استبعاد العناصر كل على حدة وعن الشركاء ملزمة المتنافسة3. بيكاب يستند على التكيف الأسفار المقايسة التكامل البروتين يسمى بيفك6. الأساليب القائمة، بما في ذلك فحوصات ربط بيفك وقربها، وقد استخدمت على نطاق واسع لوضع تصور وتح?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
D.R.C وهو “زميل نيو ساوث ويلز معهد السرطان” و D.N.S كان سابقا “زميل نيو ساوث ويلز معهد السرطان”. ومولت نتائج البحوث التي قدمت في هذه المخطوطة سرطان معهد نيو ساوث ويلز (13/فرل/1/02 و 09/الدفاع المدني/2-39)، NHMRC (المشروع منحة GNT1052963)، و “مؤسسة العلوم” أيرلندا (11/رائدا/B2157)، مكتب نيو ساوث ويلز للعلوم والبحوث الطبية، الأسرة ضيف مؤسسة الأسرة اللوردات والزمالات. J.F.H. ور. س. وكانت الجهات المتلقية “منح الدراسات العليا الأسترالية”.
Materials
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid – Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) – 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
References
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).

