איסוף ועיבוד של בלוטות הלימפה של חיות גדולות לניתוח RNA: הכנת ללימודי Transcriptomic הלימפה של מיני בעלי חיים גדולים
Summary
פרוטוקול זה מספק סקירה של נוהלי בידוד של RNA עבור פרופיל transcriptomic של הצומת לימפה רקמות חיות גדולות, כולל צעדים זיהוי, כריתה של בלוטות הלימפה של חיות המשק וחיות, דגימה גישות כדי לספק עקביות על-פני מספר בעלי חיים, שיקולים בתוספת תוצאות נציג פוסט אוסף שימור ועיבוד לניתוח RNA.
Abstract
חיות גדולות (הן חיות המשק וחיות) לשמש חשוב מאגרים של גורמי מחלה נגיפית, לרבות Brucella, חיידקי סטרפטקוקוס בוביס Mycobacterium, סלמונלהו- e. coli, והם שימושיים ללימוד פתוגנזה ו/או התפשטות החיידק ב hosts טבעי. כאשר פונקציית מפתח של בלוטות הלימפה בתגובה החיסונית המארח, רקמות לימפה לשמש מקור פוטנציאלי של RNA עבור ניתוחים transcriptomic במורד הזרם, כדי להעריך את השינויים הטמפורלי של ביטוי גנים בתאים במהלך זיהום. מאמר זה מציג סקירה של התהליך של הצומת לימפה אוסף דגימה רקמה, RNA במורד הזרם עיבוד במשק, באמצעות בקר (פרות, המטופחות) כמודל, עם דוגמאות נוספות מסופקים של ביזון אמריקאי (ביזון ביזון ). הפרוטוקול כולל מידע אודות מיקום, זיהוי, הסרה של בלוטות הלימפה מאתרים מרכזיים מרובים בגוף. בנוסף, מתודולוגיה דגימה ביופסיה מוצג המאפשר עקביות הדיגום מעבר בעלי חיים מרובים. מספר שיקולים לשימור הדגימה הנזכרים, כולל הדור של RNA מתאים מתודולוגיות במורד הזרם כמו רצפי RNA ו- RT-PCR. בשל עיכובים ממושכים הטמונה גדולים בעלי חיים לעומת העכבר פעם קורס לימודי, מוצגים תוצאות נציג ביזון ורקמות הלימפה שור כדי לתאר את מהלך הזמן השפלה בסוג זה רקמות, בהקשר של סקירה של עבודה מתודולוגי קודמות ב- RNA השפלה ברקמות אחרות. בסך הכל, פרוטוקול זה יהיה מועיל שני חוקרים וטרינרי מתחיל transcriptome פרויקטים על דגימות בעלי חיים גדולים, פיצחו המעוניינים ללמוד טכניקות ויוו רקמות דגימה ועיבוד במבחנה .
Introduction
ניתוח ה-RNA-רצף של transcriptome של בלוטות הלימפה מספק את ההזדמנות כדי לאפיין את התגובה החיסונית של חיות למגוון של פתוגנים. אמנם יש כבר מנוצל מתודולוגיה זו בהרחבה בעכברים, ניתוח הרחבת לאחרונה לתוך יונקים גדולים1,2. משק חי/גדולים בעלי חיים בלוטות הלימפה יכול לשמש כדי לאפיין תגובות המארח, זיהום, לא רק לשימוש שלהם חיסון או רגישות גנטית מחקרים, לצורך זיהוי מטרות עבור פיתוח התרופה, אלא גם דגם מערכות עבור מחקרים בבני אדם על מחלות שפוגעות. לדוגמה, במקרה של ברוצלוזיס (מחלה חיידקית שפוגעות כי ההשפעות חצי מיליון אנשים ברחבי העולם בכל שנה), למרות גדל באופן משמעותי בעלויות, לימודי כבשים או עיזים שהן יותר רלוונטיות הדבקת בני אדם, החיסון האנושית פיתוח מודלים חיות מעבדה. העכבר זיהום מודלים מסכם את הדברים הזיהום מערכת reticuloendothelial אבל לא את הסימנים הקליניים האופייניים3.
בניסויים בבעלי חיים גדולים לעומת מעבדה מחקרים שנעשו בבעלי חיים, התהליך של רקמות קציר בהכרח כרוך עיכוב ארוך יותר בין המתת החסד ואת האוסף רקמות, אשר מהווה אתגר פוטנציאל לשימור RNA באיכות גבוהה. RNA תקין חיוני לדור של נתונים transcriptomic רלוונטי מבחינה ביולוגית. הדור של RNA באיכות גבוהה של דגימות רקמה קריטי במיוחד ללימודי הפתוגן בעלי חיים גדולים מתבצע תוך מתקני כליאה. מחקרים כאלה הם מטבעם יותר קשה לבצע כפי שהם דורשים אישרה מתקנים, מאומנים כוח אדם אלא גם לשאת משמעותי בעלות הכספית, אשר, בהתאם לעבודה, יכול לנוע בין עשרות למאות אלפי דולרים. סוגי מחקרים אלה כרוכים גם שיתוף פעולה בין-תחומית והידע רב-תחומי להשלמת שלהם, הוספת את המורכבות שלהם. לכן, הדרכה, התפתחות, ואת הדבקות מערכת יעילה של המדגם אוסף שימור מספק יתרונות משמעותיים במחקרים מולקולריים במורד הזרם של רקמות של חיות נגועות.
האוסף של בלוטות הלימפה גדול מציג אתגרים נוספים עבור אוסף רקמה לעומת דגימה דומה מאתר בלוטות הלימפה. ההכנה הכריתה מדגם מחייבת הבנה בסיסית של האנטומיה של הצומת לימפה, לרבות המבנים הפנימיים הרלוונטיים. המבנה של הלימפה מורכבת של האוניות הלימפה מוקף הסינוסים מלא הלימפה. מבנים אלה מוקפים בתוך כמוסה קשה, סיביים. 4 lobule הלימפה “אנטומי פונקציונלי היחידה הבסיסית של הצומת לימפה”, מורכב זקיקי, יחידת עמוק בקליפת המוח, ואת מיתרי מדולרי הסינוסים4 (איור 1 א’). B ו- T לימפוציטים הם ביתו זקיקי ויחידות עמוק בקליפת המוח, בהתאמה. מבנים אלה מספקים לפיגום תלת-ממד, להקל על האינטראקציה בין לימפוציטים וגם אנטיגן או אנטיגן הצגת תאים.
רווחתה, זקיקי ויחידות עמוק בקליפת המוח ניתן לזהות במשטח לחתוך כפי שהם מכילים meshwork רשתי צפופה מופיעים יותר הסינוסים, המורכב מעובדים meshwork רשתי עדין יותר ואשר נראה בהיר יותר כהה (איור 1B). לפי המוסכמות, פתולוגים להפנות האזורים של בלוטות הלימפה כמו קליפת שטחית (זקיקים), את paracortex (יחידות עמוק בקליפת המוח) לשד (מיתרי מדולרי, הסינוסים). בדיקה נכונה של כל שלושה אזורים שסברו הטובה ביותר תרגול בהנחיות שגרתית פתולוגיים הלימפה5. שימו לב כי יש וריאציה ניכר עקביות, גודל וצבע של בלוטות הלימפה, אפילו בתוך חיים בודד. כמו בעלי חיים גיל, בלוטות הלימפה שלהם נוטים להקטין את גודל להיות מוצק יותר מאלה של חיים צעירים, בדרך כלל עקב גידול רקמות החיבור שלהם וירידה רגיל הלימפה מבנה6,7.
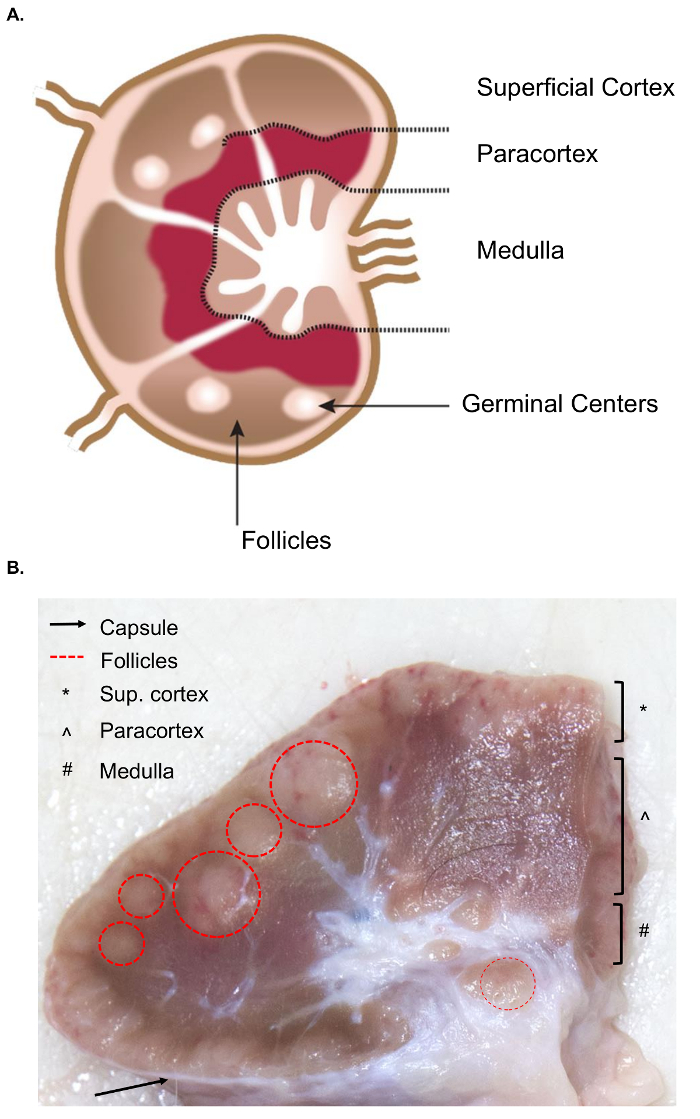
איור 1. אנטומיה של הצומת לימפה. (א) תמונה קריקטורה זו מראה את האנטומיה של הצומת לימפה, המתארים מבנים מרכזיים. (B) תמונה זו עדיין מציגה לימפה שור חותכים חתך הרוחב. המבנים/השכבות הרלוונטיות הגלויים לעין מודגשים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
בהתאם השאלה ניסיוני, הלימפה שונים יהיה עניין עבור איסוף וניתוח. בלוטות הלימפה ההיקפית הם אלה נמצא עמוק בתוך הרקמה התת עורית. הבקר, בלוטות הלימפה היקפי או שטחי משמש לעתים קרובות באימון קליניים וניסויים לכלול הפרוטיד, submandibular, retropharyngeal, prescapular, prefemoral (precrural), שטחי במפשעה (supramammary אצל נקבות, האשכים אצל זכרים) ( איור 2). טבלה 1, מאפייני מפתח בלוטות הלימפה שטחית, כמתואר ב- במערכת ‘ בקר ‘8, מתוארים. להלן, כמה תוכניות אוסף הצומת לימפה פוטנציאל למחלות זיהומיות חיידקים של הבקר מוצגים כנקודת התחלה עבור החקירה.
Melitensis abortus/Brucella brucella: תקן necropsies עבור abortus דרב-נגוע בקר ו melitensis דרב-עזים נגוע במרכז הלאומי חיה המחלה לשחזר supramammary, prescapular, רקמות parotid בלוטת לימפה , הן של שיוף שהספירה חיידקי ועל ההכנה RNA פרופיל ביטוי מארח ה-RNA. Abortus דרב ניתן לשחזר באופן קבוע בכל אחד מאותם בלוטות הלימפה בקר נגוע השפעול9. הנוכחות של חיידקים בכל אחד מסוגי הלימפה ניתן להבחין ב- melitensisבנגוע עזים עד לפחות תשעה חודשים לאחר הפגיעה באמצעות למתודולוגיות מבוססי ה-RNA ממחקרים שלנו (Boggiatto. et al., לא פורסם). סלמונלה sp.: prescapular, subiliac (prefemoral), ואת בלוטות לימפה mesenteric היו שימושיים במהלך יצירת פרופילים של פגרי הבקר סלמונלה השכיחות10,11,12 , יהיה עניין פוטנציאלי ללימודי transcriptomic. E. coli O157:H7: בלוטות לימפה mesenteric (-המעי הדק האמצעית והמיקומים המעי הדק הדיסטלי) יכול להיות האתרים של שחזור של פה ושם של חיידקים עגלים הנגוע (אך לא נגוע הבקר מבוגרים)13. לפטוספירוזיס (Leptospira sp.): התמדה כרונית של החיידקים נצפתה בקשרי הלימפה ניקוז בלוטת חלב14. Mycobacterium חיידקי סטרפטקוקוס בוביס : בבקר, החיידק כבר התאושש זיהום שלאחר ניסיוני של בלוטות הלימפה mediastinal, tracheobronchial של עגלים15. בנוסף, הצומת לימפה RNA יש כבר מנוצל כדי לבחון תגובות לארח בעלי חיים גדולים וירוסים, כגון וירוס חזירי תסמונת הרבייה, מערכת הנשימה2. איור 2 מציג את המיקום של קבוצת משנה של אלה הלימפה העיקרי בגוף הבקר.
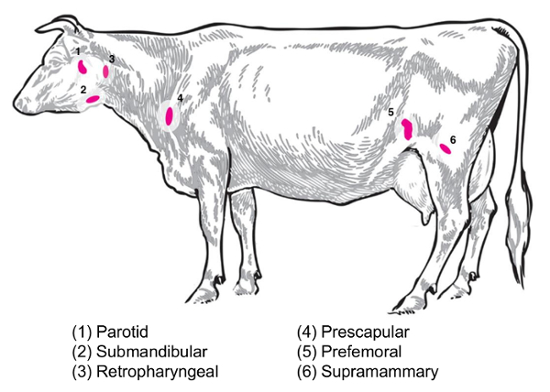
איור 2: קריקטורה המתארים במיקומים שנבחרו הלימפה בבית השחי הצומת פרות, המטופחות . בלוטות הלימפה ממוספרת הם מבואר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
נייר זה ווידאו משויך, אנו מציגים פרוטוקול עבור הבידוד של גדול הלימפה חיה ללימודים RNA, תוכנן להיות אינפורמטיבי עבור פיצחו המעורבים במחקרים transcriptomic של זיהומים בעלי חיים גדולים. ראשית, אנו מספקים סקירה של ההליך בידוד בלוטות הלימפה, באמצעות דגימת רקמות שור, ביזון כדוגמאות. מזווג עם ההדגמה, כפי שהוא מוצג בסרט, הוא זרימת עבודה עבור דגימה רקמה לשחזור לבידוד RNA. בשלב הבא, אנו מתארים שיקולים חשובים עיבוד של הצומת לימפה נגועות, עם דגש על בטיחות, עקביות ואיכות RNA.
הכנת RNA מתוך הרקמה עם ריאגנט isothiocyanate פנול acidified-guanidine מבוסס על השיטה המקורית של Chomczynski וסאקי16,17, בטהרה על-מבוססות-סיליקה ספין עמודות רכוש סוכני chaotropic בהתבסס על העבודה המקורית של Vogelstein ו גילספי18. אנו בוחנים גם את הפוטנציאל ההתאוששות של RNA עבור transcriptomics מן הבקר הלימפה שנשמרו על-ידי שיטות אלטרנטיביות. לבסוף, אנו חוקרים את ההשפעה של המשתנה פעם על איכות ה-RNA ב necropsies בעלי חיים גדולים, כולל ניסוי נציג המתארים את ההשפעה של עלייה זמן בין המתת החסד הדגימה על הפרופיל RNA התאושש מן ביזון, . בלוטות לימפה שור מאמר זה יהיה מועיל לא רק פיצחו אלא גם ל וטרינרי חוקרים מתחיל transcriptomic מחקרים.
Protocol
Representative Results
Discussion
הרוב המכריע של מחקרים transcriptomic והפרוטוקולים המשויכים מתמקדים עכבר, חולדה או פוסט-מורטם דגימות אנושי. עם זאת, חקירות חיות המשק וחיות מספקים מגוון רחב של הזדמנויות עבור האפיון של התגובה החיסונית מחלה, הן לפי הצורך רפואה וטרינרית ו, לגבי מחלות שפוגעות, לבריאות הציבור האדם. פרוטוקול זה סיפק מית…
Divulgations
The authors have nothing to disclose.
Acknowledgements
המחברים רוצה להודות פוסי ג’יימס על עבודתו מעולה על כל צילום וידאו ועיבוד וידאו; מייקל מרטי עבור עבודתו מעולה דור של בקר דיגיטלי תמונות; ליליה וולתר עזרה עם החילוץ-RNA ו- Bioanalyzer פועל; מיטש פאלמר, קארלי Kanipe סקירה מועילה, משוב על הצומת לימפה תמונות; טיפול בבעלי חיים ואת צוות וטרינרי המרכז הלאומי למחלות בעלי חיים על כל העבודה הקשה שלהם, סיוע עם גידול בעלי חיים והכנה necropsies.
Materials
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
References
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).

