コレクションと RNA 解析のための大型動物からリンパ節の処理: リンパ節トランスクリプトーム研究大型動物種のための準備
Summary
このプロトコルは、大型動物の同定と家畜、野生動物、アプローチをサンプリングからリンパ節の切除の手順を含むリンパ節組織のトランスクリプトームのプロファイルの RNA の隔離のための手順の概要を提供します回収後保存と RNA 解析の処理のため、複数の動物と考慮事項プラス代表の結果に一貫性を提供します。
Abstract
大動物 (家畜と野生動物の両方)ブルセラ、ウシ結核菌、サルモネラ菌、大腸菌を含む、人獣共通感染病原体の重要な貯水池として、機序の解明に便利です/または自然宿主の細菌の広がり。宿主の免疫応答におけるリンパ節のキー機能により、リンパ節組織は感染の過程で細胞における遺伝子発現の変化を評価するために下流のトランスクリプトーム解析のための RNA の潜在的なソースとして機能します。本稿ではリンパ節のコレクション、組織サンプリング、および下流の RNA、家畜処理モデルとしてウシ (Bos のトーラス) を用いた (バイソン バイソンのバイソンから提供されるその他の例のプロセスの概要).プロトコルには体内場所、識別、および複数の主要サイトからリンパ節の除去に関する情報が含まれます。また、生検の方法論が表示によりサンプリングの一貫性を保つのため、複数の動物の間でされます。RNA シーケンスと RT-PCR のような下流の手法に適した RNA の生成を含む、サンプル保存に関するいくつかの考慮事項を説明します。大動物対マウス時間コース研究に固有の長時間の遅延によりバイソンおよび牛リンパ節組織からの代表的な結果を表示してのレビューのコンテキストでこの組織型の劣化の経過を記述するには他の組織の RNA の分解の前の方法論的仕事。全体的に、このプロトコルは両方獣医研究者の大きな動物試料のトランスクリプトーム プロジェクトを開始し、分子生物学者組織サンプリング体内及び体外処理テクニックを学習に興味があるに役に立つでしょう。
Introduction
リンパ節のトランスクリプトームの RNA シーケンス解析は、様々 な病原体に動物の免疫応答を特徴付けるため機会を提供します。この方法は、マウスで広く利用されている、しながら解析最近大きい哺乳類1,2に拡大しています。ワクチンや遺伝的感受性の研究での使用、医薬品開発、人間の研究のモデル系としてもターゲットの同定だけでなく、感染する宿主反応を特徴付ける家畜・大型動物リンパ節を使用できます。人獣共通感染症。たとえば、ブルセラ症 (人畜共通細菌性疾患、影響 50万の人々 世界中毎年)、場合にもかかわらず大幅コスト、羊の研究の増加やヤギ、ヒトへの感染とワクチンに関連します。動物実験よりも開発。マウス感染モデル要約細網内皮のシステム感染がないの特徴的な臨床症状3.
実験動物学と比較して大規模な動物実験、必ずしも収穫組織のプロセスは、安楽死と保全の課題と潜在的な組織のコレクションとの間の遅延が長くなります高品質の RNA。そのまま RNA は生物学的に関連するトランスクリプトーム データの生成に不可欠です。組織サンプルからの高品質の RNA の生成は特に大きな動物病原体研究の重要で実施封じ込め設備。このような研究は施設を承認、高度訓練を受けた技術者を必要とするだけでなく、また、これは、作業に応じて、数百数千ドルの数十から範囲することができます重要な金融費用を運ぶように本質的により困難です。この種の研究は、分野横断的なコラボレーションと、完了すると、その複雑さに追加するための横断的知識もあります。したがって、トレーニングの開発とサンプル収集・保存のための合理化されたシステムへの付着大きなメリットをもたらします組織の下流の分子研究のため感染している動物から。
大きなリンパ節のコレクションは、マウスのリンパ節のようなサンプリングと比較して組織コレクションの追加課題を提示します。サンプルの切除のための準備は、関連する内部構造を含むリンパ節の解剖学の基本的な理解を必要とします。リンパ節の構造は、満ちているリンパ洞に囲まれたリンパ性小葉で構成されます。これらの構造は、堅い、繊維状のカプセルに含まれています。4リンパ性小葉は、「基本的な解剖学的および機能的な単位リンパ節」包、皮質深部ユニットと髄コードと副鼻腔4 (図 1 a) で構成されます。B および T リンパ球は、それぞれ卵胞と皮質深部の単位に家します。これらの構造は、3 D 足場を提供し、リンパ球と抗原抗原提示細胞の相互作用を容易にします。
肉眼的に, 卵胞と皮質深部単位上識別できること切断面と高密度細網の網目を含む副鼻腔はより繊細な細網網目から成るし、ライターが表示よりも暗く見えます (図 1 b)。慣例では、病理学者は浅野 (包), (皮質深部単位) 皮質髄質 (髄コードや副鼻腔) とリンパ節の領域を参照してください。すべての 3 つの地域の適切な検査はルーチン検査、病理組織学的リンパ節5指針の実践として最高と判断がされています。一貫性、サイズ、および 1 つの動物の中でも、リンパ節の色でかなり変動があることに注意してください。動物の年齢、サイズが小さくなり、若い動物のものより硬くなり、通常構造の結合組織と正常リンパ球の減少の増加のための6,7がちで、リンパ節。
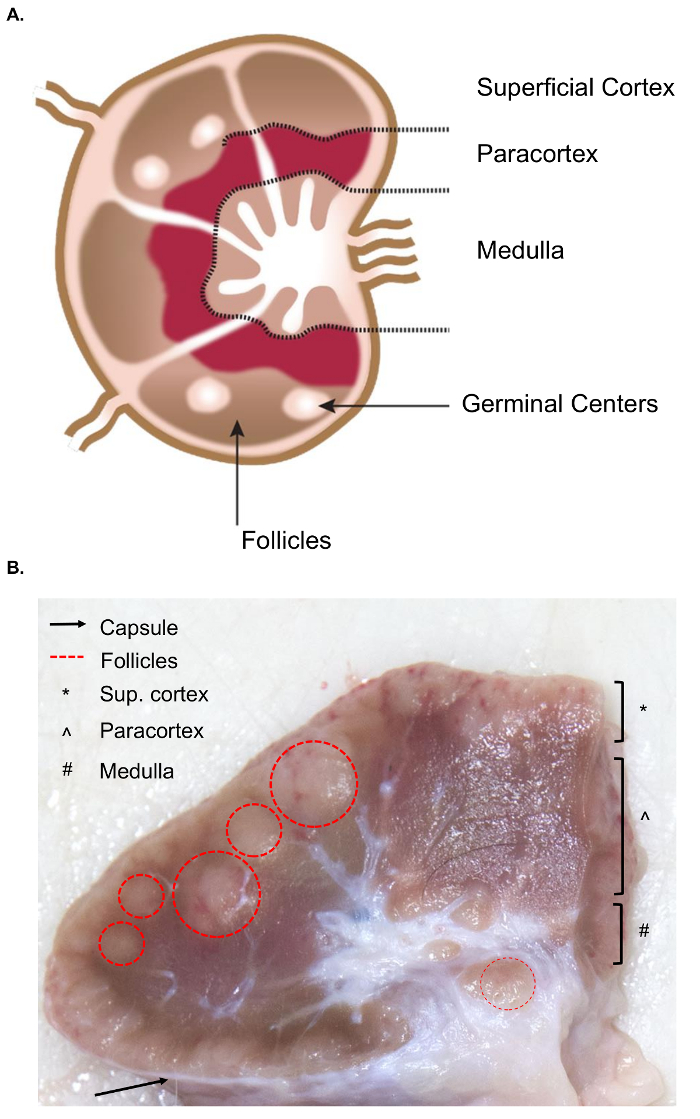
図 1.リンパ節の解剖学。(A) この漫画のイメージは、キー構造を描いたリンパ節の構造を示します。(B) この画像は、断面カット牛リンパ節を示しています。関連する構造/レイヤーは肉眼に目に見えるが強調表示されます。この図の拡大版を表示するのにはここをクリックしてください。
実験的質問によって収集および分析のための興味の別のリンパ節になります。末梢のリンパ節は、皮下の組織に深くあります。牛は臨床的および実験的練習でよく使用されます周辺機器または表在性のリンパ節、耳下腺、顎下腺、咽頭、prescapular、prefemoral (precrural) と浅鼠径 (女性、男性の陰嚢に supramammary) (図 2)。テーブル 1、キーの表在リンパ節のプロパティ牛のシステム8に示すとおりです。以下、牛の伝染性の細菌性疾患のいくつかの潜在的なリンパ節のコレクションの計画が、調査の出発点として掲載されています。
ブルセラ abortus/ブルセラ melitensis:菌の標準 necropsies-感染牛およびB. melitensis-国立動物病センターで感染した山羊 supramammary、prescapular、耳下腺リンパ節組織を回復、研磨細菌の列挙とホスト RNA 発現プロファイリングのための RNA の準備のための両方。実験感染牛9.でこれらのリンパ節のそれぞれで菌を定期的にリカバリできます。B. melitensisでこれらのリンパ節の種類ごとの細菌の存在を検出できる-私たちの研究 (Boggiattoら、未発表) から RNA ベースの方法を使用して、少なくとも 9 ヶ月後感染までヤギを感染しています。サルモネラsp: prescapular、subiliac (prefemoral)、腸間膜リンパ節は、プロファイリングのサルモネラの有病率10、11,12の家畜の死骸の中に有用されていると、トランスクリプトーム研究の潜在的な利益のでしょう。エシェリヒア属大腸菌 o157: h7: (中間の小腸と遠位側小腸場所) で腸間膜のリンパ節が細菌感染牛 (ただし感染の成牛ではなく)13の時折回復のサイトをすることができます。レプトスピラ症 (レプトスピラ sp.): 乳腺14リンパ節で細菌の慢性持続性が観察されています。ウシ結核菌: 細菌は牛、子牛15縦隔や気管気管支リンパ節から回復した後実験感染をされています。さらに、リンパ節の RNA はウイルス、豚繁殖・呼吸障害症候群ウイルス2のように大きな動物宿主反応を調べるため利用されています。図 2は、牛の体のこれらの主要なリンパ節のサブセットの場所を示しています。
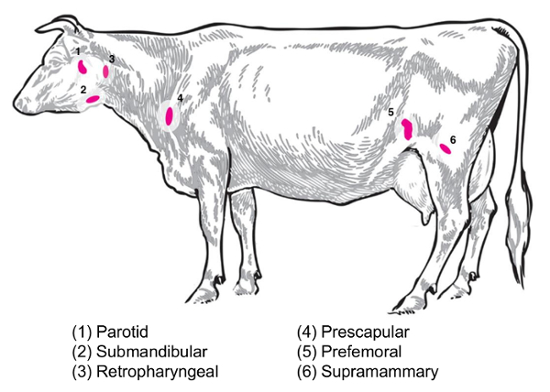
図 2:漫画で描いた内の選択したリンパ節の場所オオツノウシ. リンパ節の番号が付きます。この図の拡大版を表示するのにはここをクリックしてください。
本稿および関連のビデオ、大型動物感染症のトランスクリプトーム研究に関与する分子生物学者のために有益であること、RNA 研究の大きな動物リンパ節の隔離のためのプロトコルを提案する.まず、我々 はリンパ節の例として牛、バイソンの組織からのサンプリングを使用して分離のプロシージャの概要を示します。ビデオに表示されるのこのデモでは、ペアになって、RNA の隔離のための再現可能な組織採取のワークフローです。次に、我々 は安全性、一貫性、および RNA の品質重視で、感染したリンパ節の処理のための重要な考慮事項をについて説明します。
酸性フェノール グアニジン イソチオ シアン酸性試薬による組織からの RNA の準備は、元 Chomczynski とサッキ16,17の存在下でのシリカ系スピン列浄化法に基づいてください。カオトロ Vogelstein、ガレスピーの18の原作に基づきます。トランスクリプトミクスの代替方式と保存牛リンパ節からのリカバリーの可能性も検討します。最後に、私たちは安楽死とバイソンから回復された RNA プロファイルのサンプリング時間の増加の影響を描いた代表的な実験を含む大規模な動物の魚で RNA の品質の時間変数の影響を探索し、牛のリンパ節。この記事は分子生物トランスクリプトーム研究を開始また、獣医学の研究にだけ役に立つでしょう。
Protocol
Representative Results
Discussion
トランスクリプトーム研究と関連プロトコルの大部分はマウス、ラット、または事後ひと試料に焦点を当てます。しかし、家畜や野生動物の調査は人間の公衆衛生獣医・人獣共通感染症については必要に応じて、両方の病気に免疫応答の評価の機会の広い範囲を提供します。このプロトコルは、牛、バイソン、ヤギ、羊などの大型動物から組織から整合性の高い RNA 抽出の重要な考慮事項の?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
著者はすべてのビデオ撮影とビデオ処理; 彼の素晴らしい仕事のためジェームズ ・ フォッシーを感謝したいです。デジタル化された牛のイメージの生成の彼の素晴らしい仕事のためのマイケル ・ マルティRNA の抽出と彼女の助けのリリア ヴァルターとバイオアナライザーの実行;ミッチ パーマーと彼らの役に立つレビューとリンパ節の画像上のフィードバックのカーリー Kanipe動物の世話とすべての彼らのハードワークと畜産の支援のための国立動物病センターで魚のための準備の獣医のスタッフ。
Materials
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
References
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).

