Erhebung und Verarbeitung von Lymphknoten von großen Tieren für RNA-Analyse: Vorbereitung auf Lymphknoten Transkriptomischen Studien der großen Tierarten
Summary
Dieses Protokoll bietet einen Überblick über Verfahren zur Isolierung von RNA für die transkriptomischen Profilierung der Lymphknoten Gewebe von großen Tieren, einschließlich Schritte bei der Identifizierung und Entfernung der Lymphknoten von Vieh und Wildtiere, Probenahme Ansätze Konsistenz über mehrere Tiere, und Überlegungen sowie repräsentative Ergebnisse für die Post-Sammlung, Erhaltung und Verarbeitung für RNA-Analyse zu schaffen.
Abstract
Große Tiere (Vieh und Wildtiere) dienen als wichtiges Reservoir von Zoonoseerregern, einschließlich Brucella, Mycobacterium Bovis, Salmonellenund Escherichia Coli, und eignen sich für die Untersuchung der Pathogenese und/oder Ausbreitung der Bakterien in natürlichen Wirte. Mit der wichtigen Funktion der Lymphknoten in der Host-Immunantwort dienen Lymphknoten Gewebe als eine potentielle Quelle von RNA für nachgeschaltete transkriptomischen Analysen, um die zeitlichen Veränderungen in der Genexpression in Zellen im Verlauf einer Infektion zu bewerten. Dieser Artikel bietet eine Übersicht über den Prozess der Lymphknoten Sammlung, Gewebe-Sampling und nachgelagerten RNA Verarbeitung in Vieh, weitere Beispiele zur Verfügung gestellt von der amerikanischen Bison (Bison Bison Rind (Bos Taurus) als ein Modell mit ). Das Protokoll enthält Informationen über die Lage, Ermittlung und Entfernung der Lymphknoten aus mehreren wichtigen Standorten im Körper. Darüber hinaus wird eine Biopsie Sampling-Methode vorgestellt, die für eine Konsistenz der Probenahme über mehrere Tiere ermöglicht. Einige Überlegungen zur Probe Erhaltung werden diskutiert, einschließlich der Erzeugung von RNA geeignet für nachgeschaltete Methoden wie RNA-Sequenzierung und RT-PCR. Aufgrund der langen Verzögerungen große Tier vs. Maus Zeitstudien Kurs innewohnt sind repräsentative Ergebnisse von Bisons und Rinder Lymphknoten Gewebe präsentiert um zu beschreiben, den zeitlichen Verlauf der Abbau in diesem Gewebetyp, im Rahmen einer Überprüfung der methodische Vorarbeiten auf RNA-Abbau in anderen Geweben. Insgesamt wird dieses Protokoll sinnvoll, beide tierärztliche Forscher Anfang Transkriptom Projekte auf große Tiere Proben und Molekularbiologen Lerntechniken für in Vivo Gewebe-Probeentnahme und in-vitro- Verarbeitung interessiert sein.
Introduction
RNA-Sequenzierung Analyse des transkriptoms Lymphknoten bietet die Möglichkeit, die Immunantwort von Tieren zu einer Vielzahl von Krankheitserregern zu charakterisieren. Während diese Methode bei Mäusen ausgiebig genutzt wurden, haben vor kurzem Analysen in größeren Säugetiere1,2ausgebaut. Vieh/großes Tier Lymphknoten kann verwendet werden, um Host Reaktion auf eine Infektion, nicht nur für den Gebrauch im Impfstoff oder genetische Anfälligkeit Studien und für die Identifizierung von Zielen für die Entwicklung von Medikamenten, sondern auch als Modellsysteme für Studien am Menschen zu charakterisieren über Zoonosen. Zum Beispiel im Falle von Brucellose (eine bakterielle Zoonose, dass Auswirkungen eine halbe Million auf der ganzen Welt jedes Jahr Menschen), trotz deutlich erhöhte Kosten, Studien bei Schafen oder Ziegen sind relevanter für die Infektion beim Menschen und menschliche Impfstoff Entwicklung als Labor Tiermodelle. Maus Infektionsmodelle rekapitulieren die retikuloendothelialen System Infektion aber nicht die charakteristischen klinischen Symptome3.
Im großen Tierversuch im Vergleich zu tierischen Laborstudien umfasst den Prozess des Gewebes Ernte unbedingt eine längere Verzögerung zwischen der Euthanasie und die Gewebe-Kollektion, die eine mögliche für die Erhaltung der Herausforderung qualitativ hochwertige RNA. Intakte RNA ist essentiell für die Generation der biologisch relevanten transkriptomischen Daten. Die Erzeugung von qualitativ hochwertigen RNA aus Gewebeproben erfolgt im Containment Einrichtungen für große Tiere Pathogen Studien besonders kritisch. Solche Studien sind von Natur aus schwieriger durchzuführen, da sie nicht nur genehmigte Anlagen und hoch qualifiziertes Personal erfordern aber auch erhebliche finanzielle Kosten, die abhängig von der Arbeit von Dutzende bis Hunderte von Tausenden von Dollar reichen können. Diese Arten von Studien beinhalten auch eine interdisziplinäre Zusammenarbeit und fachübergreifende Kenntnisse für ihren Abschluss, ihre Komplexität hinzufügen. Daher bietet Ausbildung auf, Entwicklung und Einhaltung ein optimiertes System für die Entnahme von Proben und Erhaltung erhebliche Vorteile für nachgeschaltete molekulare Untersuchungen von Geweben von infizierten Tieren.
Die Sammlung von größeren Lymphknoten präsentiert zusätzliche Herausforderungen für die Gewebe-Sammlung im Vergleich zu ähnlichen Probenahme von murinen Lymphknoten. Die Vorbereitung auf die Probe-Exzision erfordert ein grundlegendes Verständnis der Anatomie des Lymphknotens, einschließlich der relevanten internen Strukturen. Die Struktur eines Lymphknotens besteht aus lymphoiden Läppchen umgeben von Nebenhöhlen mit Lymphe gefüllt. Diese Strukturen sind in eine zähe, fibröse Kapsel eingeschlossen. 4 eine lymphoide Lobule ist die “grundlegende anatomische und funktionelle Einheit des Lymphknotens” und besteht aus Follikel, eine tief kortikale Einheit und medulläre Schnüre und Nebenhöhlen4 (Abbildung 1A). B- und T-Lymphozyten sind Heimat der Follikel und tiefen kortikalen Einheiten. Diese Strukturen bieten eine 3D Gerüst und der Interaktion zwischen Lymphozyten und Antigen oder antigenpräsentierende Zellen.
Grob, Follikel und tiefen kortikalen Einheiten identifiziert werden können auf Schnittfläche als sie eine dichtere netzartige Geflecht enthalten und dunkler als die Nebenhöhlen, die bestehen aus einem zarteren netzartige Geflecht und heller erscheinen (Abbildung 1 b). Gemäß der Konvention beziehen sich Pathologen auf die Regionen der Lymphknoten als oberflächliche Kortex (Follikel), Parakortex (tief kortikalen Einheiten) und der Medulla (medulläre Schnüre und Nebenhöhlen). Eine ordnungsgemäße Untersuchung aller drei Regionen wurde als beste Praxis in Routine pathologischen Untersuchung Leitlinien für Lymphknoten5angesehen. Beachten Sie, dass es erhebliche Unterschiede in der Konsistenz, Größe und Farbe der Lymphknoten, auch innerhalb eines einzelnen Tieres. Zunehmendem Alter der Tiere ihre Lymphknoten wird tendenziell kleiner und werden fester als bei jüngeren Tieren, in der Regel auf eine Erhöhung ihrer Bindegewebe und eine Verminderung der normalen lymphatischen Struktur6,7.
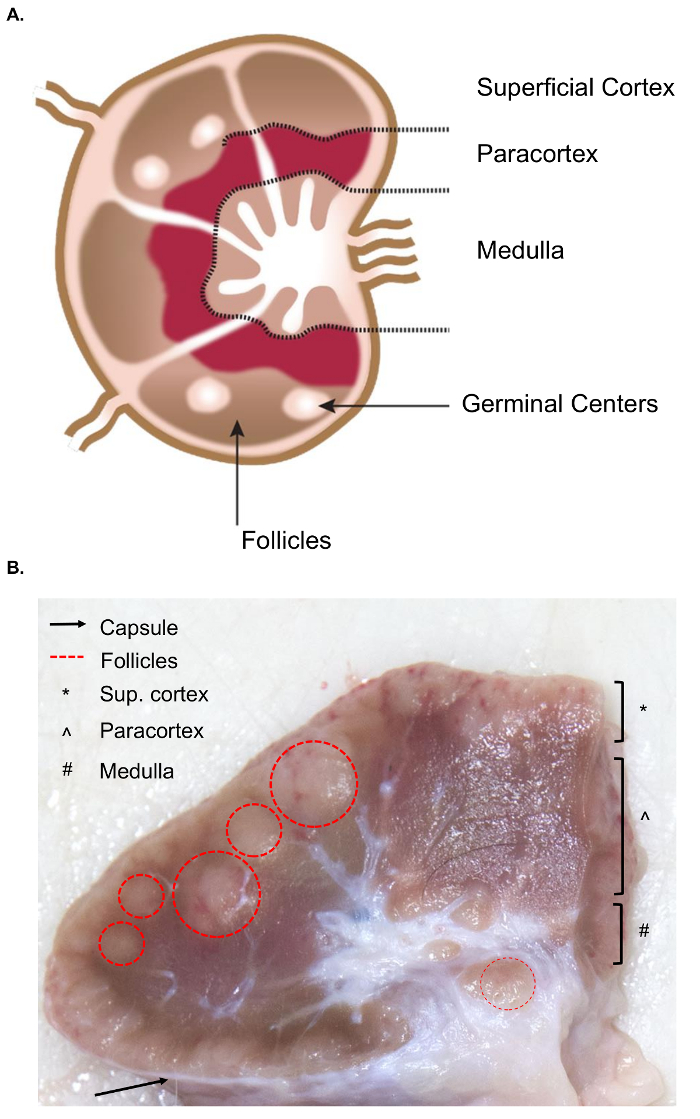
Abbildung 1. Anatomie des Lymphknotens. (A) Diese Karikatur zeigt die Anatomie des Lymphknotens, Schlüsselstrukturen darstellt. (B) dieses noch Bild zeigt einen bovinen Lymphknoten schneiden im Querschnitt. Die relevanten Strukturen/Layer, die mit dem bloßen Auge sichtbar sind, werden hervorgehoben. Bitte klicken Sie hier für eine größere Version dieser Figur.
Abhängig von der experimentellen Frage wird verschiedenen Lymphknoten für die Erhebung und Analyse von Interesse sein. Peripheren Lymphknoten sind diejenigen befindet sich tief im subkutanen Gewebe. Bei Rindern, periphere oder oberflächlichen Lymphknoten oft verwendet in der klinischen und experimentellen Praxis umfassen Parotis, mandibulären, retropharyngeal, prescapular, Thymus (precrural) und oberflächlichen inguinalen (Supramammary bei Frauen, bei Männern scrotal) () ( Abbildung 2). In Tabelle 1sind die Eigenschaften der wichtigsten oberflächlichen Lymphknoten, wie beschrieben in die Rinder System8beschrieben. Im folgenden sind einige mögliche Lymphknoten Sammlung Pläne für bakterielle Infektionskrankheiten von Rindern als Ausgangspunkt für die Untersuchung vorgestellt.
Brucella Abortus/Brucella Melitensis: Standard necropsies für B. Abortus-infizierten Rindern und B. Melitensis-infizierten Ziegen am National Animal Disease Center zu erholen, Supramammary, Prescapular und Parotis Lymphknoten Gewebe , sowohl für das Schleifen für die bakterielle Enumeration und für die RNA-Vorbereitung für den Host RNA Ausdruck profilieren. B. Abortus zurückgewonnen werden regelmäßig in jedem der diese Lymphknoten in experimentell infizierten Rindern9. Das Vorhandensein von Bakterien in jedem solcher Lymphknoten nachweisbar in B. Melitensis-infiziert Ziegen bis zu mindestens neun Monate nach der Infektion mit der RNA-basierten Methoden aus unseren Studien (Boggiatto Et Al., unveröffentlicht). Salmonellen SP.: Prescapular, subiliac (Thymus), mesenterialen Lymphknoten nützlich erwiesen haben, während die Profilierung der Rinder Kadaver Salmonellen Prävalenz10,11,12 und wäre von Interesse für transkriptomischen Studien. E. Coli O157: H7: mesenterialen Lymphknoten (in den mittleren Dünndarm und distalen Dünndarm Standorten) sind die Niederlassungen einer gelegentlichen Erholung der Bakterien im infizierten Kälbern (aber nicht bei infizierten Erwachsenen Rindern)13. Leptospirose (Leptospira SP.): eine chronische Persistenz der Bakterien in den Lymphknoten Entwässerung der Brustdrüse14beobachtet worden. Mycobacterium bovis : Bei Rindern wurden die Bakterien wieder Post-experimentelle Infektion von mediastinalen und tracheobronchialer Lymphknoten Kälber15. Darüber hinaus ist Lymphknoten RNA verwendet worden, um große Tier Host Reaktionen auf Viren, wie die Schweine reproduktive und respiratorische Syndrom Virus2zu untersuchen. Abbildung 2 zeigt den Speicherort der eine Teilmenge von diesen großen Lymphknoten im Körper Rinder.
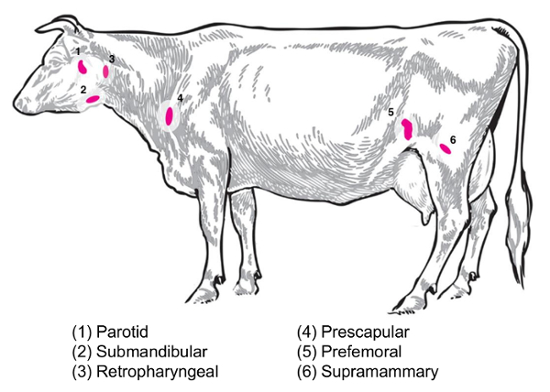
Abbildung 2: Cartoon Darstellung ausgewählter Lymphknoten Standorte in Bos taurus . Die nummerierten Lymphknoten sind kommentiert. Bitte klicken Sie hier für eine größere Version dieser Figur.
In diesem Papier und das zugehörige Video präsentieren wir ein Protokoll für die Isolierung von großen Tieren Lymphknoten für RNA-Studien, soll informativ für Molekularbiologen transkriptomischen Studien von großen Tieren Infektionen beteiligt sein. Erstens bieten wir einen Überblick über die Isolierung-Verfahren für die Lymphknoten mit Probenahme von Rindern und Bisons Gewebe als Beispiele. Gepaart mit dieser Demo, wie im Video dargestellt, ist ein Workflow für eine reproduzierbare Gewebe Probenahme zur RNA-Isolierung. Anschließend beschreiben wir wichtige Überlegungen für die Verarbeitung eines infizierten Lymphknotens mit Fokus auf Sicherheit, Beständigkeit und RNS-Qualität.
Die Vorbereitung der RNA aus dem Gewebe mit einem versauerten Phenol-Guanidin erfolgt Reagenz basiert auf der Originalmethode von Chomczynski und Sacchi16,17, mit einer Reinigung über Silica-basierten Spin Spalten in Anwesenheit von chaotropen Agenten basierend auf der ursprünglichen Arbeit von Vogelstein und Gillespie18. Wir untersuchen auch das Potenzial für die Verwertung von RNA für Transkriptom von Rindern Lymphknoten durch alternative Methoden haltbar gemacht. Schließlich beschäftigen wir die Auswirkungen der Zeitvariablen RNS-Qualität in großen Tier Autopsien, einschließlich eine repräsentativere Experiment Darstellung der Wirkung einer Erhöhung in der Zeit zwischen der Euthanasie und die Probenahme auf dem wiederhergestellten RNA-Profil von Bison und Bovine Lymphknoten. Dieser Artikel wird nicht nur Molekulare Biologen, sondern auch zu tierärztliche Forscher beginnend transkriptomischen Studien nützlich.
Protocol
Representative Results
Discussion
Die Mehrheit der transkriptomischen Studien und die dazugehörigen Protokolle auf Maus, Ratte oder Post-Mortem Humanproben konzentrieren. Jedoch bieten Untersuchungen in Vieh und Wildtiere eine breite Palette von Möglichkeiten für die Charakterisierung der Immunantwort gegen Krankheiten, sowohl als für Veterinärmedizin und in Bezug auf zoonotische Krankheiten, für die menschliche Gesundheit. Dieses Protokoll zur Verfügung gestellt, einer Übersicht der wichtigsten Überlegungen für hoher Integrität RNA-Extraktion…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Die Autoren möchten James Fosse für seine hervorragende Arbeit auf allen Videografie und Videoverarbeitung danken; Michael Marti für seine hervorragende Arbeit bei der Erzeugung von digitalisierten Rinder Bilder; Lilia Walther für ihre Hilfe mit RNA-Extraktion und Bioanalyzer läuft; Mitch Palmer und Carly Kanipe für ihre hilfreiche Bewertung und Feedback auf Lymphknoten Bilder; und die Tierpflege und Tierärzten bei der National Animal Disease Center für all ihre harte Arbeit und Unterstützung bei der Tierhaltung und der Vorbereitung auf Autopsien.
Materials
| RNA preservation solution (we used RNALater for all experiments) | ThermoFisher | AM7020 | |
| 1.5 ml or 2 ml polypropylene microcentrifuge tubes | Fisher Scientific | 05-408-129 | |
| Disposable scalpels | Daigger Scientific | EF7281 | |
| Tissue forceps, rat tooth | Fisher Scientific | 12-460-117 | Other tissue forceps available including curved tip, tapered edge, etc. , depends on user preference |
| 3 mm punch biopsy needles | Fisher Scientific | NC9949469 | |
| Sharps container (small and transportable for necropsy) | Stericycle | 8900SA | 1 qt. size shown here |
| Cutting boards or disposable trays | Fisher Scientific | 09-002-24A | Available in a variety of sizes, depends on user preference |
| Personal protective equipment | Varies with pathogen (gloves, respirator masks, goggles, etc.) | ||
| Phenol-based RNA extraction reagent (we used TRIzol Reagent for all experiments) | ThermoFisher | 15596026 | |
| Silica column-based RNA extraction kit (we used the PureLink RNA Mini kit for all experiments) | ThermoFisher | 12183018A | Designed for up to 100 mg tissue |
| 100% Ethanol (200 proof for molecular biology) | Sigma-Aldrich | E7023 | |
| Tissue homogenizer with enclosed homogenization tubes (we used the gentleMACS dissociator for all experiments) | Miltenyi Biotec | 130-093-235 | |
| Agarose (General, for gel electrophoresis) | Sigma-Aldrich | A9539 | |
| 1X TBE | Fisher Scientific | BP24301 | Can also make from scratch in the laboratory |
| Deionized formamide | EMD Millipore | S4117 | |
| Sodium dodecyl sulfate | Sigma-Aldrich | L3771 | |
| Bromophenol blue | Sigma-Aldrich | 114391 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| EDTA (Ethylenediaminetetraacetic acid) | Sigma-Aldrich | EDS | |
| UV-Vis Spectrophotometer (we used the NanoDrop Spectrophotometer) | ThermoFisher | ND-2000 | |
| Device for quantitative RNA assessment (we used the Bioanalyzer, with associated components and protocols) | Agilent | G2939BA | |
| FFPE RNA extraction kit (we used the RecoverAll Total Nucleic Acid Isolation Kit for Formalin Fixed, Paraffin Embedded Tissue) | ThermoFisher | AM1975 | |
| Plastic spreader (L-shaped spreader) | Fisher Scientific | 14-665-231 | Only needed for sterility testing for samples from infected animals |
| Necropsy knives | Livestock Concepts | WI-0009209 |
References
- Tizioto, P. C., et al. Immunological response to single pathogen challenge with agents of the bovine respiratory disease complex: an RNA-sequence analysis of the bronchial lymph node transcriptome. PLoS One. 10 (6), e0131459 (2015).
- Miller, L. C., et al. Analysis of the swine tracheobronchial lymph node transcriptomic response to infection with a Chinese highly pathogenic strain of porcine reproductive and respiratory syndrome virus. BMC Veterinary Research. 8, 208 (2012).
- Silva, T. M. A., Costa, E. A., Paixao, T. A., Tsolis, R. M., Santos, R. L. Laboratory animal models for brucellosis research. Journal of Biomedicine and Biotechnology. 2011, 518323 (2011).
- Willard-Mack, C. L. Normal structure, function, and histology of the lymph nodes. Toxicologic Pathology. 34, 409-424 (2006).
- Elmore, S. A. Histopathology of the lymph nodes. Toxicologic Pathology. 34 (5), 425-454 (2006).
- Luscieti, P., Hubschmid, T. h., Cottier, H., Hess, M. W., Sobin, L. H. Human lymph node morphology as a function of age and site. Journal of Clinical Pathology. 33 (5), 454-461 (1980).
- Hadamitsky, C., et al. Age-dependent histoarchitectural changes in human lymph nodes: an underestimated process with clinical relevance?. Journal of Anatomy. 216 (5), 556-562 (2010).
- Sisson, S., Grossman, J. D., Getty, R. . Sisson and Grossman’s The Anatomy of Domestic Animals, Volume 1. , (1975).
- Olsen, S. C., Johnson, C. Comparison of abortion and infection after experimental challenge of pregnant bison and cattle with Brucella abortus strain 2308. Clinical and Vaccine Immunology. 18 (12), 2075-2078 (2011).
- Brichta-Harhay, D. M., et al. Microbiological analysis of bovine lymph nodes for the detection of Salmonella enterica. Journal of Food Protection. 75 (5), 854-858 (2012).
- Samuel, J. L., O’Boyle, D. A., Mathers, W. J., Frost, A. J. Isolation of Salmonella from mesenteric lymph nodes of healthy cattle at slaughter. Research in Veterinary Science. 28 (2), 238-241 (1980).
- Arthur, T. M., et al. Prevalence and characterization of Salmonella in bovine lymph nodes potentially destined for use in ground beef. Journal of Food Protection. 71 (8), 1685-1688 (2008).
- Cray, W. C., Moon, H. W. Experimental infection of calves and adult cattle with Escherichia coli O157:H7. Applied and Environmental Microbiology. 61 (4), 1586-1590 (1995).
- Thiermann, A. B. Experimental leptospiral infections in pregnant cattle with organisms of the Hebdomadis serogroup. American Journal of Veterinary Research. 43 (5), 780-784 (1982).
- Palmer, M. V., Waters, W. R., Whipple, D. L. Investigation of the transmission of Mycobacterium bovis from deer to cattle through indirect contact. American Journal of Veterinary Research. 65 (11), 1483-1489 (2004).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA, and proteins from cell and tissue samples. BioTechniques. 15 (3), 532-537 (1993).
- Chomczynski, P., Sacchi, N. Single step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Vogelstein, B., Gillespie, D. Preparative and analytical purification of DNA from agarose. Proceedings of the National Academy of Sciences of the United States of America. 76 (2), 615-619 (1979).
- . . AVMA Guidelines for the Euthanasia of Animals. , (2013).
- . . TRIzol Reagent Manual. , (2016).
- . . Disruption and Homogenization of Tissue for the Extraction of RNA. , (2014).
- . . PureLink RNA Mini Kit Protocol . , (2012).
- . . RNA Gel-loading Buffer. , (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing Agarose Gel Electrophoresis of RNA. Cold Spring Harbor Protocols. , (2010).
- Mueller, O., et al. A microfluidic system for high-speed reproducible DNA sizing and quantitation. Electrophoresis. 21 (1), 128-134 (2000).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7 (3), (2006).
- Suvarna, K. S., Layton, C., Bancroft, J. D. . Bancroft’s Theory and Practice of Histological Techniques. , (2012).
- Medawar, P. B. The rate of penetration of fixatives. Journal of Microscopy. 61 (1-2), 46-57 (1941).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods in Enzymology. 533, 225-233 (2013).
- Fleige, S., Pfaffl, M. W. RNA integrity and the effect on the real-time qRT-PCR performance. Molecular Aspects of Medicine. 27, 126-139 (2006).
- Fajardy, I., et al. Time course analysis of RNA stability in human placenta. BMC Molecular Biology. 10 (21), (2009).
- Bahar, B., et al. Long-term stability of RNA in post-mortem bovine skeletal muscle, liver and subcutaneous adipose tissues. BMC Molecular Biology. 8, 108 (2007).
- Yamagishi, A., et al. Gene profiling and bioinformatics analyses reveal time course differential gene expression in surgically resected colorectal tissues. Oncology Reports. 31 (4), 1532-1538 (2014).
- Choi, S., Ray, H. E., Lai, S. H., Alwood, J. S., Globus, R. K. Preservation of multiple mammalian tissues to maximize science return from ground based and spaceflight experiments. PLoS One. 11 (12), e0167391 (2016).
- Almeida, A., Thiery, J. P., Magdelenat, H., Radvanyi, F. Gene expression analysis by real-time reverse transcription polymerase chain reaction: influence of tissue handling. Analytical Biochemistry. 328 (2), 101-108 (2004).
- Lee, S. M. L., Schelcher, C., Thasler, R., Schiergens, T. S., Thasler, W. E. Pre-analytical determination of the effect of extended warm or cold ischaemia on RNA stability in the human ileum mucosa. PLoS One. 10 (9), e0138214 (2015).
- Kap, M., et al. The influence of tissue procurement procedures on RNA integrity, gene expression, and morphology in porcine and human liver tissue. Biopreservation and Biobanking. 13 (3), 200-206 (2015).
- Hong, S. H., et al. Effects of delay in the snap freezing of colorectal cancer tissues on the quality of DNA and RNA. Journal of the Korean Society of Coloproctology. 26 (5), 316-325 (2010).
- Lee, S. M., et al. RNA stability in human liver: comparison of different processing times, temperatures and methods. Molecular Biotechnology. 53 (1), 1-8 (2013).
- Morrison, P. K., et al. Post-mortem stability of RNA in skeletal muscle and adipose tissue and the tissue-specific expression of myostatin, perilipin and associated factors in the horse. PLoS One. 9 (6), e100810 (2014).
- Seear, P. J., Sweeney, G. E. Stability of RNA isolated from post-mortem tissues of Atlantic salmon (Salmo salar L.). Fish Physiology and Biochemistry. 34 (1), 19-24 (2008).
- Marchuk, L., Sciore, P., Reno, C., Frank, C. B., Hart, D. A. Postmortem stability of total RNA isolated from rabbit ligament, tendon, and cartilage. Biochimica et Biophysica Acta. 1379 (2), 171-177 (1998).
- Inoue, H., Kimura, A., Tuji, T. Degradation profile of mRNA in a dead rat body: basic semi-quantification study. Forensic Science International. 130 (2-3), 127-132 (2002).
- Micke, P., et al. Biobanking of fresh frozen tissue: RNA is stable in nonfixed surgical specimens. Laboratory Investigation. 86 (2), 202-211 (2006).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of nucleic acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Ahmed, A. M., et al. Variation in the ovine abomasal lymph node transcriptome between breeds known to differ in resistance to the gastrointestinal nematode. PLoS One. 10 (5), e0124823 (2015).
- Russell, G. C., et al. Host gene expression changes in cattle infected with Alcelaphine herpesvirus 1. Virus Research. 169 (1), 246-254 (2012).
- Avraham, R., et al. A highly multiplexed and sensitive RNA-seq protocol for simultaneous analysis of host and pathogen transcriptomes. Nature Protocols. 11, 1477-1491 (2016).

