एक विधि के रूप में अनुमापन एलिसा रिसेप्टर Ligand बातचीत के पृथक्करण स्थिरांक निर्धारित करने के लिए
Summary
एक विस्तृत प्रोटोकॉल एक अनुमापन एलिसा प्रदर्शन करने के लिए वर्णित है । इसके अलावा, एक उपंयास एल्गोरिथ्म अनुमापन एलिसा का मूल्यांकन करने के लिए और एक microtiter प्लेट-मैटीरियल रिसेप्टर के लिए एक घुलनशील ligand के बंधन के एक पृथक्करण निरंतर प्राप्त करने के लिए प्रस्तुत किया है ।
Abstract
पृथक्करण लगातार बाध्यकारी संतुलन में दो भागीदारों के बीच बातचीत का वर्णन है और उनके संबंध का एक उपाय है । यह एक महत्वपूर्ण पैरामीटर के लिए विभिंन लाइगैंडों, जैसे, प्रतिस्पर्धी अवरोधकों, प्रोटीन isoforms और म्यूटेंट, एक बाध्यकारी भागीदार के लिए अपनी बाध्यकारी ताकत के लिए तुलना है । पृथक्करण स्थिरांक बाध्यकारी curves के रूप में मुक्त ligand बाउंड बनाम की सांद्रता की साजिश रचने से निर्धारित होते हैं । इसके विपरीत, अनुमापन घटता है, जिसमें एक संकेत है कि बाध्य ligand की एकाग्रता के लिए आनुपातिक है जोड़ा ligand की कुल एकाग्रता के खिलाफ साजिश रची है, बहुत रिकॉर्ड करने के लिए आसान कर रहे हैं । संकेत spectroscopically और एंजाइम से जुड़े immunosorbent परख (एलिसा) द्वारा पता लगाया जा सकता है । यह एक अनुमापन एलिसा के लिए एक प्रोटोकॉल में उदाहरण है कि सांप विष की बाध्यकारी-व्युत्पंन rhodocetin α2β1 integrin के अपने मैटीरियल लक्ष्य डोमेन के लिए उपाय । अनुमापन एलिसा बहुमुखी और व्यापक रूप से इस्तेमाल कर रहे हैं । बातचीत प्रोटीन के किसी भी जोड़ी के रूप में इस्तेमाल किया जा सकता है मैटीरियल रिसेप्टर और घुलनशील ligand, बशर्ते कि दोनों प्रोटीन शुद्ध कर रहे हैं, और उनकी सांद्रता जाना जाता है । कठिनाई अब तक एक अनुमापन वक्र से पृथक्करण लगातार निर्धारित किया गया है । इस अध्ययन में, एक गणितीय अनुमापन curves अंतर्निहित समारोह शुरू की है । किसी भी त्रुटि प्रवण एक संतृप्ति उपज की चित्रमय अनुमान के बिना, इस एल्गोरिथ्म कच्चे डेटा के प्रसंस्करण की अनुमति देता है (जोड़ा ligand के विभिंन सांद्रता पर संकेत तीव्रता) गैर रेखीय प्रतिगमन के माध्यम से गणितीय मूल्यांकन द्वारा सीधे । इस प्रकार, कई अनुमापन घटता एक साथ दर्ज किया जा सकता है और विशिष्ट मापदंडों का एक सेट में तब्दील, उनमें से पृथक्करण निरंतर और बाध्यकारी सक्रिय रिसेप्टर की एकाग्रता, और वे सांख्यिकीय मूल्यांकन किया जा सकता है. जब इस एल्गोरिथ्म के साथ संयुक्त, अनुमापन एलिसा सीधे पृथक्करण निरंतर पेश करने का लाभ प्राप्त करते हैं । इसलिए, वे भविष्य में और अधिक कुशलता से इस्तेमाल किया जा सकता है ।
Introduction
पृथक्करण स्थिरांक K अपने ligand (L) के लिए एक रिसेप्टर (R) के संबध का वर्णन करने के लिए एक कुंजी पैरामीटर है. जन कार्रवाई के कानून के आधार पर, कश्मीर संतुलन के लिए परिभाषित किया गया है, जिसमें रिसेप्टर में ligand परिसर आरएल dissociates आर और ligand एल में:
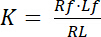 समीकरण 1
समीकरण 1
के साथ सूचकांक एफ रिसेप्टर और ligand के मुक्त/असीम राज्य का संकेत है । रिसेप्टर की एकाग्रता-ligand जटिल, आर एल, रिसेप्टर की एकाग्रता के समान है-ligand एलबीबाध्य. रिसेप्टर आरटी की कुल एकाग्रता के रूप में मुक्त रिसेप्टर आरएफ और ligand-बाउंड रिसेप्टर आरबी = एलबीकी राशि है, पृथक्करण स्थिरांक भी के रूप में लिखा जा सकता है:
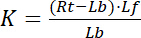 समीकरण 2
समीकरण 2
इसलिए, संतृप्ति की उपज Y, रिसेप्टर आरटीकी कुल एकाग्रता के संबंध में बाध्य ligand एलबी के अंश के रूप में परिभाषित,
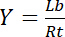 समीकरण 3
समीकरण 3
मुक्त ligand एल की एकाग्रता पर निर्भर करता हैच:
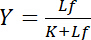 समीकरण 4
समीकरण 4
इस अतिशयोक्तिपूर्ण संबंध एक रिसेप्टर ligand बातचीत के बंधन वक्र का वर्णन करता है और इसके भूखंड मुक्त ligand एलएफकी एकाग्रता के एक समारोह के रूप में बंधे ligand एलबी की एकाग्रता से पता चलता है. बंधन वक्र से, पृथक्करण लगातार कश्मीर आधा-अधिक से अधिक अधिकतम संतृप्ति उपज में मुक्त ligand की एकाग्रता के रूप में प्राप्त किया जा सकता है । इसके अलावा, विभिंन एल्गोरिदम linearize curves करने के लिए स्थापित किया गया है, जैसे Klotz द्वारा डबल पारस्परिक साजिश के रूप में1,2, या परिवर्तनों के अनुसार Scatchard या Hanes (Bisswanger3द्वारा की समीक्षा की) । हालांकि, सभी एल्गोरिदम समस्या यह है कि संतृप्ति उपज है, जो asymptotically बंधन वक्र में मुक्त ligand के उच्च सांद्रता पर संपर्क किया है की अधिकतम मूल्य से ग्रस्त है, एक चित्रमय पूर्व मूल्यांकन में अनुमान लगाया जा सकता है और इसलिए है त्रुटि-प्रवण ।
इसके अलावा, एक बाध्यकारी वक्र के निर्धारण के बंधन संतुलन के दौरान स्वतंत्र और समयबद्ध ligand के ठहराव की आवश्यकता है । इस अंत करने के लिए, मुक्त ligand रिसेप्टर बाध्य ligand और quantified से अलग हो गया है । इसलिए, ligand और रिसेप्टर के लिए एक प्रोटीन रिसेप्टर के विरोध के रूप में एक गैर प्रोटीन ligand के रूप में उनकी संपत्तियों, में अलग करने के लिए है. यदि दोनों बाध्यकारी भागीदारों प्रोटीन हैं, वे अपने आकार, शुल्क, या अंय आणविक सुविधाओं में भेद किया जाना है । फिर भी, छोटे पैमाने पर बाध्यकारी दृष्टिकोण में ligand सांद्रता के ठहराव एक कठिन काम है । ligand के रेडियोधर्मी लेबल अक्सर बाध्य ligand की कम एकाग्रता का पता लगाने के लिए आवश्यक हो गया है, विशेष रूप से अगर रिसेप्टर्स की पर्याप्त मात्रा में उपलब्ध है या सस्ती नहीं थे. इसके अलावा, रिसेप्टर बाउंड ligand अलग कर देना के दौरान और अलगाव के बाद एक गैर नगण्य तरीके से हो सकता है । इसलिए, ऐसे संतुलन जेल निस्पंदन4, केशिका ट्रो5, और पल्स प्रोटियोलिसिस6, के रूप में जटिल तरीके, रिसेप्टर से बंधे ligand यों की आवश्यकता होती है और यह मुफ्त ligand से अलग ।
इन बाध्यकारी परख के विपरीत, अनुमापन प्रयोगों बाध्य और मुक्त ligand के मात्रात्मक जुदाई की आवश्यकता नहीं है । इस अंत करने के लिए, एक निरंतर एकाग्रता में एक रिसेप्टर जोड़ा ligand के विभिन्न सांद्रता के साथ titrated है. रिसेप्टर के लिए बाध्यकारी द्वारा, बाध्य ligand एक भौतिक संपत्ति है जो इसे मुक्त ligand से अलग है और से मध्यम श्रेणी का है, जैसे, photometry, fluorometry, या एंटीबॉडी का पता लगाने । इस प्रकार, एक संकेत एस, जो संतृप्ति के लिए आनुपातिक है और फलस्वरूप भी रिसेप्टर की एकाग्रता के लिए बाध्य ligand (एलबी), जोड़ा ligand की कुल एकाग्रता के एक समारोह के रूप में पता चला है (एलटी). दोनों मापदंडों, संकेत एस और जोड़ा ligand की कुल एकाग्रता बाध्य और मुक्त ligand की सांद्रता की तुलना में एक प्रत्यक्ष और आसान तरीके से quantified हैं. विशेष रूप से, रिसेप्टर का पता लगाने-ligand एंजाइम से जुड़े immunosorbent परख (एलिसा) के लिए नमूना मात्रा की कमी से नीचे १०० µ एल के रूप में अच्छी तरह से बहु में कई ligand सांद्रता के समानांतर माप अच्छी तरह से microtiter प्लेट की अनुमति दी । एक अनुमापन एलिसा में, एक रिसेप्टर शारीरिक रूप से एक ही एकाग्रता और घुलनशील ligand के साथ titrated में एक microtiter प्लेट को adsorbed है । रिसेप्टर hydrophobic सोखना द्वारा अनिवार्य रूप से प्लास्टिक की सतह के लिए मैटीरियल है । स्थिर रिसेप्टर की सतह एकाग्रता एक रैखिक संबंध में रिसेप्टर की कोटिंग एकाग्रता के साथ संबद्ध, Langmuir ´ एस सोखना isotherm के अनुसार होने की संभावना7. adsorbed रिसेप्टर अणुओं की कुल संख्या के अलावा, उनकी गतिविधि राज्य अनुमापन परख के लिए एक और महत्वपूर्ण पैरामीटर है । केवल स्थिर रिसेप्टर्स जो ligand बाध्यकारी गतिविधि को बनाए रखा है, अनुमापन परख के लिए प्रासंगिक है और अंततः सक्रिय रिसेप्टर्स के कुल एकाग्रता के लिए योगदान आरटी अनुमापन परख, जो सीधे निर्धारित नहीं किया जा सकता है ।
प्लास्टिक की सतह पर साइटों, जो मैटीरियल रिसेप्टर द्वारा कवर नहीं कर रहे हैं adsorb अन्य प्रोटीन, जैसे ligand के लिए प्रवण हैं । इस तरह के प्लास्टिक की सतह साइटों को ligand के भौतिक सोखना रिसेप्टर बाध्य ligand के रूप में एक समान संकेत में परिणाम, अभी तक एक गैर विशिष्ट तरीके से होगा । इस विशिष्ट संकेत को कम करने के लिए, प्लास्टिक की सतह साइटों microtiter प्लेटों जो प्रोटीन के साथ लेपित नहीं किया गया है अभी तक गोजातीय सीरम एल्ब्युमिन (BSA) के साथ अवरुद्ध हो जाएगा । हालांकि, कुछ रिसेप्टर-ligand अनुमापन परख के लिए, गैर विशिष्ट पृष्ठभूमि संकेतों मनाया जा सकता है । फिर, अंय ब्लॉकिंग एजेंटों, जैसे ०.२% जिलेटिन या ०.०४% 20 के बीच की एक समाधान की सिफारिश की है ।
रिसेप्टर के लिए बाध्यकारी के बाद, मुक्त ligand दो धोने कदम से हटा दिया है. बाउंड ligand रिसेप्टर, जो अच्छी तरह से microtiter की प्लास्टिक की सतह के लिए मैटीरियल है, और वैकल्पिक रूप से रासायनिक निर्धारण द्वारा प्रबलित के साथ रहता है । बाद के आबंध पार के लिए बाध्य ligand और glutaraldehyde के साथ मैटीरियल रिसेप्टर का संबंध, बफर पदार्थ TRIS HEPES के लिए जगह है, ligand बंधन में किसी भी परिवर्तन के बिना । HEPES, TRIS के विपरीत, glutaraldehyde को निष्क्रिय नहीं करता है । आबंध पार glutaraldehyde के साथ संपर्क अपने रिसेप्टर के साथ बंधे ligand को ठीक करता है और बाद में कपड़े धोने और गर्मी कदम के दौरान अपनी पृथक्करण रोकता है । इस प्रकार, रिसेप्टर ligand बातचीत रासायनिक जम जाता है और एक अनुमापन वक्र जो धोने और गर्मी के बाद के कदम से अप्रभावित है वारंट । हालांकि, glutaraldehyde निर्धारण रासायनिक ligand और रिसेप्टर इस तरह से संशोधित कर सकते हैं कि उनकी बातचीत कम या समाप्त हो गया है. इसके अलावा, ligand के भीतर epitopes के संशोधन का पता लगाने एंटीबॉडी के बंधन संबध बदल सकते हैं, खासकर अगर एक मोनोक्लोनल एंटीबॉडी के लिए बाध्य ligand यों तो इस्तेमाल किया जाता है । हालांकि glutaraldehyde निर्धारण के इन प्रतिकूल प्रभाव का न तो इस अनुमापन एलिसा में होता है, glutaraldehyde की ओर परीक्षण की संवेदनशीलता हर रिसेप्टर ligand बातचीत के लिए अनुमापन प्रयोग करने से पहले परीक्षण किया जाना चाहिए । निर्धारण के बाद, अतिरिक्त glutaraldehyde TRIS-युक्त बफर के साथ तीन धुलाई चरणों में हटा दिया जाता है । TRIS शेष एल्डिहाइड समूहों, जो विशेष रूप से बाद में कदम में एंटीबॉडी का पता लगाने के साथ प्रतिक्रिया हो सकती है निष्क्रिय करता है ।
बंधे ligand की मात्रा एंजाइम से जुड़े एंटीबॉडी के साथ quantified है, जो एक भामिति एलिसा संकेत एस प्रदान करते हैं । इस बनाम कुल ligand एकाग्रता एलटी एक अच्छी तरह से जोड़ा साजिश रची है । इसके आसान अधिग्रहण के बावजूद, अनुमापन वक्र बाध्यकारी वक्र के विपरीत में एक अतिशयोक्तिपूर्ण समारोह नहीं है । इसके अलावा, यह कैसे एक अनुमापन वक्र से पृथक्करण लगातार कश्मीर की गणना करने के लिए स्पष्ट नहीं किया गया है । हालांकि linearize spectroscopically अनुमापन curves करने के लिए एल्गोरिदम स्वतंत्र रूप से Stockell8 और Heyn और Weischet9द्वारा सूचित किया गया है, वे कम अधिकतम संकेत मूल्य का आकलन करने के अपने अनिश्चितता के कारण गिर गया है कि जोड़ा ligand के उच्च सांद्रता पर संतृप्ति उपज दृष्टिकोण ।
यहां, एक अनुमापन एलिसा और एक गैर रेखीय प्रतिगमन एल्गोरिथ्म एक अनुमापन वक्र से एक रिसेप्टर ligand बातचीत के लिए पृथक्करण निरंतर कश्मीर प्राप्त करने के लिए वर्णित हैं । इस प्रोटोकॉल कोलेजन की बातचीत के लिए उदाहरण है एक सर्प विष के साथ एक integrin α2β1 के डोमेन बाध्यकारी–अवरोध करनेवाला । Integrins कोशिका आसंजन अणु हैं, जो आसपास के extracellular मैट्रिक्स या अंतर्निहित तहखाने झिल्ली के लिए कोशिकाओं के anchorage मध्यस्थता10,11. इसके अलावा, integrins कोशिकाओं और extracellular मैट्रिक्स के बीच अतिरिक्त संकेतन अणुओं की भर्ती और नए सेल organelles, adhesomes, सेल-मैट्रिक्स बातचीत पर12,13के गठन से महत्वपूर्ण संकेतों को व्यक्त करते हैं, 14. कोलेजन, α2β1 integrin के ligand, मानव शरीर के सबसे प्रचुर मात्रा में प्रोटीन है और संयोजी ऊतक के एक महत्वपूर्ण मचान घटक15है । α2β1 integrin और कोलेजन के बीच बातचीत integrin α2 उपइकाई के एक डोमेन द्वारा मध्यस्थता है । integrin α2A-डोमेन एक divalent कटियन, जो कोलेजन बाध्यकारी के लिए आवश्यक है और अपनी संरचना स्थिर होता है । जंगली प्रकार के रूप में अच्छी तरह के रूप में α2A डोमेन के म्यूटेंट, जैसे एक जिसमें सतह उजागर अवशेषों Y216 एक glycine के लिए प्रतिस्थापित किया गया था, आसानी से एक बैक्टीरियल अभिव्यक्ति प्रणाली में recombinantly का उत्पादन किया जा सकता है और उनके oligo के माध्यम से अलग-एक नि्ता के साथ टैग- TRIS-बफर खारा के खिलाफ बाद डायलिसिस के साथ superflow कॉलम (टीबीएस; ५० mm TRIS/एचसीएल, पीएच ७.४, १५० mm NaCl) जिसमें 2 mM MgCl216है । उनकी सांद्रता bicinchoninic एसिड परख (बीसीए) के साथ निर्धारित की गई थी और उनके purities पारंपरिक एसडीएस-पृष्ठ और Coomassie-प्रतिभाशाली नीले R250 के साथ दाग द्वारा परीक्षण कर रहे हैं ।
α2β1 integrin और कोलेजन के बीच बातचीत सर्प विष घटक, rhodocetin से, मलयन पिट सांप (Calloselasma rhodostoma)16,17से बाध्यकारी द्वारा अवरुद्ध है । इस अनुमापन एलिसा में एक घुलनशील ligand के रूप में प्रयुक्त, rhodocetin कच्चे जहर से शुद्ध के रूप में पहले16वर्णित है । यह HEPES-बफर खारा में भंग कर रहा है (एचबीएस; 10 मिमी HEPES/NaOH, पीएच ७.४, १५० मिमी NaCl) और पर जमे हुए संग्रहीत है-20 ° c. इसकी एकाग्रता बीसीए द्वारा निर्धारित की गई थी और इसकी शुद्धता एसडीएस-पृष्ठ द्वारा सिद्ध की गई थी. एक विरोधी के रूप में, rhodocetin न केवल ब्लॉक कोलेजन integrin α2β1 ए-डोमेन के लिए, लेकिन यह भी integrin के निष्क्रिय अनुरूप स्थिर जिससे या कोशिकाओं या प्लेटलेट्स में कोलेजन से किसी भी संकेतन को रोकने18। यह महान जैव चिकित्सा महत्व का है अपने रिसेप्टर लक्ष्य के साथ rhodocetin के पृथक्करण निरंतर निर्धारित है और इस तरह अपने आणविक तंत्र और दवा की क्षमता को सुलझाना उदा, एक antithrombotic एजेंट के रूप में. यह अंत करने के लिए, एक अनुमापन एलिसा अपने मूल्यांकन, जो लगभग किसी भी रिसेप्टर एक 1:1 बातचीत stoichiometry के साथ ligand बातचीत के लिए लागू है सहित वर्णित है ।
Protocol
Representative Results
Discussion
अनुमापन एलिसा एक बहुमुखी परीक्षण प्रणाली के लिए एक रिसेप्टर ligand बातचीत के पृथक्करण निर्धारित है । के रूप में अनुमापन एलिसा आवश्यकता को दरकिनार स्वतंत्र और समयबद्ध लाइगैंडों प्रभावी ढंग से और उनकी सां…
Divulgations
The authors have nothing to disclose.
Acknowledgements
प्रोटोकॉल और एल्गोरिथ्म एक ड्यूश Forschungsgemeinschaft द्वारा वित्त पोषित परियोजना के भीतर विकसित किया गया था (DFG अनुदान SFB1009 A09 और EB177/ लेखक धंयवाद बारबरा Schedding और फेलिक्स तकनीकी सहायता के लिए Schmalbein और गंभीर पांडुलिपि पढ़ने के लिए डॉ Niland ।
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

