滴定 ELISA 法测定受体配体相互作用的离解常数
Summary
描述了执行滴定 ELISA 的详细协议。此外, 提出了一种新的评价滴定 ELISAs 的方法, 并获得了可溶性配体对微量滴定板固定化受体的离解常数。
Abstract
离解常数描述二个伙伴之间的相互作用在束缚平衡并且是衡量他们的亲和力。它是比较不同配体的关键参数,例如, 竞争性抑制剂, 蛋白质亚型和突变体, 其结合强度的结合的合作伙伴。离解常数通过绘制绑定vs自由配体的浓度作为绑定曲线来确定。相反, 滴定曲线, 其中一个比例的浓度的绑定配体被绘制反对总浓度的附加配体, 更容易记录。该信号可以 spectroscopically 和酶联免疫吸附试验 (ELISA) 检测。这在一项滴定 ELISA 的协议中得到了证明, 它测量了蛇毒衍生 rhodocetin 对其固定化目标域α2β1整合素的约束力。滴定 ELISAs 是多才多艺和广泛使用。任何一对相互作用的蛋白质可以作为固定受体和可溶性配体, 只要两种蛋白质是纯的, 他们的浓度是已知的。到目前为止的困难是确定从滴定曲线的离解常数。本文介绍了滴定曲线的数学函数。在没有任何容易出错的饱和率图形估计的情况下, 该算法可以通过非线性回归的数学评价直接处理原始数据 (不同浓度的附加配体的信号强度)。这样, 可以同时记录几种滴定曲线, 转化为一组特征参数, 其中包括解离常数和结合主动受体的浓度, 并对其进行统计学评价。结合该算法, 滴定 ELISAs 获得直接呈现离解常数的优点。因此, 将来可能会更有效地使用这些方法。
Introduction
离解常数 K 是描述受体 (R) 对配体 (L) 亲和性的关键参数。以质量作用定律为基础, 定义了受体配体复合 RL 离解受体 R 和配体 L 的平衡:
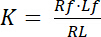 等式1
等式1
索引f指示受体和配体的自由/未绑定状态。受体配体复合物的浓度, RL, 是相同的受体绑定配体 Lb的浓度。当受体 rt的总浓度是自由受体 rf和配体绑定受体 rb = Lb的总和时, 离解常数也可以写成:
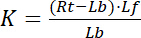 等式2
等式2
因此, 饱和屈服 Y, 定义为绑定配体 Lb的分数与受体 Rt的总浓度的关系,
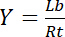 等式3
等式3
取决于游离配体 Lf的浓度:
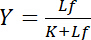 等式4
等式4
这种双曲关系描述了受体配体相互作用的结合曲线, 其图形显示了束缚配体 lb作为游离配体 lf浓度的函数的浓度。从结合曲线上可以导出游离配体在半最大饱和屈服下的浓度。此外, 还建立了进行线性化绑定曲线的不同算法, 如Klotz1、2或根据斯卡查德或哈内斯进行的转换 (由Bisswanger3 检查) 的双对等图。然而, 所有的算法都存在一个问题, 即饱和屈服的最大值在结合曲线上的自由配体的高浓度下渐近逼近, 必须在图形预评价中得到估计, 因此容易出错。
另外, 结合曲线的确定要求在束缚平衡期间定量的自由和束缚配体。为此, 游离配体必须与受体结合的配体分离并量化。因此, 配体和受体必须在其性质上有所不同, 如非蛋白配体, 而不是蛋白质受体。如果两个具有约束力的合作伙伴都是蛋白质, 它们就必须在大小、电荷或其他分子特征上区分开来。然而, 小尺度结合方法中配体浓度的量化是一项艰巨的任务。对配体进行放射性标记往往是检测束缚配体低浓度的必要条件, 尤其是在大量的受体无法获得或负担得起的情况下。此外, 受体结合的配体可以在隔离期间和之后, 以不可忽略的方式分离。因此, 复杂的方法, 如平衡凝胶过滤4, 毛细管电泳5和脉冲蛋白质分解6, 需要量化受体绑定配体, 并将其与游离配体分离。
与这些结合化验相比, 滴定实验不需要定量分离的束缚和游离配体。为此, 在恒定浓度的受体滴定不同浓度的添加配体。通过绑定到受体, 绑定配体有一个生物物理性质, 它区别于游离配体, 是可测量的,例如, 光度, 荧光, 或抗体检测。因此, 信号 S, 与饱和率 Y 和因而也到受体束缚配体 (lb) 的浓度成正比, 被检测为添加配体 (lt) 总浓度的函数。两个参数, 信号 S 和添加配体的总浓度比束缚和游离配体的浓度直接和容易的方式量化。特别是通过酶联免疫吸附试验 (ELISA) 检测受体结合配体, 使试样体积减少到100µL 以下, 以及多井微量滴定板中几种配体浓度的平行测量。在滴定 ELISA 中, 受体被物理吸附到微量滴定板上, 在同一浓度和滴定与可溶性配体。该受体主要通过疏水性吸附固定于塑料表面。固定化受体的表面浓度与受体在非线性关系中的涂层浓度相关, 可能根据 Langmuir´s 吸附等温线7。除了吸附受体分子的总数量外, 它们的活性状态也是滴定测定的另一个重要参数。只有固定的受体保留配体结合活动, 是相关的滴定分析和最终贡献的总浓度的活性受体 Rt滴定法, 不能直接确定。
非固定化受体覆盖的塑料表面上的部位容易吸附其他蛋白质, 如配体。对这种塑料表面的配体进行物理吸附会导致类似的信号作为受体束缚配体, 但以非特异性的方式。为了减少这种非特异性信号, 尚未涂上蛋白质的微量滴定板的塑料表面部位会被牛血清白蛋白 (BSA) 阻断。然而, 对于某些受体配体滴定法, 可以观察非特异性的背景信号。然后, 建议使用其他阻挡剂, 如0.2% 明胶或0.04% 吐温20的溶液。
与受体结合后, 游离配体被两个洗涤步骤除去。束缚配体仍然与受体, 这是固定在塑料表面的微量滴定井, 并选择性加强化学固定。对于随以戊二醛的束缚配体与固定化受体的共价键交联, HEPES 中的缓冲物质三被取代, 而不改变配体结合。HEPES, 与三个不同, 不灭活戊二醛。戊二醛共价交联固定与受体的束缚配体, 防止其离解在随后的洗涤和孵化步骤。因此, 受体配体相互作用是化学冻结, 并保证一个滴定曲线, 不受随后的洗涤和孵化步骤的影响。然而, 戊二醛固定可能化学修饰的配体和受体, 这样的方式, 他们的相互作用减少或废除。此外, 修饰配体内的表位可能改变检测抗体的结合亲和性, 特别是当单克隆抗体用于量化绑定配体。尽管这两种戊二醛固定的不良影响都发生在这种滴定法中, 但对戊二醛的检测灵敏度必须在滴定实验之前对每种受体配体相互作用进行测试。固定后, 过量戊二醛被去除三洗涤步骤与三含缓冲。三钝化剩余醛类, 这可能 nonspecifically 反应与检测抗体在随后的步骤。
结合酶联抗体定量分析了束缚配体的数量, 提供了光度 ELISA 信号。这是绘制的与总配体浓度 Lt添加到每个井。尽管它更容易获得, 滴定曲线不是一个双曲函数与结合曲线的对比。此外, 如何从滴定曲线计算离解常数 K 也不清楚。虽然 Stockell8和海恩和 Weischet9独立地报告了进行线性化 spectroscopically 获得滴定曲线的算法, 但由于它们估计的最大信号值的不确定性, 它们的数量很短。高浓度添加配体的饱和屈服方法。
本文介绍了一种滴定法和非线性回归算法, 从滴定曲线上推导出受体配体相互作用的离解常数 K。这一协议的例子, 以相互作用的胶原结合 a 域的整合素α2β1与蛇毒衍生抑制剂。整合是细胞黏附分子, 它调解细胞的锚地到周围细胞外基质或底层基底膜10,11。此外, 整合在细胞和细胞外基质之间传递重要信号, 通过招募额外的信号分子和形成新的细胞器, adhesomes, 在细胞基质相互作用12,13,14. 胶原蛋白是α2β1整合素的配体, 是人体最丰富的蛋白质, 是结缔组织15的关键支架组件。α2β1整合素与胶原蛋白之间的相互作用是由α2亚单位的 A 域介导的。整合素α2A 域含有价阳离子, 它是胶原结合所必需的, 它的结构稳定。野生型的形式以及α2A 领域的突变体, 如 Y216 被取代为甘氨酸的表面暴露的残留物, 可以很容易地在细菌表达系统中产生 recombinantly, 并通过其寡核苷酸与 NiNTA 分离。superflow 柱与随后透析对三缓冲盐水 (tb; 50 毫米三/HCl, pH 值 7.4, 150 毫米氯化钠) 包含2毫米氯化镁216。它们的浓度是用二辛可宁酸测定法 (纯度) 测定的, 它们的含量由常规的 SDS 页进行测试, 并沾上了考马斯–灿烂的蓝色 R250。
α2β1整合素与胶原蛋白的相互作用是由 rhodocetin 的蛇毒成分 (Calloselasma rhodostoma)16,17) 的结合所阻断的。作为可溶性配体在这个滴定酶联免疫吸附, rhodocetin 是从粗毒液纯化, 如前所述16。它被溶化在 HEPES 缓冲的盐水 (哈佛商学院; 10 毫米 HEPES/氢氧化钠, pH 值 7.4, 150 毫米氯化钠) 并且被存放被冻结在-20 °c。它的浓度是由鉴定者决定的, 其纯度由 SDS 页面证明。作为拮抗剂, rhodocetin 不仅阻断了整合素α2β1 A 域的胶原蛋白结合, 而且稳定了整合体的非活性构象, 从而防止胶原蛋白进入细胞或血小板18。rhodocetin 与受体靶的分离常数的测定具有重要的生物医学意义, 从而解开其分子机制和药用电位如, 作为抗血栓剂。为此, 介绍了一种滴定 ELISA 法, 包括其评价, 适用于几乎任何受体配体相互作用的1:1 相互作用化学计量。
Protocol
Representative Results
Discussion
滴定 ELISA 是一种多功能的测试系统, 用于测定受体配体相互作用的离解。由于滴定 ELISA 绕过了有效分离游离和束缚配体的必要性, 并定量分析了它们的浓度, 大量的研究和出版物使用滴定 ELISAs 而不是记录绑定曲线.此外, 滴定 ELISAs 是容易执行和要求相当低数量的受体和配体。为了准确分析离解常数, 必须使用纯制剂和受体和配体。在受体制剂中污染蛋白质与微量滴定板塑料表面吸附部位的受体竞?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
该协议和算法是在德意志 Forschungsgemeinschaft (DFG 赠款 SFB1009 A09 和 EB177/13-1) 资助的一个项目内开发的。作者感谢芭芭拉 Schedding 和费利克斯 Schmalbein 的技术支持和赖能博士批判地阅读手稿。
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

