Titrering ELISA som en metode til at bestemme dissociationskonstant Receptor Ligand interaktion
Summary
En detaljeret protokol til at udføre en titrering ELISA er beskrevet. Derudover præsenteres en roman algoritme at evaluere titrering ringprøver og opnå en dissociationskonstant af bindingen af et opløseligt ligand til en mikrotiter plade-immobiliseret receptor.
Abstract
Dissociationskonstant beskriver samspillet mellem to partnere i bindende ligevægt og er et mål for deres affinitet. Det er en afgørende parameter for at sammenligne forskellige ligander, f.eks., kompetitive inhibitorer, protein isoformer og mutanter, for deres bindende styrke til en bindende partner. Dissociation konstanter bestemmes af plotte koncentrationer af bundne versus frie ligand som bindende kurver. Derimod er titrering kurver, hvor et signal, der er proportional med koncentrationen af bundne ligand er plottes i den samlede koncentration af tilsat ligand, meget lettere at optage. Signalet kan påvises hjælp og enzym-forbundet immunosorbent assay (ELISA). Dette er eksemplificeret i en protokol for en titrering ELISA, der måler bindingen af snake venom-afledte rhodocetin til sin immobiliseret destinationsdomænet af α2β1 integrin. Titrering ringprøver er alsidig og udbredte. Ethvert par af interagerende proteiner kan bruges som immobiliseret receptor og opløselige ligand, forudsat at begge proteiner er ren, og deres koncentrationer er kendt. Problemet har hidtil været at bestemme dissociationskonstant fra en titreringskurven. I denne undersøgelse, er en matematisk funktion underliggende titrering kurver indført. Uden noget fejlbehæftet grafisk skøn over en mætning udbytte tillader denne algoritme behandling af de rå data (signal intensiteter i forskellige koncentrationer af tilsat ligand) direkte af matematiske evaluering via ikke-lineær regression. Således flere titrering kurver kan registreres samtidigt og omdannet til et sæt af parametre, blandt dem dissociationskonstant og koncentrationen af bindende-aktive receptor, og de kan evalueres statistisk. Når det kombineres med denne algoritme, titrering ringprøver få fordel af direkte præsenterer dissociationskonstant. Derfor, de kan anvendes mere effektivt i fremtiden.
Introduction
Dissociationskonstant K er en vigtig parameter til at beskrive en receptor (R) affinitet for dets ligand (L). Baseret på loven massevirkningsloven, er K defineret for ligevægt, hvor receptor-ligand komplekse RL dissocieres til receptoren Rasmussen og ligand L:
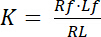 Ligning 1
Ligning 1
med indeks f , der angiver tilstanden gratis/ubundet af receptor og ligand. Koncentrationen af receptor-ligand kompleks, RL, er identisk med koncentrationen af receptor-bundet ligand Lb. Da den samlede koncentration af receptor Rt er summen af de gratis receptor Rf og ligand-bundet receptor Rb = Lb, dissociationskonstant kan også skrives som:
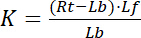 Ligning 2
Ligning 2
Derfor, mætning udbytte Y, defineret som brøkdel af bundne ligand Lb i forholdet mellem den samlede koncentration af receptor Rt,
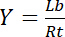 Ligning 3
Ligning 3
afhænger af koncentrationen af frie ligand Lf:
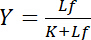 Ligning 4
Ligning 4
Denne hyperbolske relation beskriver bindende kurven af en receptor-ligand interaktion og dens plot viser koncentrationen af bundne ligand Lb som funktion af koncentrationen af frie ligand Larsenf. Fra den bindende kurve, kan dissociationskonstant K afledes som koncentrationen af frie ligand på halv-maksimal mætning udbytte. Derudover har været etableret forskellige algoritmer til linearize bindende kurver som dobbelt-reciprokke plot af Klotz1,2, eller transformationer Scatchard eller Hanes (gennemgået ved Bisswanger3). Men alle algoritmer lider af det problem, at den maksimale værdi af mætning udbytte, der er asymptotisk nærmede sig i høje koncentrationer af gratis ligand i bindende kurve, skal vurderes i en grafisk pre evaluering og derfor er fejlbehæftet.
Derudover kræver fastsættelsen af en bindende kurve kvantificering af frie og bundne ligand under bindende ligevægt. Med henblik herpå har den gratis ligand adskilles fra receptor-bundet ligand og kvantificeret. Ligand og receptor skal derfor adskiller sig i deres egenskaber, såsom en ikke-proteinholdige ligand i modsætning til et protein receptor. Hvis begge bindende partnere er proteiner, skal de være adskiller sig i deres størrelse, afgifter eller andre molekylære funktioner. Kvantificering af ligand koncentrationer i mindre bindende strategier er imidlertid en vanskelig opgave. Radioaktive mærkning af liganden har ofte været nødvendige for at påvise en lav koncentration af bundne ligand, især hvis betydelige mængder af receptorer ikke var tilgængelige eller økonomisk overkommelig. Desuden, receptor-bundet ligand kan adskille under og efter isolation i en ikke uvæsentlig måde. Derfor, komplekse metoder, såsom ligevægt gel filtrering4, kapillær elektroforese5og pulse proteolyse6, er forpligtet til at kvantificere receptor-bundet ligand og adskille det fra gratis ligand.
I modsætning til disse bindende assays kræver titrering eksperimenter ikke den kvantitative adskillelse af bundne og gratis ligand. Med henblik herpå, er en receptor på en konstant koncentration titreres med forskellige koncentrationer af tilsat ligand. Af binding til receptoren har den bundne ligand en Biofysisk egenskab, som adskiller det fra den frie ligand og måles ved fx, fotometri, fluorometry eller påvisning af antistof. Således et signal S, som er proportional med mætning udbytte Y og derfor også til koncentration af receptor-bundet ligand (Lb), er registreret som en funktion af den samlede koncentration af tilsat ligand (Lt). Både parametre, signal S og den samlede koncentration af tilsat ligand er kvantificeret i en direkte og lettere måde end koncentrationerne af bundne og gratis ligand. Især, påvisning af receptor-bundet ligand ved enzymmaerket assay (ELISA) tilladt reduktion af prøven diskenheder til under 100 µL og parallelle målinger af flere ligand koncentrationer i multi godt mikrotiter plader. I en titrering ELISA, er en receptor fysisk adsorberet til en mikrotiter plade på den samme koncentration og titreres med opløselige ligand. Receptoren er immobiliseret på plast overfladen hovedsagelig af hydrofobe adsorption. Overflade koncentrationen af immobiliserede receptor korrelerer med belægning koncentrationen af receptor i en ikke-lineær relation, sandsynligvis efter Langmuir´s adsorption isoterm7. Ud over det samlede antal adsorberet receptor molekyler er deres aktivitet tilstand en anden vigtig parameter for titreringen assays. Kun immobiliseret receptorer, som har bevaret ligand bindende aktivitet, er relevante for titreringen assay og i sidste ende bidrager til den samlede koncentration af aktive receptorer Rt af titrering assay, som ikke kan bestemmes direkte.
Websteder på plastik overflade, som ikke er omfattet af immobiliserede receptoren er tilbøjelige til adsorberes andre proteiner, som liganden. Fysiske adsorption af ligand til sådanne plastik overflade seværdigheder ville resultere i en lignende signal som receptor-bundet ligand, men i en uspecifik måde. At reducere denne uspecifik signal, de plastik overflade seværdigheder i mikrotiter plader, som ikke er blevet belagt med protein endnu vil blive blokeret med bovint serumalbumin (BSA). Men for nogle receptor-ligand titrering assays, uspecifik baggrund signaler kan observeres. Derefter, andre blokerende stoffer, såsom en løsning af 0,2% gelatine eller 0,04% Tween 20, anbefales.
Efter binding til receptoren fjernes den gratis ligand ved to vaske trin. Bundne ligand forbliver hos den receptor, som er immobiliseret mikrotiter godt plastic overflade, og eventuelt styrket af kemisk fiksering. For de efterfølgende kovalente cross-sammenkædning af bundne ligand og immobiliseret receptor med glutaraldehyd, buffer stof TRIS erstattes for HEPES, uden ændring af ligand bindende. HEPES, i modsætning til TRIS, ikke inaktivere glutaraldehyd. Den kovalente cross-kobling med glutaraldehyd løser den bundne ligand med dens receptor og forhindrer dens dissociation under efterfølgende vask og inkubering trin. Således, receptor-ligand interaktion er kemisk frosset og garanterer en titreringskurven, som er upåvirket af efterfølgende trin af vask og inkubation. Glutaraldehyd fiksering kan dog kemisk ændre ligand og receptor på en sådan måde, at deres interaktion er reduceret eller afskaffet. Desuden, ændring af epitoper inden for liganden kan ændre bindingsaffinitet afsløre antistof, især hvis et monoklonalt antistof, der bruges til at kvantificere bundne ligand. Selv om ingen af disse negative virkninger af glutaraldehyd fiksering sker i denne titrering ELISA, skal følsomheden af test mod glutaraldehyd testes for hver receptor-ligand interaktion forud for titreringen eksperiment. Efter fiksering fjernes overskydende glutaraldehyd i tre vaske trin med TRIS-holdige buffer. TRIS inaktiverer resterende aldehyd grupper, som kan nonspecifically reagerer med påvisning af antistoffer i de efterfølgende trin.
Mængden af bundne ligand er kvantificeret med enzym-forbundet antistoffer, som giver et fotometrisk ELISA signal S. Dette er afbildet versus den samlede ligand koncentration Lt føjet til hver brønd. På trods af sin lettere erhvervelse er titreringskurven ikke hyperbolske funktion i modsætning til den bindende kurve. Derudover har det været uklart hvordan man beregner dissociationskonstant K fra en titreringskurven. Selvom algoritmer til linearize hjælp erhvervede titrering kurver er indberettet uafhængigt af Stockell8 og Heyn og Weischet9, de kom til kort på grund af deres usikkerhed på estimering af den maksimale signal værdi, som den mætning udbytte tilgange ved høje koncentrationer af tilsat ligand.
Her, er en titrering ELISA og en ikke-lineær regression algoritme beskrevet til at udlede dissociationskonstant K for en receptor ligand interaktion fra en titreringskurven. Denne protokol er eksemplificeret for samspillet mellem kollagen-bindende A-domæne integrin α2β1 med en snake venom-afledte hæmmer. Integriner er celle adhæsionsmolekyler, der mægle forankring af celler til den omkringliggende ekstracellulære matrix eller det underliggende basalmembranen10,11. Derudover formidle integriner vigtige signaler mellem celler og den ekstracellulære matrix ved at rekruttere yderligere signalering molekyler og danner nye celle organeller, adhesomes, på celle-matrix interaktion12,13, 14. kollagen, ligand i α2β1 Integra, er den mest rigelige protein af det menneskelige legeme og er en afgørende stilladser bestanddel af bindevæv15. Samspillet mellem α2β1 integrin og kollagen er medieret af A-domæne af integrin en2 subunit. Integrin α2A-domænet indeholder en divalent kation, der er nødvendig for kollagen bindende og stabiliserer dens struktur. Wild-type form samt mutanter af domænet α2A, som, hvori den overflade-eksponerede rest Y216 var blevet udskiftet for en glycin, kan nemt produceret recombinantly i en bakteriel ekspressionssystem og isoleret via deres oligo-hans-tags med en NiNTA SuperFlow kolonne med en efterfølgende dialyse mod TRIS-bufferet saltvand (TBS; 50 mM TRIS/HCl, pH 7,4, 150 mM NaCl) indeholdende 2 mM MgCl216. Deres koncentrationer blev fastsat med bicinchoninic syre assay (BCA) og deres purities er testet af konventionelle SDS-PAGE og farves med Coomassie-Brilliant blå R250.
Samspillet mellem α2β1 integrin og kollagen er blokeret af bindingen af snake venom komponent, rhodocetin, fra Malaysisk pit viper (Calloselasma rhodostoma)16,17. Bruges som en opløselig ligand i denne titrering ELISA, rhodocetin blev renset fra rå venom som beskrevet tidligere16. Det er opløst i HEPES-bufferet saltvand (HBS; 10 mM HEPES/NaOH, pH 7,4, 150 mM NaCl) og opbevares frosset ved-20 ° C. Dets koncentration var bestemt af BCA og dens renhed var bevist af SDS-PAGE. Som en antagonist, rhodocetin ikke kun blokerer kollagen binding til integrin α2β1 A-domæne, men også stabiliserer den inaktive kropsbygning af integrin derved forhindre enhver signalering fra kollagen i celler eller blodplader18. Det er af stor biomedicinsk betydning til at bestemme dissociationskonstant af rhodocetin med sit receptor mål og dermed udrede sin molekylære mekanisme og farmaceutiske potentielle fxsom antitrombotisk agent. Til dette formål, en titrering ELISA er beskrevet herunder dens evaluering, som er gælder for næsten enhver receptor-ligand interaktion med en 1:1 interaktion støkiometrisk.
Protocol
Representative Results
Discussion
Titrering ELISA er en alsidig testsystem til at bestemme dissociation af en receptor-ligand interaktion. Som titreringen ELISA omgår nødvendighed at adskille frie og bundne ligander effektivt og at analysere deres koncentrationer kvantitativt betydeligt flere undersøgelser og publikationer har ansat titrering ringprøver i stedet for optagelse bindende kurver . Desuden titrering ringprøver er nemme at udføre og kræver forholdsvis lavt beløb af receptor og ligand. For nøjagtig analyse af dissociation konstanter, s…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Protokol og algoritme blev udviklet inden for et projekt finansieret af Deutsche Forschungsgemeinschaft (DFG grant SFB1009 A09 og EB177/13-1). Forfatteren tak Barbara Schedding og Felix Schmalbein for teknisk support og Dr. Niland for kritisk læsning af manuskript.
Materials
| TRIS | neoFrox | 1125KG001 | |
| HEPES | Sigma-Aldrich | H4034 | |
| NaCl | Applichem | 1,316,591,214 | |
| MgCl2 | Merck | 172571 | |
| integrin a2A, wild-type and mutant, recombinant | isolated in author's lab | ||
| NiNTA superflow column | Qiagen, Germany | 30821 | |
| Coomassie-Brilliant Blue R250 | Serva | 35050 | |
| bicinchoninic acid assay (BCA), protein concentration determination kit | Fisher Scientific | 23225 | |
| bovine serum albumine (BSA), fraction V | Applichem | A1391 | |
| 25 % solution of glutaraldehyde | Merck | 354400 | |
| anti-rabbit immunglobulin-antibodies from goat, conjugated with alkaline phosphatase | Sigma-Aldrich | A9919 | |
| Glycine | Applichem | A1377 | |
| Zn(II)-acetate | Applichem | A4324 | |
| NaOH | Applichem | A1551 | |
| Alkaline phosphatase substrate tablet (5 mg) | Sigma-Aldrich | S0942 | |
| Costar half-area microtiter plate | Thermo Scientific | Corning 3690 | |
| micro reaction tubes | Eppendorf | 30120086 | |
| Microplate ELISA reader | BioTek | Synergy HT |
References
- Klotz, I. M. The application of the law of mass action to binding by proteins; interactions with calcium. Arch Biochem. 9, 109-117 (1946).
- Klotz, I. M. Ligand-receptor complexes: origin and development of the concept. J Biol Chem. 279 (1), 1-12 (2004).
- Bisswanger, H. Ch. 1: Multiple Equilibria, Principles and Derivations. Enzyme Kinetics: Principles and Methods. , 1-26 (2017).
- Shimura, K., Kasai, K. Affinity gel titration: quantitative analysis of the binding equilibrium between immobilized protein and free ligand by a continuous titration procedure. Anal Biochem. 149 (2), 369-378 (1985).
- Gong, M., Nikcevic, I., Wehmeyer, K. R., Limbach, P. A., Heineman, W. R. Protein-aptamer binding studies using microchip affinity capillary electrophoresis. Electrophoresis. 29 (7), 1415-1422 (2008).
- Hanes, M. S., Ratcliff, K., Marqusee, S., Handel, T. M. Protein-protein binding affinities by pulse proteolysis: application to TEM-1/BLIP protein complexes. Protein Sci. 19 (10), 1996-2000 (2010).
- Latour, R. A. The Langmuir isotherm: a commonly applied but misleading approach for the analysis of protein adsorption behavior. J Biomed Mater Res A. 103 (3), 949-958 (2015).
- Stockell, A. The binding of diphosphopyridine nucleotide by yeast glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem. 234 (5), 1286-1292 (1959).
- Heyn, M. P., Weischet, W. O. Circular dichroism and fluorescence studies on the binding of ligands to the α subunit of tryptophan synthase. Biochem. 14 (13), 2962-2968 (1975).
- Campbell, I. D., Humphries, M. J. Integrin structure, activation, and interactions. Cold Spring Harb Perspect Biol. 3 (3), (2011).
- Zeltz, C., Gullberg, D. The integrin-collagen connection–a glue for tissue repair?. J Cell Sci. 129 (4), 653-664 (2016).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468 (7323), 580-584 (2010).
- Luo, B. H., Carman, C. V., Springer, T. A. Structural basis of integrin regulation and signaling. Annu Rev Immunol. 25, 619-647 (2007).
- Luo, B. H., Springer, T. A. Integrin structures and conformational signaling. Curr Opin Cell Biol. 18 (5), 579-586 (2006).
- Ricard-Blum, S. The collagen family. Cold Spring Harb Perspect Biol. 3 (1), a004978 (2011).
- Eble, J. A., Tuckwell, D. S. The α2β1 integrin inhibitor rhodocetin binds to the A-domain of the integrin α2 subunit proximal to the collagen-binding site. Biochem J. 376 (Pt 1), 77-85 (2003).
- Eble, J. A., et al. The α2β1 integrin-specific antagonist rhodocetin is a cruciform, heterotetrameric molecule. FASEB J. 23 (9), 2917-2927 (2009).
- Eble, J. A., et al. Dramatic and concerted conformational changes enable rhodocetin to block α2β1 integrin selectively. PLoS Biol. 15 (7), e2001492 (2017).
- Bracht, T., Figueiredo de Rezende, F., Stetefeld, J., Sorokin, L. M., Eble, J. A. Monoclonal antibodies reveal the alteration of the rhodocetin structure upon α2β1 integrin binding. Biochem J. 440 (1), 1-11 (2011).
- Harlow, E., Lane, D. Chapter 5: Immunizations. Antibodies, a laboratory manual. 5, 53-138 (1988).
- Lu, D. Analyzing interactions between SSB and proteins by the use of fluorescence anisotropy. Methods Mol Biol. 922, 155-159 (2012).
- Fielding, L. NMR methods for the determination of protein-ligand dissociation constants. Curr Top Med Chem. 3 (1), 39-53 (2003).
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr Opin Struct Biol. 11 (5), 560-566 (2001).
- McDonnell, J. M. Surface plasmon resonance: towards an understanding of the mechanisms of biological molecular recognition. Curr Opin Chem Biol. 5 (5), 572-577 (2001).
- Rich, R. L., Myszka, D. G. Advances in surface plasmon resonance biosensor analysis. Curr Opin Biotechnol. 11 (1), 54-61 (2000).
- Pesquero, N. C., et al. Real-time monitoring and kinetic parameter estimation of the affinity interaction of jArtinM and rArtinM with peroxidase glycoprotein by the electrogravimetric technique. Biosens Bioelectron. 26 (1), 36-42 (2010).
- Scheuermann, T. H., Padrick, S. B., Gardner, K. H., Brautigam, C. A. On the acquisition and analysis of microscale thermophoresis data. Anal Biochem. 496, 79-93 (2016).

