Polyamine 기반 펩타이드 Amphiphiles (PPAs) 및 관련된 생체 자기 조립의 합성에 대 한 손쉬운 프로토콜
Summary
Polyamine 기반 펩타이드 amphiphiles (PPAs)의 합성은 이러한 반응 기능 마스크 그룹 보호의 사리 분별이 사용 여러 아민 nitrogens의 존재로 인해 중요 한 도전 이다. 이 문서에서 우리는 자기 조립 분자의 이러한 새로운 클래스의 준비에 대 한 손쉬운 방법을 설명합니다.
Abstract
펩 티 드 Amphiphiles polyamine 기반 (PPAs) 자가 조립 amphiphilic 펩 티 드 amphiphiles (Pa)에 바이오 관련의 새로운 클래스는. 전통적인 파 소유 그룹 (리 신, 아르기닌), 지질 세그먼트에 직접 연결 하거나 중립 아미노산의 링커 지구를 포함할 수 있습니다 solubilizing로 충전된 아미노산. 파의 펩 티 드 순서를 조정 하는 것은 다양 한 형태학 얻을 수 있습니다. 마찬가지로, PPAs 소수 성 세그먼트 및 중립 아미노산, 하지만 또한 물 (친수성) 그룹 solubilizing polyamine 분자를 포함. 파로 PPAs 때 물속에에서 녹아 있는 작은 봉, 트위스트 나노-리본, 및 융합된 나노 시트, 포함 한 다양 한 형태학에 자체 조립 또한 수 있습니다. 그러나, 단일 polyamine 분자에 1 차 및 이차 아민의 존재 PPAs 합성 때 상당한 도전 포즈. 이 문서에서 우리는 단단한 단계 펩 티 드 합성 (SPPS)을 사용 하 여 PPAs의 손쉬운 합성을 달성 하기 위해 문학 판례에 따라 간단한 프로토콜을 보여줍니다. 이 프로토콜은 우선권 및 다른 유사한 시스템의 합성에 확장할 수 있습니다. 우리는 또한 수 지, 식별 및 정화에서 분열에 필요한 단계를 보여 줍니다.
Introduction
자가 조립 펩 티 드 amphiphiles (Pa)는 일반적으로 다음 세그먼트의 구성 하는 생체 재료의 클래스: (a) 친수성 머리, (b) 링커 지역, 및 (c) 소수 성 꼬리. 대부분 파 문학에 설명 된 충전 또는 극 지 아미노산 잔류물1,2,,34로 구성 된 친수성 머리를 소유한 다. 파 의학 등5, 재생 의학, 질병 진단, 약물 전달 등에서 다양 한 응용 프로그램을 발견 했습니다. 그들의 아미노산 서 열을 바탕으로, 파 nanostructures 구형 micelles 나노 필 라 멘 트 등의 다양 한을 형성할 수 있다. 우리 최근 하이브리드 polyamine 기반 펩타이드 amphiphiles, PPAs6나의 클래스를 보고 있다. 형태학, 자가 조립 속도 론, 그리고이 생체의 대사 저하 solubilizing 머리 그룹 그들의 관련을 발견 했다. 또한, PPA nanostructures 테스트 농도에 포유류 세포 (MiaPaCa2 그리고 HeLa 세포 라인)으로 독성을 보여주지 않았다. PPA 기반 nanocarriers는 매력적인 마약 배달 차량 때문에: (1) polyamine 통풍 및 대사 암 세포 증가 표시 되었습니다, (2) 양이온 nanostructures endosomal 탈출7,8을 달성할 수 있다 높은 순환 및 셀, 및 (3) 그들은 PA;와 비교할 때 다른 신진 대사 프로필 있어야 내 거주에 이르게 예를 들어 그들은 인간의 신체에서 발견 하는 프로 테아 제 쪽으로 더 안정 될 것입니다 (비록 그들은 어쩌면 아민 oxidases 같은 다른 효소에 민감한)9,10. 또한, PPAs 다양 한 형태학, 물리 화학적 특성, 나노 강성 및 길이 개별 PPA 분자6의 요금에 따라 조립 활동 발견 되었습니다. 여기, 우리는 합성, 식별 및 파 또는 유사한 하이브리드 펩 티 드 분자의 준비에도 적용 될 수 있는 PPAs의 정화에 대 한 상세한 프로토콜을 설명 합니다.
Polyamines는 일반적으로 그들의 보호 된 형태로 상업적으로 사용할 수 있기 때문에 고 이므로 polyamines의 1 차 및 이차 아민 보호 우리 설명 아미노산 및 다른 분자 들을 변화에 대 한 매우 중요 합니다 그들의 보호를 달성 하기 위해 합성 단계입니다. 이 프로토콜의 전반적인 목표 polyamines 아미노산을 변화에 대 한 간단한 방법을 제공 하는 것입니다. Polyamines 부족 carboxylic 그룹; 따라서, 그들은 링크 아 미드 또는 왕 수 지에 결합 될 수 없습니다. 대신, 2 chlorotrityl 염화 비닐 등 수 지 합성 프로토콜에 대 한 권장 됩니다. PPA 합성에 대 한 주요 도전 1 차 및 이차 아민 기능적인 그룹의 존재 이다. 우리의 목적을 위해 우리는 커플링 반응 수 있도록 무료 polyamine에 기본 아미노 그룹을 유지 하면서는 polyamine에 모든 이차 아민 보호. 반응 고체 지원 각 커플링 및 deprotection 단계 후 작업 업 촉진 하기 위하여 단단한 단계 펩 티 드 종합 (SPPS)의 원칙에 따라 이루어졌다. 다음 프로토콜은 PPAs의 수동 및 자동 합성에 대 한 (비록 몇 가지 단계의 검증 자동화 시스템에 도전 것입니다). 이러한 분자의 합성도 실행 될 수 있다 밖으로 자동된 합성기에 또는 전자 레인지 반응 기의 도움으로 (자동 또는 반자동). 반응 체계는 그림 1에 요약 되었습니다.
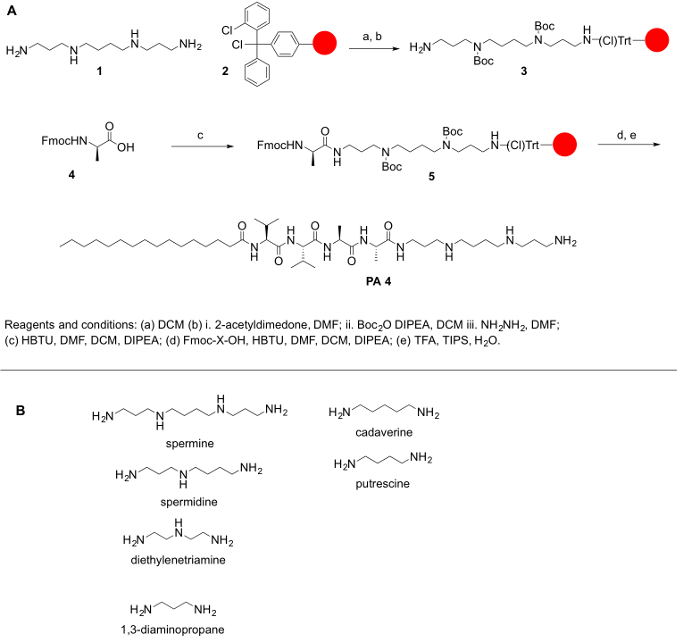
그림 1: (A) A PPAs의 합성에 대 한 일반적인 반응 체계. 하는 데 사용 될 수 있는 (B) 대표 polyamines PPAs 여기에 설명 된 합성. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
합성 파로 우물 및 펩타이드 기반 분자 (하이브리드 PA-peptoids) 등 관련 PPAs 하 여기에 설명 된 프로토콜을 사용할 수 있습니다. SPPS를 사용 하 여 펩 티 드의 합성은 간단한 절차, 생물학 유도 분자를 포함 하는 펩 티 드의 종합 특히 도전 수 있습니다. Polyamines spermine, spermidine, diethyelenetriamine, 등, 유도 분자 암 세포13타겟팅으로 작동할 수 있습니다. PPAs 자체 다양 한 형태학<sup…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 프로젝트는 네브라스카 대학 의료 센터 (창업 자금, MC S);에 의해 투자 되었다 NIH-COBRE, 5P20GM103480 (T. Bronich) 및 미국 화학 학회, PRF # 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

