Microscopie spectrale réflectométrique sur les axones myélinisés In Situ
Summary
Nous présentons ici un protocole étape par étape pour l’imagerie des axones myélinisés dans une tranche de cerveau fixe à l’aide d’une échelle nanométrique exempte d’étiquette d’imagerie technique basée sur la réflectométrie spectrale.
Abstract
Dans un système nerveux des mammifères, la myéline fournit une isolation électrique par Envellopants les fibres axonales dans une spirale de multicouche. Inspiré par son architecture sous-cellulaire très organisés, nous avons récemment développé une nouvelle modalité d’imagerie, nommée réflectométrie spectrale (diffuseurs), qui permet l’imagerie nanométriques de label-free sans précédent de l’ axones myélinisés live in situ. Le principe sous-jacent est d’obtenir des informations de la nanostructure en analysant le spectre de réflectance de la structure multicouche subcellulaire. Dans cet article, nous décrivons un protocole détaillé étape par étape pour réaliser une imagerie de diffuseurs de base des tissus nerveux à l’aide d’un système microscopique confocal commercial, équipé d’un laser de lumière blanche et d’un filtre accordable. Nous couvrons les procédures de préparation des échantillons, acquisition de données spectrales et traitement d’image pour obtenir des informations de nanostructure.
Introduction
Dans le système nerveux des mammifères, la myéline fournit la conduction nerveuse rapide et intégrité axonale par Envellopants les fibres axonales avec gaines membraneuses multicouches. Sa structure multicouche est composé d’une alternance de minces nanométriques composées de membranes plasmiques (~ 5 nm), cytosol (environ 3 nm) et les espaces extracellulaires (~ 7 nm)1,2. La microscopie optique, y compris la microscopie de Super-résolution récente, ne conviennent pas pour l’observation de la dynamique de la myéline échelle nanométrique en raison de leur résolution insuffisante en raison de la diffraction optique3,4,5. Bien que la microscopie électronique peut fournir des détails de la nanostructure de myéline, ce n’est pas compatible avec les systèmes biologiques vivants en raison des préparations très envahissante impliquant la fixation chimique et ultrasectioning6,7 . Jusqu’à tout récemment, il n’y a eu aucune technique il y a lieu d’observer nanométriques dynamique des axones myélinisés in situ.
Schain et coll. a déjà signalé que les axones myélinisés présentent8de la réflexion de la lumière colorée. En adoptant l’analyse spectroscopique de la lumière réfléchie, nous avons mis au point une nouvelle modalité d’imagerie pour l’imagerie nanométrique des axones myélinisés, nommé réflectométrie spectrale (diffuseurs)9. Diffuseurs repose sur l’ingérence de minces qui se produisent dans la structure multicouche de la gaine de myéline (Figure 1). Par simulation optique sur les axones différents, nous avons révélé que le spectre de réflectance est une fonction périodique de nombre d’onde et sa périodicité (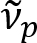 ) est inversement proportionnelle au diamètre de l’axone (d). Cette relation simple (
) est inversement proportionnelle au diamètre de l’axone (d). Cette relation simple (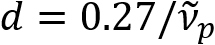 ) propose une quantification du diamètre de l’axone d’après les données de diffuseurs. Grâce à cela, nous avons révélé l’axone répandue renflement sous léger traumatisme crânien dans notre rapport précédent.
) propose une quantification du diamètre de l’axone d’après les données de diffuseurs. Grâce à cela, nous avons révélé l’axone répandue renflement sous léger traumatisme crânien dans notre rapport précédent.
Le système de diffuseurs repose sur la microscopie confocale et se compose d’une source laser spécialisés et filtre (Figure 2). La source d’entrée est un laser de lumière blanche, fournissant une sortie à large bande spectrale visible à l’infrarouge. Pour l’analyse spectrale, le système est muni de deux dispositifs acousto-optiques : un filtre accordable acousto-optique (AOTF) pour fournir une longueur d’onde sélectionnée de la source à large bande d’entrée et un séparateur de faisceau d’acousto-optique (AOBS) pour guider les sélectionnés reflétés longueur d’onde du détecteur. Le logiciel pour la microscopie confocal hyperspectrales (voir Table des matières) fournit une option de balayage spectral personnalisable d’acquérir dans l’ordre les images de réflectance à différentes longueurs d’onde d’entrée. Par ailleurs, l’aberration chromatique peut gravement interférer dans la mesure spectrale ; par conséquent, l’utilisation d’une lentille d’objectif apochromat est recommandée.
À noter, lumière blanche lasers produisent une sortie spectrale inégale et les composants optiques affectent également le profil spectral. Par conséquent, les spectres acquis doivent être calibrées pour l’analyse quantitative ultérieur. Un miroir argent protégé est généralement utilisé comme référence, qui offre une réflexion presque constante (> 97 %) au-dessus de la région complètement visible. Les spectres acquis sont ensuite divisés par les spectres de référence par le miroir.
La taille de palier spectrale pour l’analyse spectrale détermine la vitesse d’acquisition ; ainsi, il doit être optimisé. Comme un axone plus grande et dispose d’un délai spectral plus élevé, il faut plus fine de l’échantillonnage spectral. Par exemple, un axone d’un diamètre de 10 µm, une des axones physiologiques plus grands, dispose d’un délai spectral de ~ 8 nm. En appliquant les critères d’échantillonnage de Nyquist, nous avons utilisé l’intervalle d’échantillonnage spectral de 4 nm pour couvrir tous les axones physiologiques dans les tissus nerveux de la souris. Cette approche prend généralement plus de quelques secondes pour un scan complet spectral et donc n’est pas adaptée pour des applications in vivo , où le mouvement physiologique (p. ex. respiration et rythme cardiaque) s’ingère acquisition spectrale stable. Précédemment, nous avons résolu ce problème en instrumentant un microscope droit sur mesure, conçu pour acquérir le spectre complet pour chaque point à l’aide d’un spectromètre de tableau (acquisition Vitesse ≈ 30 ms par pixel).
Dans ce rapport, nous décrivons un protocole détaillé sur l’imagerie de diffuseurs sur une tranche fixe de cerveau, qui peut être effectuée dans un microscope hyperspectral commerciale (voir Table des matières). Ainsi, le protocole peut être complété par les expérimentateurs sans expertise en instrumentation optique. Nous couvrons également les problèmes potentiels et dépannage pour l’acquisition et l’analyse des données de diffuseurs.
Protocol
Representative Results
Discussion
Diffuseurs est une nouvelle modalité d’imagerie exempte d’étiquette basée sur l’interférométrie spectrale, qui pour la première fois, offre l’information de l’échelle nanométrique dans les axones myélinisés direct. Dans le protocole actuel de l’acquisition, la résolution spatiale pour le diamètre de l’axone est de l’ordre de 10 nm. En outre, diffuseurs utilise des ordres de grandeur plus faible dose légère par rapport aux autres microscopies de Super-résolution ; Il est donc exempt de phot…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par l’Institut de sciences fondamentales (IBS-R015-D1) et de base programme de recherche scientifique grâce à la Fondation de la recherche nationale de Corée (NRF) financé par le ministère de l’éducation (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

