מיקרוסקופ Reflectometric ספקטרלי ב ו דנדריטים בחיי עיר
Summary
כאן, אנו מציגים עבור הדמיה ו דנדריטים בפרוסה המוח קבוע באמצעות ננו ללא תווית הדמיה הטכניקה מבוססת על reflectometry ספקטרלי פרוטוקול צעד אחר צעד.
Abstract
במערכת העצבים יונקים, המיאלין מספק בידוד חשמלי על-ידי enwrapping הסיבים האקסון ספירלה מרובה שכבות. בהשראת הארכיטקטורה subcellular-מאורגן, לאחרונה פיתחנו מודאליות הדמיה חדשה, בשם ספקטרלי reflectometry (SpeRe), המאפשרת הדמיה ננו ללא תווית חסרת תקדים של חיה ו דנדריטים בתוך באתרו. העיקרון הבסיסי הוא לקבל מידע nanostructural על-ידי ניתוח הספקטרום השתקפות של המבנה subcellular מרובה שכבות. במאמר זה, אנו מתארים פרוטוקול מפורט שלב אחר שלב לביצוע של הדמיה SpeRe בסיסיים של רקמות עצבים משתמש מסחרי במערכת מיקרוסקופיים קונאפוקלית, מצוידים לייזר אור לבן, מסנן tunable. אנחנו מכסים את תהליכי הכנת הדוגמא, רכישת נתונים ספקטרלי, עיבוד להשגת מידע nanostructural תמונה.
Introduction
במערכת העצבים יונקים, המיאלין מספק גיאן מהירה ותקינות עצב על-ידי enwrapping הסיבים האקסון עם מעילי פרווה עלי הלוואי קרומיים מרובה שכבות. מבנהו מרובה שכבות מורכב לסירוגין הננומטרי דק-סרטים של ממברנות פלזמה (~ 5 nm), ציטוזול (~ 3 ננומטר), ורווחים חוץ-תאית (~ 7 ננומטר)1,2. מיקרוסקופ אופטי, כולל את מיקרוסקופ ברזולוציה-העל האחרונה, אינם מתאימים להתבוננות הדינמיקות המיאלין הננומטרי בשל הרזולוציה שלהן לא מספיק בשל עקיפה אופטי3,4,5. למרות מיקרוסקופ אלקטרונים יכול לספק פרטים עדינים של ננו-מבנה המיאלין, זה לא תואם עם המערכות הביולוגיות חיים עקב ההכנות מדגם פולשני ביותר מעורבים קיבוע כימי ו ultrasectioning6,7 . עד לאחרונה היו לא טכניקה ישים להתבונן הננומטרי דינמיקת ו דנדריטים באתרו בתוך.
. Schain et al. דיווח בעבר ו דנדריטים התערוכה השתקפות אור צבעוני8. על ידי אימוץ הניתוח spectroscopic על האור המוחזר, אנחנו תכנן מודאליות הדמיה חדשה עבור ננו הדמיה של ו דנדריטים, בשם ספקטרלי reflectometry (SpeRe)9. SpeRe מבוסס על ההפרעות סרט דק המתרחשים במבנה רב שכבתית של למעטפת מיאלין (איור 1). על ידי הדמיה אופטיים על אקסונים שונים, נחשפו כי הקשת השתקפות היא פונקציה מחזורית של מספר גל תקופתיות שלה (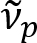 ) הוא ביחס הפוך ל קוטר האקסון (d). מערכת היחסים הזו פשוטה (
) הוא ביחס הפוך ל קוטר האקסון (d). מערכת היחסים הזו פשוטה (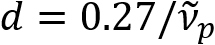 ) מציע נתיישב כימות של קוטר האקסון של הנתונים SpeRe. ניצול זה, חשפנו את האקסון ונפוצים בולטות תחת פציעת מוח טראומטית קלה בדוח הקודם שלנו.
) מציע נתיישב כימות של קוטר האקסון של הנתונים SpeRe. ניצול זה, חשפנו את האקסון ונפוצים בולטות תחת פציעת מוח טראומטית קלה בדוח הקודם שלנו.
מערכת SpeRe מבוסס מיקרוסקופיה קונפוקלית מורכב מקור לייזר מיוחדים, מסננים (איור 2). מקור קלט הוא לבן-אור לייזר, מתן הפס הרחב פלט ספקטרלי הגלויים לאזורים אינפרא-אדום. עבור הסריקה ספקטרלי, המערכת הינו מצויד עם שני התקנים אקוסטו אופטי: אקוסטו אופטי tunable מסנן (AOTF) להעברת אורך גל שנבחרו מן המקור פס קלט של הפיצול קרן אקוסטו אופטי (AOBS) עבור המנחה שנבחר משתקפת גל את הגלאי. התוכנה עבור היפרספקטרליות מיקרוסקופיה קונפוקלית (ראה טבלה של חומרים) מספק אפשרות להתאמה אישית סריקה ספקטרלי לרכוש ברצף התמונות השתקפות קלט באורכי גל שונים. בנוסף, אברציה כרומטית יכול להתערב באורח קשה במדידה ספקטרלי; לכן, השימוש העדשה המטרה עדשה אפוכרומטית מומלץ.
ראוי לציין, אור לבן לייזרים לייצר פלט ספקטרלי לא אחידה, רכיבים אופטיים גם להשפיע על הפרופיל ספקטרלי. לכן, ספקטרום רכשה לכייל לניתוח כמותי עוקבות. מראה כסוף מוגן משמש בדרך כלל כנקודת התייחסות, אשר מספק של השתקפות כמעט קבוע (> 97%) השתלטה על האזור מלא גלוי. ספקטרום שנרכשו לאחר מכן מחולקים לפי ספקטרום הפניה מן המראה.
גודל הצעד ספקטרלי עבור הסריקה ספקטרלי קובעת את מהירות הרכישה; לכן, זה צריך להיות מותאם. כמו האקסון גדולים יותר יש תקופה ספקטרלי גבוה יותר, זה דורש עדין ספקטרלי הדגימה. לדוגמה, האקסון בקוטר של 10 מיקרומטר, אחד האקסונים הפיזיולוגיות הגדול, יש תקופה ספקטרלי של ~ 8 nm. על-ידי החלת קריטריונים הדגימה של נייקוויסט, אנחנו מועסקים את מרווח הדגימה ספקטרלי של 4 nm כדי לכסות כל האקסונים הפיזיולוגיות ברקמות העכבר לחוץ. גישה זו נמשכת בדרך כלל במשך מספר שניות לקבלת סריקה מלאה ספקטרלי, ולכן הוא לא מתאים ליישומי ויוו , איפה הפיזיולוגיות תנועה (למשל נשימה ואת קצב לב) משבש את רכישת ספקטרלי יציב. בעבר פתרנו בעיה זו על-ידי instrumenting מיקרוסקופ זקופה המותאמת אישית, שנועדה להשיג את ספקטרום מלא עבור כל נקודה באמצעות ספקטרומטר של המערך (≈ מהירות של רכישת 30 ms לפיקסל).
בדו ח זה, אנו מתארים פרוטוקול מפורט על ההדמיה SpeRe על פרוסה המוח קבוע, אשר ניתן לבצע במיקרוסקופ היפרספקטרליות המסחרי (ראה טבלה של חומרים). כך, הפרוטוקול יכול להתבצע על ידי ניסויים ללא התמחות במכשור אופטי. אנחנו גם לכסות את בעיות אפשריות לפתרון בעיות עבור רכישת וניתוח של נתונים SpeRe.
Protocol
Representative Results
Discussion
SpeRe הוא חדש ללא תווית הדמיה מודאליות בהתבסס על אינטרפרומטריה ספקטרלי, המציעה בפעם הראשונה, את המידע הננומטרי בשידור חי ו דנדריטים. בפרוטוקול הנוכחי רכישה, הרזולוציה המרחבית עבור קוטר האקסון הוא מסדר 10 ננומטר. יתר על כן, SpeRe מנצל הזמנות-הגודל של ערכים מינון אור נמוך יותר בהשוואה microscopies סופר ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכון בסיסי למדע (IBS-R015-D1), על-ידי תוכנית מחקר מדעי בסיסי דרך לאומי מחקר קרן של קוריאה (ב- NRF) ממומן על ידי משרד החינוך (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

