Спектральная Рефлектометрические микроскопия на Миелинизированные аксоны в Situ
Summary
Здесь мы представляем пошаговые протокол для визуализации Миелинизированные аксоны в кусочек фиксированной мозга, используя ярлык свободный наноразмерных изображения метод, основанный на спектральные рефлектометрии.
Abstract
В млекопитающих нервной системы миелина обеспечивает электрической изоляции, обертыванием аксон волокон в многослойных спираль. Вдохновленный архитектурой субцеллюлярные высоко организованной, мы недавно разработали новый механизм визуализации, именем спектральных рефлектометрии (сфере), который позволяет беспрецедентную лейбл свободных наноразмерных изображений живой Миелинизированные аксоны в situ. Основополагающий принцип заключается в получении информации наноструктурных, проанализировав отражения спектр многослойных субцеллюлярные структуры. В этой статье мы опишем подробные пошаговые протокол для выполнения основной сфере изображений нервных тканей, с использованием коммерческих конфокальный микроскопические системы, с белый свет лазера и перестраиваемый фильтр. Мы охватывают процедуры пробоподготовки, приобретение спектральных данных и обработки для получения сведений о наноструктурных изображений.
Introduction
В нервной системе млекопитающих миелина обеспечивает быстрое нервной проводимости и аксональной целостность, обертыванием аксон волокон с многослойных мембранных влагалищ. Многослойная структура состоит из чередующихся наноразмерных тонких пленок-состоящий из плазменных мембран (~ 5 Нм), цитозоле (~ 3 Нм) и внеклеточного пространства (~ 7 Нм)1,2. Оптическая микроскопия, включая недавние суперразрешением микроскопии, не подходят для наблюдений за наноразмерных миелина динамика из-за их недостаточной резолюции вследствие дифракции3,4,5. Хотя электронная микроскопия может предоставить мелких деталей из наноструктурированных миелина, это не совместимо с живых биологических систем из-за очень инвазивных образец подготовки с участием химической фиксации и ultrasectioning6,7 . До недавнего времени, там было не техника применяется для наблюдения за наноразмерных динамика Миелинизированные аксоны в situ.
Schain et al. ранее сообщалось, что Миелинизированные аксоны exhibit красочные светоотражения8. Приняв спектроскопического анализа на отраженный свет, мы разработали новый механизм изображений для визуализации наноразмерных Миелинизированные аксонов, названный спектральных рефлектометрии (сфере)9. Сфере на основе тонкопленочных вмешательства, происходящих в многослойной структуре Миелиновые оболочки (рис. 1). По оптического моделирования на различных аксонов, мы показали, что спектр отражения является периодическая функция волновое и его периодичность (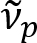 ) пропорциональна аксон диаметр (d). Этот простой отношения (
) пропорциональна аксон диаметр (d). Этот простой отношения (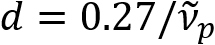 ) предлагает снисходительный количественная оценка диаметра аксона от сфере данных. Используя это, мы показали распространены аксона, выпуклые под легкой черепно-мозговой травмы в нашем предыдущем докладе.
) предлагает снисходительный количественная оценка диаметра аксона от сфере данных. Используя это, мы показали распространены аксона, выпуклые под легкой черепно-мозговой травмы в нашем предыдущем докладе.
Сфере система основана на confocal микроскопии и состоит из специализированных лазерного источника и фильтров (рис. 2). Источник ввода является белый свет лазера, предоставление широкополосного спектральных вывода видимых инфракрасных регионов. Для спектрального сканирования, система оснащена двумя акустооптические устройства: акустооптические перестраиваемый фильтр (AOTF) для доставки выбранной длине волны от источника входного сигнала широкополосные и splitter луча Акусто оптический (AOBS) для руководства выбранного отражение Длина волны до детектора. Программное обеспечение для гиперспектрального confocal микроскопии (см. Таблицу материалы) предоставляет настраиваемый спектрального сканирования вариант последовательно получить отражения изображения на различных длинах волн ввода. Кроме того хроматические аберрации критически может вмешиваться в спектральных измерений; Поэтому рекомендуется использовать Апохромат объектива.
Следует отметить белый свет лазеры производства неравномерным спектральных и оптических компонентов также влияет на спектральные профиль. Таким образом полученные спектры должны быть откалиброваны для последующего количественного анализа. Охраняемых Серебряное зеркало обычно используется как ссылка, которая обеспечивает практически постоянный коэффициент отражения (> 97%) над полностью видимой области. Полученные спектры затем делится на ссылку спектров от зеркала.
Размер спектральных шаг спектрального сканирования определяет скорость приобретения; Таким образом он должен быть оптимизирован. Как большие аксона имеет высокий спектральных период, он требует тонкой спектральных выборки. К примеру, аксон с диаметром 10 мкм, один из крупнейших физиологического аксоны, имеет спектральный период ~ 8 Нм. Применив критерии отбора проб Найквиста, мы заняты спектральный интервал 4 Нм для покрытия всех физиологических аксоны в нервных тканях мыши. Этот подход обычно занимает более нескольких секунд для полного спектрального сканирования и таким образом не подходит для приложений в естественных условиях , где физиологическое движение (например дыхание и сердцебиение) мешает стабильной спектральных приобретения. Ранее мы решили этот вопрос путем инструментирования микроскопом заказной вертикально, предназначена для получения полного спектра для каждой точки, с помощью массива спектрометр (приобретение скорость ≈ 30 мс на пиксель).
В настоящем докладе, мы описываем подробный протокол на сфере изображений на кусочек фиксированной мозга, которые могут быть выполнены в коммерческих гиперспектрального микроскоп (см. Таблицу материалы). Таким образом протокол может быть дополнено экспериментаторов без опыта в оптических приборов. Мы также охватывать потенциальные проблемы и устранение неполадок для сбора и анализа данных сфере.
Protocol
Representative Results
Discussion
Сфере является новый лейбл бесплатная изображений механизм на основе спектральных интерферометрии, который в первый раз, предлагает наноразмерных информацию в прямом Миелинизированные аксоны. В протоколе текущего приобретения, пространственное разрешение для axon диаметр составляет …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержку Института фундаментальной науки (IBS-R015-D1) и основные программы исследований науки через национальных исследований фонда из Кореи (NRF) финансируется министерством образования (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

