Spektral Reflectometric mikroskopi på myeliniserade axoner In Situ
Summary
Här presenterar vi ett stegvisa protokoll för imaging myeliniserade axoner i en fast hjärnan segment med etikett-fri nanoskala imaging teknik utifrån spektrala reflectometry.
Abstract
I ett däggdjur nervsystemet ger myelin en elektrisk isolering genom omsluter axon fibrerna i en multilayered spiral. Inspirerad av sin-organiserade subcellulär arkitektur, vi nyligen utvecklat en ny bildgivande modalitet, heter spectral reflectometry (SpeRe), som ger oöverträffad etikett-fri nanoskala avbildning av den levande myeliniserade axoner i situ. Grundprincipen är att erhålla nanostrukturella information genom att analysera reflektans spectrumen av multilayered subcellulär struktur. I den här artikeln beskriver vi en detaljerad steg för steg-protokoll för att utföra en grundläggande SpeRe avbildning av nervös vävnader med hjälp av ett kommersiellt confocal mikroskopiska system, utrustad med ett vitt ljus laser och en avstämbara filter. Vi täcker förfarandena för provberedning, förvärv av spektrala data och bildbehandling för att erhålla nanostrukturella information.
Introduction
I däggdjur nervsystemet ger myelin snabb nerv överledning och axonal integritet genom omsluter axon fibrerna med multilayered membranös slidor. Dess mångbottnat struktur består av omväxlande nanoskala thin-film består av plasma membran (~ 5 nm), cytosol (~ 3 nm), och extracellulära utrymmen (~ 7 nm)1,2. Optisk mikroskopi, inklusive den senaste super-resolution mikroskopi, lämpar sig inte för att observera nanoskala myelin dynamiken på grund av sin otillräckliga upplösning på grund av optiska diffraktion3,4,5. Även om elektronmikroskopi kan ge fina detaljer av myelin nanostrukturen, är det inte förenligt med de levande biologiska system på grund av mycket invasiva provet preparat som involverar kemiska fixering och ultrasectioning6,7 . Tills nyligen har man ingen teknik gällande att iaktta nanoskala dynamiken i myeliniserade axoner i situ.
Schain et al. rapporterade tidigare att myeliniserade axoner uppvisar färgglada ljusreflektion8. Genom att anta den spektroskopiska analysen på det reflekterade ljuset, har vi utarbetat en ny bildgivande modalitet för nanoskala avbildning av myeliniserade axoner, heter spectral reflectometry (SpeRe)9. SpeRe baseras på tunnfilms-störningar inträffar i flerskiktade strukturen av myelinskidan (figur 1). Av optisk simulering på olika axoner, vi har visat att reflektans spektrumet en periodisk funktion i Vågtal och dess periodicitet (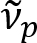 ) är omvänt proportionell mot axon diameter (d). Detta enkla förhållande (
) är omvänt proportionell mot axon diameter (d). Detta enkla förhållande (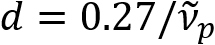 ) erbjuder lättköpt kvantifiering av axon diameter från SpeRe data. Utnyttja detta, avslöjade vi den förhärskande axon Utbuktningen under mild traumatisk hjärnskada i vår föregående rapport.
) erbjuder lättköpt kvantifiering av axon diameter från SpeRe data. Utnyttja detta, avslöjade vi den förhärskande axon Utbuktningen under mild traumatisk hjärnskada i vår föregående rapport.
SpeRe systemet är baserat på konfokalmikroskopi och består av en specialiserad laserkälla och filtrerar (figur 2). Ingångskällan är en vitt ljus laser, att tillhandahålla bredband spektrala utdata synlig infraröd regioner. För spektral skanna, systemet är utrustat med två acousto-optiska enheter: en acousto-optic avstämbara filter (AOTF) för att leverera en vald våglängd från bredband ingångskälla och en acousto-optic stråldelare (AOBS) för vägledande den valda återspeglas våglängd till detektorn. Programvaran för Hyperspektrala konfokalmikroskopi ger (se Tabell för material) en anpassningsbar spektrala skanningsalternativ sekventiellt förvärva reflektans bilderna på olika indata våglängder. Dessutom kan kromatisk aberration kritiskt ingripa i spektral mätning; Därför rekommenderas användning av ett apochromat objektiv.
Notera, vitt ljus lasrar producera en ojämn spektrala utgång och de optiska komponenterna påverkar också den spektrala profilen. Därför behöver de förvärvade spectrana kalibreras för efterföljande kvantitativ analys. En skyddad silver spegel används vanligen som referens, vilket ger en nästan konstant reflexionsfaktor (> 97%) över regionen fullt synliga. De förvärvade spectrana är sedan uppdelade efter referens spektra från spegeln.
Den spektrala steg storleken för spektral Skanna bestämmer hastigheten hos förvärv; Således behöver optimeras. Som en större axon har en högre spektrala period, kräver det finare spektrala provtagning. Ett axon med en diameter av 10 μm, en av de största fysiologiska axoner, har exempelvis en spektral period av ~ 8 nm. Genom att tillämpa Nyquist provtagning kriterier, vi anställt den spektrala provtagningsintervall 4 nm att täcka alla fysiologiska axoner i mus nervös vävnader. Detta tillvägagångssätt tar vanligtvis över flera sekunder för en full spektral scan och därmed är inte lämplig för i vivo applikationer, där fysiologiska rörelse (t.ex. andning och hjärtslag) stör stabil spektrala förvärv. Vi har tidigare löst problemet av instrumentera anpassade upprätt Mikroskop, utformad för att förvärva hela spektrumet för varje punkt med en array spektrometer (förvärv hastighet ≈ 30 ms per pixel).
I den här rapporten beskriver vi ett detaljerat protokoll på SpeRe bildtagning på en fast hjärnan slice, som kan utföras i kommersiella Hyperspektrala Mikroskop (se Tabell för material). Protokollet kan således utföras av praktiker utan sakkunskap i optiska instrumentation. Vi täcker även de potentiella problem och felsökning för förvärv och analys av SpeRe data.
Protocol
Representative Results
Discussion
SpeRe är en ny etikett-fri bildgivande modalitet baserat på spektrala interferometri, som för första gången erbjuder nanoskala informationen i levande myeliniserade axoner. I det aktuella förvärv protokollet, den rumsliga upplösningen för axon diametern är i storleksordningen 10 nm. Dessutom SpeRe använder tredjeparts beställer-av-storlek lägre ljus dos jämfört med andra super-upplösning microscopies; Därför är det fritt från fototoxicitet och fotoblekning. SpeRe skulle ge en ny väg för att studera …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av institut av grundläggande vetenskapen (IBS-R015-D1) och av grundläggande vetenskap forskningsprogram genom den nationella Research Foundation i Korea (NRF) finansieras av undervisningsministeriet (2017R1A6A1A03015642).
Materials
| Glass cutter | – | – | Can be purchased in a local convenience store or online stores. |
| Nail polish | – | – | Can be purchased in a local convenience store or online stores. |
| Apochromat objective 40×, NA 1.1 | Leica Microsystems | 15506357 | Water-immersion type |
| Fluoromyelin Green | Thermo Fisher | F34651 | Alternatively, Fluoromyelin Red (F34652) can be used. |
| Leica SP8 TCS microscope | Leica Microsystems | SP8 | Refer to the "Configuration of microscope" in Introduction Section for details. |
| Imaging software | Leica Microsystems | LAS-X | – |
| Matlab | MathWorks | – | – |
| Mirror | Thorlabs | PF10-03-P01 | Coated with protected silver. |
| Phosphate-buffered saline (PBS) | Life technologies | 14190-136 | – |
| Paraformaldehyde | Biosolution | BP031a | 4% v/v in PBS |
| Cover slip | Thermo Fisher | 3306 | Thickness: #1 (0.13 to 0.17 mm) |
| Slide glass | Muto Pure Chemicals | 5116-20F | Thickness: ~1 mm |
| Super glue | Henkel | Loctite 406 | Use a dispensing equipment to avoid skin or eye contact. |
| Syringe pump | Brainetree Scientific | BS-8000 DUAL | – |
| Vibratome | Leica Biosystems | VT1200S | – |
| White-light laser | NKT photonics | EXB-6 | EXB-6 was discontinued and replaced by EXU-6. |
References
- Fernandez-Moran, H., Finean, J. B. Electron microscope and low-angle x-ray diffraction studies of the nerve myelin sheath. Journal of Cell Biology. 3, (1957).
- Blaurock, A. E. The spaces between membrane bilayers within PNS myelin as characterized by X-ray diffraction. Brain Research. 210, 383-387 (1981).
- Shim, S. -. H., et al. Super-resolution fluorescence imaging of organelles in live cells with photoswitchable membrane probes. Proceedings of the National Academy of Sciences. , 13978-13983 (2012).
- Urban, N. T., Willig, K. I., Hell, S. W., Nägerl, U. V. STED nanoscopy of actin dynamics in synapses deep inside living brain slices. Biophysics Journal. 101, 1277-1284 (2011).
- Manley, S., et al. High-density mapping of single-molecule trajectories with photoactivated localization microscopy. Nature Methods. 5, 155-157 (2008).
- Peters, A., Sethares, C. Is there remyelination during aging of the primate central nervous system?. Journal of Comparative Neurology. 460, 238-254 (2003).
- De Campos Vidal, B., Silveira Mello, M. L., Caseiro-Filho, A. C., Godo, C. Anisotropic properties of the myelin sheath. Acta Histochemica. 66, 32-39 (1980).
- Schain, A. J., Hill, R. A., Grutzendler, J. Label-free in vivo imaging of myelinated axons in health and disease with spectral confocal reflectance microscopy. Nature Medicine. 20, 443-449 (2014).
- Kwon, J., et al. Label-free nanoscale optical metrology on myelinated axons in vivo. Nature Communication. 8, 1832 (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. JoVE. (65), e3564 (2012).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell Patch-clamp Recordings in Brain Slices. JoVE. (112), e54024 (2016).
- Waldchen, S., Lehmann, J., Klein, T., Van De Linde, S., Sauer, M. Light-induced cell damage in live-cell super-resolution microscopy. Scientific Reports. 5, 15348 (2015).
- Chang, J. B., et al. Iterative expansion microscopy. Nature Methods. 14, 593-599 (2017).
- Polishchuk, R. S., et al. Correlative light-electron microscopy reveals the tubular-saccular ultrastructure of carriers operating between Golgi apparatus and plasma membrane. Journal of Cell Biology. 148, 45-58 (2000).

