Autometallography 在鲸目组织中的定位和半定量银的应用
Summary
本文提出了 autometallography 在鲸鱼肝和肾脏组织中定位银的协议。此外, 还开发了一种新的检测方法, 名为鲸类组织学 ag 测定 (CHAA), 用以估计这些组织中的银浓度。
Abstract
银纳米粒子 (AgNPs) 已广泛用于商业产品, 包括纺织品, 化妆品和保健项目, 由于其强大的抗菌作用。它们也可能被释放到环境中并积聚在海洋中。因此, AgNPs 是银污染的主要来源, 公众对银的环境毒性的认识也在增加。以往的研究表明, Ag 的生物积累 (生产者) 和放大 (在消费者/掠食者)。鲸类动物作为海洋的顶点捕食者, 可能受到银/银化合物的负面影响。虽然在鲸类组织中, 银/银化合物的浓度可以用电感耦合等离子体质谱 (icp-ms) 来测量, 但由于其高昂的资本成本和对组织贮存/准备的要求, 采用 icp-ms 的方法受到限制。因此, 用福尔马林固定、石蜡嵌入 (FFPE) 组织进行图像定量分析的 autometallography (AMG) 方法可以作为一种辅助方法, 在 suborgan 水平上定位银的分布, 估计鲸的银浓度。组织。AMG 阳性信号主要为棕色至近端肾小管上皮、肝细胞和枯否细胞细胞质中各种大小的黑色颗粒。有时, 一些非晶金黄色到褐色 AMG 阳性信号在一些近端肾小管的腔内和基底膜中被注意到。测定银浓度的方法被命名为鲸的组织学 Ag 检测 (CHAA), 它是由 AMG 方法和 ICP-MS 的图像定量分析数据建立的回归模型。使用 AMG 与 CHAA 的本地化和半定量重金属为时空和跨物种研究提供了一个方便的方法。
Introduction
银纳米粒子 (AgNPs) 已广泛用于商业产品, 包括纺织品, 化妆品和保健项目, 由于其巨大的抗菌作用1,2。因此, AgNPs 的生产和 AgNP 产品的数量随着时间的推移增加了3,4。然而, AgNPs 可能被释放入环境并且积累在海洋5,6。它们已成为银污染的主要来源, 公众对银的环境毒性的认识正在增加。
AgNPs 和 Ag 在海洋环境中的地位是复杂和不断变化的。以前的研究表明, AgNPs 可以保持为颗粒, 聚合, 溶解, 反应与不同的化学物种, 或从 Ag+离子再生7,8。在海洋沉积物中发现了几种类型的 Ag 化合物, 如 AgCl, 它们可以被底栖生物摄取, 进入食物链9,10。根据此前在台湾西南海岸的池畔泻湖区进行的一项研究, 海洋沉积物的 Ag 浓度极低, 与地壳丰度相似, 而鱼肝组织的含量通常低于检测限量 (< 0.025 微克/克湿/湿)11。然而, 以往在不同国家进行的研究表明, 鲸类动物12、13的肝脏中的银浓度相对较高。鲸类肝脏中的银浓度是年龄依赖性的, 这表明它们体内的 ag 的来源很可能是它们的猎物12。这些发现进一步表明生物放大作用的动物在较高的营养水平。鲸类动物作为海洋中的最顶端掠食者, 可能遭受了银/银化合物12、13、14造成的负面健康影响。最重要的是, 像鲸目动物一样, 人类是哺乳动物, 在鲸类中银/银化合物造成的负面健康影响也可能发生在人类身上。换言之, 鲸类动物可以作为海洋环境和人类健康的哨兵。因此, 鲸类动物的健康效应、组织分布和浓度均备受关注。
虽然在鲸类组织中, 银/银化合物的浓度可以用电感耦合等离子体质谱 (icp-ms) 来测量, 但 icp-ms 的使用受其高昂的资本成本 (仪器和维护) 的限制, 以及对组织贮存的要求/准备12,15。此外, 由于后勤困难、人手不足和缺乏相关资源12, 在所有调查滞留鲸类病例时, 通常难以收集综合组织样本。由于制冷空间有限, 冷冻组织样品不容易储存, 冷冻组织样品可能因制冷设备损坏12而被丢弃。上述这些障碍阻碍了用冷冻组织样品分析 ICP-质谱法研究鲸类组织中的污染水平。相比之下, 福尔马林固定的组织样本相对容易收集在尸检的死滞留鲸目动物。因此, 有必要开发一种简便、廉价的方法, 用福尔马林固定组织样品检测鲸鱼组织中的重金属。
尽管在福尔马林固定、石蜡嵌入 (FFPE) 过程中, 碱和碱性地球金属的 suborgan 分布和浓度可能会发生变化, 但对过渡金属 (如 Ag) 的影响只有较小的16。因此, FFPE 组织已被认为是一个理想的样品资源的金属定位和测量16,17。Autometallography (AMG), 一个组织化学的过程, 可以放大重金属作为变大小的金黄色到黑色 AMG 阳性信号在 FFPE 切片, 这些放大的重金属可以在光显微镜下可视化18,19,20,21. 因此, AMG 方法提供了有关重金属 suborgan 分布的信息。它可以为研究生物系统中重金属的代谢途径提供重要的补充信息, 因为 ICP-MS 只能测量器官18级的重金属浓度。此外, 数字图像分析软件, 如 ImageJ, 已应用于组织学组织切片的定量分析22,23。FFPE 组织切片的变大小金黄色到黑色 AMG 阳性信号可以量化并用于估计重金属的浓度。虽然绝对 Ag 浓度不能直接由 AMG 方法确定的图像定量分析, 它可以估计的一个回归模型的基础上得到的数据从图像定量分析和 ICP-MS, 这是命名为鲸组织学 Ag 化验 (CHAA)。考虑到大多数滞留鲸类中的 icp-ms 分析测定银浓度的困难, CHAA 是评估鲸类组织中银浓度的一种宝贵的佐剂方法, 由于缺乏冷冻而不能由 icp 分析确定。组织样本。本文介绍了一种组织化学技术 (AMG 方法) 在 suborgan 水平上定位银的协议, 以及一个名为 CHAA 的测定鲸类肝脏和肾脏组织中银浓度的实验。
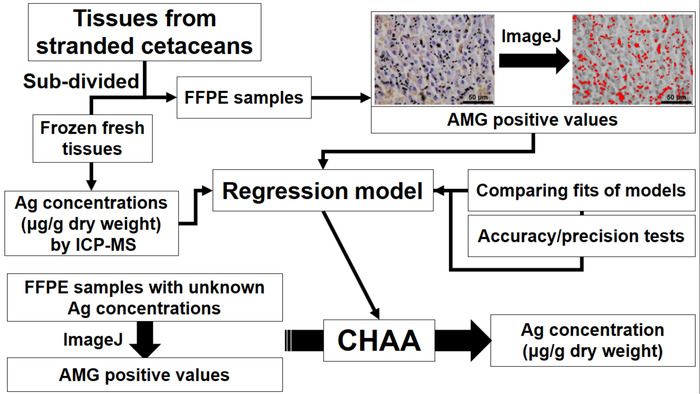
图 1: 描述了鲸的组织学 ag 测定 (CHAA) 的建立和应用的流程图, 用于估计银浓度.CHAA = 鲸目组织学 Ag 化验, FFPE = 福尔马林固定, 石蜡嵌入, ICP-MS = 电感耦合等离子质谱。请单击此处查看此图的较大版本.
Protocol
Representative Results
Discussion
本文的研究目的是建立一种辅助方法, 以评估 suborgan 水平的银分布, 并估算鲸体内的银浓度。目前的协议包括 1) ICP-MS, 2) 测定鲸目组织中银的含量. 用已知 ag 浓度对配对组织样品的 AMG 分析, 3) 建立回归模型 (CHAA) 估算银浓度通过 AMG 正值, 4) 评价 CHAA 的准确度和精确度, 以及 5) CHAA 对银浓度的估计。
在本研究中, ICP 的数据与 amg 阳性值呈显著正相关, 提示在鲸类组织中的银浓度?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
我们感谢台湾鲸鱼鲸搁浅网络标本采集和储存, 包括台湾鲸目协会, 台北;国立台湾大学生态学与进化生物学研究所, 鲸目研究实验室 (周莲香教授);国家自然科学博物馆 (黄重球博士), 台中;与国立成武大学海洋生物学 & 鲸目研究中心。我们也感谢农业部林业局, 行政院的许可。
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

