Utilisation de Autometallography pour localiser et semi-quantifier argent dans les tissus de cétacés
Summary
Un protocole est présenté afin de localiser des Ag dans les tissus hépatiques et rénaux cétacés par autometallography. En outre, une nouvelle méthode de dosage, appelé le test de Ag histologique cétacé (CHAA) est élaboré pour estimer les concentrations Ag dans ces tissus.
Abstract
Nanoparticules d’argent (AgNPs) ont été largement utilisés dans les produits commerciaux, y compris les textiles, cosmétiques et Articles de santé, en raison de ses forts effets antimicrobiens. Ils peuvent être libérés dans l’environnement et s’accumulent dans l’océan. Par conséquent, AgNPs constituent la principale source de contamination de l’Ag, et la sensibilisation du public de la toxicité environnementale de Ag augmente. Des études antérieures ont démontré la bioaccumulation (chez les producteurs) et le grossissement (chez les consommateurs/prédateurs) AG. Cétacés, comme les prédateurs de l’océan, peuvent ont été négativement touchés par les composés Ag/Ag. Bien que les concentrations de composés Ag/Ag dans les tissus cétacés peuvent être mesurées par spectrométrie de masse à plasma inductif (ICP-MS), l’utilisation de l’ICP-MS est limitée par son coût élevé du capital et de la nécessité de stockage/préparation du tissu. Par conséquent, une méthode d’autometallography (AMG) avec une analyse quantitative d’images en utilisant fixés au formol, paraffine de tissu (FFPE) peut-être constituer une méthode de traitement adjuvant peut localiser distribution Ag au niveau suborgan et estimation de la concentration d’Ag en cétacés tissus. Les signaux positifs de l’AMG sont principalement bruns à noirs granules de différentes tailles dans le cytoplasme de l’épithélium tubulaire rénale proximale, les hépatocytes et les cellules de Kupffer. Parfois, certains amorphe jaune doré à bruns signaux positifs de l’AMG sont notées dans le lumen et les membranes basales des tubules rénaux proximaux. Le dosage pour estimer la concentration de l’Ag est nommé le cétacé histologique Ag Assay (CHAA), qui est un modèle de régression établi par les données de l’analyse quantitative d’images de la méthode de l’AMG et ICP-MS. L’utilisation de AMG avec CHAA pour localiser et quantifier semi métauxlourds fournit une méthodologie pratique pour études spatio-temporelle et interspécifique.
Introduction
Nanoparticules d’argent (AgNPs) ont été largement utilisés dans les produits commerciaux, y compris les textiles, cosmétiques et Articles de soins de santé, en raison de leur grand effets antimicrobiens1,2. Par conséquent, la production de AgNPs et le nombre de produits contenant de l’AGP sont augmentés au fil du temps3,4. Cependant, AgNPs peut être rejetée dans l’environnement et s’accumulent dans l’océan5,6. Ils sont devenus la principale source de contamination de l’Ag, et la sensibilisation du public de la toxicité environnementale de Ag est en augmentation.
Le statut de l’AgNPs et Ag dans le milieu marin est complexe et en constante évolution. Des études antérieures ont indiqué que l’AgNPs peut rester comme particules, agrégats, dissolvent, réagissent avec les différentes espèces chimiques ou être régénérés à partir de7,ions Ag+ 8. Plusieurs types de composés Ag comme AgCl, ont été trouvés dans les sédiments marins, où ils peuvent être ingérés par les organismes benthiques et entrer dans la chaîne alimentaire9,10. Selon une étude précédente menée dans la région de Chi-ku Lagoon le long de la côte sud-ouest de Taïwan, les concentrations de l’Ag de sédiments marins sont extrêmement faible et similaire à l’abondance crustale, et celles du tissu de foie de poisson sont généralement inférieures à la détection limite (< 0,025 μg/g humide/humide)11. Toutefois, des études antérieures menées dans différents pays ont montré des concentrations relativement élevées de Ag dans le foie des cétacés12,13. La concentration de l’Ag dans le foie des cétacés est fonction de l’âge, ce qui suggère que la source des Ag dans leur corps est très probablement leurs proies12. Ces résultats suggèrent la bioamplification de l’Ag chez les animaux à des niveaux trophiques plus élevés. Cétacés, comme les prédateurs de l’océan, pourraient avoir subi les impacts négatifs sur la santé causés par Ag/Ag composés12,13,14. Plus important encore, comme les cétacés, les humains sont des mammifères et les impacts causés par des composés de Ag/Ag chez les cétacés peuvent également survenir chez les humains néfastes pour la santé. En d’autres termes, les cétacés pourraient être animaux sentinelles pour la santé du milieu marin et les êtres humains. Par conséquent, les effets sur la santé, la distribution tissulaire et la concentration de l’Ag chez les cétacés sont très préoccupante.
Bien que les concentrations de composés Ag/Ag dans les tissus cétacés peuvent être mesurées par spectrométrie de masse à plasma inductif (ICP-MS), l’utilisation de l’ICP-MS est limitée par son coût en capital élevé (instrument et entretien) et les exigences pour le stockage de tissus /PREPARATION12,15. En outre, il est généralement difficile de recueillir des échantillons de tissus complète dans toutes les enquêtes sur des cas de cétacés échoués en raison de difficultés logistiques, une pénurie de main-d’oeuvre et un manque de ressources connexes12. Les échantillons de tissus congelés pour analyse par ICP-SM ne se trouvant pas facilement à cause de l’espace limité de réfrigération, et les échantillons de tissus congelés peuvent être ignorés en raison de l’ équipement de réfrigération cassé12. Ces obstacles précités entravent les enquêtes sur les niveaux de contamination dans les tissus de cétacés par ICP-MS analyse en utilisant des échantillons de tissus congelés. En revanche, formol fixe des échantillons de tissus sont relativement faciles à recueillir au cours de l’autopsie des cétacés morts-brin. Par conséquent, il est nécessaire de développer une méthode facile à utiliser et peu coûteuse pour détecter/mesure des métaux lourds dans les tissus de cétacés à l’aide de formol fixé des échantillons de tissus.
Bien que les concentrations de métaux alcalins et alcalino-terreux et distributions de suborgan peuvent être modifiées au cours de la formaline-fixes, paraffine (FFIP) processus, seulement des effets moindre sur les métaux de transition, tels que Ag, été noté16. Par conséquent, tissu FFPE a été considéré comme une ressource d’échantillon idéal pour localisation métal et mesures16,17. Autometallography (AMG), un processus histochimique, peut amplifier les métaux lourds comme taille jaune d’or à des signaux positifs AMG noirs sur coupes tissulaires FFPE, et ces métaux lourds amplifié peut être visualisée sous microscopie optique18, 19 , 20 , 21. par conséquent, la méthode AMG fournit des informations sur les distributions de suborgan des métaux lourds. Il peut fournir des informations supplémentaires importantes pour étudier les voies métaboliques de métaux lourds dans les systèmes biologiques parce qu’ICP-MS ne peut mesurer la concentration de métaux lourds à l’orgue de niveau18. En outre, logiciel d’analyse des images numériques, comme ImageJ, a été appliquée à l’analyse quantitative des tissus histologiques sections22,23. Le jaune doré taille variable à des signaux positifs AMG noirs des coupes de tissu FFPE peut être quantifié et utilisée pour estimer les concentrations de métaux lourds. Bien que la concentration absolue en Ag ne peut être déterminée directement par la méthode AMG avec analyse quantitative d’images, il peut être estimée par un modèle de régression basé sur les données obtenues par l’analyse quantitative d’images et l’ICP-MS, ce qui porte le nom de cétacés test de Ag histologique (CHAA). Compte tenu des difficultés de mesure des concentrations d’Ag par ICP-MS analyse chez les cétacés échoués plus, CHAA est une méthode de traitement adjuvant utile pour estimer les concentrations d’Ag dans les tissus de cétacés, qui ne peuvent être déterminées par l’analyse des ICP-MS à cause du manque de surgelés échantillons de tissus. Cet article décrit le protocole d’une technique histochimique (méthode AMG) pour localiser le Ag au niveau suborgan et un test nommé CHAA pour estimer les concentrations d’Ag dans les tissus du foie et les reins des cétacés.
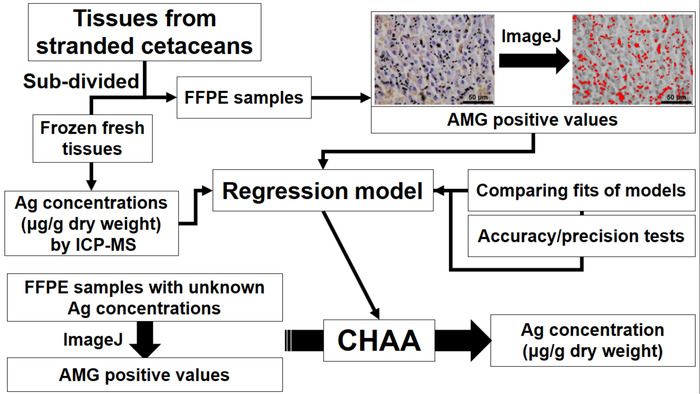
Figure 1 : organigramme illustrant la création et l’application de test de Ag histologique cétacé (CHAA) pour estimer les concentrations Ag. CHAA = cétacé test histologique d’Ag, FFIP = fixés au formol, paraffine, ICP-MS = spectrométrie de masse à plasma inductif. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Le but de l’étude de l’article est d’établir une méthode de traitement adjuvant pour évaluer la distribution Ag aux niveaux suborgan et pour estimer les concentrations d’Ag dans les tissus de cétacés. Les protocoles actuels comprennent 1) Détermination des concentrations de l’Ag dans les tissus cétacés par ICP-MS, analyse 2) AMG paire assortie d’échantillons de tissus avec des concentrations connues de Ag, 3) mise en place du modèle de régression (CHAA) pour estimer les concentrations d’Ag par d…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Nous remercions le Taiwan Cetacean Stranding Network pour le prélèvement d’échantillons et de stockage, y compris le Taiwan Cetacean Society, Taipei ; le laboratoire de recherche cétacés (Prof. privilège-Siang Chou), l’Institut d’écologie et de biologie évolutive, Université nationale de Taïwan, Taipei ; le Musée National des sciences naturelles (Dr Chiou-Ju Yao), Taichung ; et la biologie Marine & Cetacean Research Center, National Cheng-Kung University. Nous remercions également le Forestry Bureau, le Conseil de l’Agriculture, le Yuan exécutif pour leur permis.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

