Verwendung von Autometallography zu lokalisieren und semi-Quantifizierung Silber im Wal Gewebe
Summary
Ein Protokoll wird zum Ag in Wale Leber und Niere Geweben zu lokalisieren von Autometallography präsentiert. Darüber hinaus ist ein neue Assay, benannt die Wale histologischen Ag-Assay (CHAA) entwickelt, um die Ag-Konzentrationen in den Geweben zu schätzen.
Abstract
Silber-Nanopartikel (AgNPs) wurden ausgiebig in kommerziellen Produkten, einschließlich Textilien, Kosmetika und Gesundheitswesen Elemente aufgrund ihrer starken antimikrobiellen Wirkung eingesetzt. Sie auch in die Umwelt freigesetzt werden und reichern sich in den Ozean. Daher AgNPs sind die Hauptquelle der Ag Kontamination und Sensibilisierung der Umwelttoxizität von Ag steigt. Frühere Studien haben die Bioakkumulation (in Produzenten) und Vergrößerung (in Verbraucher/Raubtiere) der Ag gezeigt. Wale und Delfine, können als Spitzenprädatoren des Ozeans, negativ von der Ag/Ag-Verbindungen betroffen sind. Obwohl die Konzentrationen von Ag/Ag-Verbindungen in Wale Gewebe durch Massenspektroskopie induktiv gekoppelte Plasma (ICP-MS) gemessen werden können, ist der Einsatz von ICP-MS durch die hohen Investitionskosten und die Forderung nach Gewebe Lagerung/Vorbereitung begrenzt. Daher, eine Autometallography (AMG) Methode mit einer quantitativen Bildanalyse mit Formalin fixiert, Paraffin-eingebetteten (FFPE) Gewebe möglicherweise eine adjuvante Methode Ag Vertrieb Ebene Unterorgan zu lokalisieren und schätzen die Ag-Konzentration im Wal Gewebe. Die positiven Signale von AMG sind vor allem braun bis schwarz Granulate in verschiedenen Größen im Zytoplasma der proximalen renale tubuläre Epithel, Hepatozyten und Kupffer Zellen. Gelegentlich sind einige amorphen goldgelb bis braun AMG positive Signale in das Lumen und Basalmembran von einigen proximalen Nierentubuli zur Kenntnis genommen. Der Assay für die Schätzung der Konzentration Ag ist die Cetacean histologischen Ag Assay (CHAA), benannt, die ein Regressionsmodell festgelegten Daten aus quantitativen Bildanalyse der AMG-Methode und ICP-MS ist. Die Verwendung von AMG mit CHAA lokalisieren und semi-Quantifizierung Schwermetalle bietet eine bequeme Methode für räumlich-zeitliche und Cross-Arten.
Introduction
Silber-Nanopartikel (AgNPs) wurden ausgiebig in kommerziellen Produkten, einschließlich Textilien, Kosmetika und Gesundheitswesen Elemente, aufgrund ihrer großen antimikrobiell1,2eingesetzt. Daher sind die Herstellung von AgNPs und die Anzahl der Psychopharmakologie-haltigen Arzneimitteln über Zeit3,4erhöht. Jedoch AgNPs in die Umwelt freigesetzt werden und reichern sich in den Ozean5,6. Sie sind die wichtigste Quelle der Verunreinigung Ag geworden, und das öffentliche Bewusstsein für die ökologische Toxizität der Ag steigt.
Der Status des AgNPs und der Ag in der Meeresumwelt ist kompliziert und verändert sich ständig. Früheren Studien ergaben, dass AgNPs bleiben kann, wie Partikel, Aggregat, auflösen, mit verschiedenen chemischen Spezies reagieren oder vom Ag+ -Ionen7,8regeneriert werden. Verschiedene Arten von Ag-Verbindungen, wie AgCl, wurden in marinen Sedimenten gefunden, wo sie können von benthischen Organismen aufgenommen werden und geben Sie die Nahrungskette9,10. Nach einer früheren Studie in der Chi-Ku-Lagune entlang der südwestlichen Küste von Taiwan Ag-Konzentrationen von marinen Sedimenten sind extrem niedrig und ähnlich wie die Erdkruste Fülle und denen der Fisch Leber Gewebe sind in der Regel unter den Nachweis begrenzen Sie (< 0,025 μg/g nass/nass)11. Frühere Studien, die in verschiedenen Ländern haben jedoch relativ hohe Ag-Konzentrationen in den Lebern von Walen12,13gezeigt. Die Ag-Konzentration in den Lebern von Walen ist altersabhängig, was darauf hindeutet, dass die Quelle AG in ihrem Körper am ehesten ihre Beute12. Diese Ergebnisse weiter deuten die Biomagnifikation Ag bei Tieren auf höheren trophischen Ebenen. Wale und Delfine, können als Spitzenprädatoren in den Ozean negative gesundheitliche Auswirkungen der Ag/Ag Verbindungen12,13,14erlitten haben. Am wichtigsten ist, wie Wale sind Menschen Säugetiere und die negativen gesundheitlichen Auswirkungen der Ag/Ag-Verbindungen in Walen auch beim Menschen auftreten können. Mit anderen Worten könnte Wale Sentinel Tiere für die Gesundheit der Meeresumwelt und der Menschen. Daher sind die Auswirkungen auf die Gesundheit, die Gewebeverteilung und Konzentration der Ag in Wale von großer Bedeutung.
Obwohl die Konzentrationen von Ag/Ag-Verbindungen in Wale Gewebe durch Massenspektroskopie induktiv gekoppelte Plasma (ICP-MS) gemessen werden können, ist der Einsatz von ICP-MS durch seine hohe Kapitalkosten (Instrument und Wartung) und die Anforderungen für die Lagerung von Gewebe begrenzt. Definition-12,–15. Darüber hinaus ist es in der Regel schwierig, umfassende Gewebeproben bei allen Untersuchungen der gestrandete Wale Fälle aufgrund logistischer Schwierigkeiten, ein Mangel an Arbeitskräften und ein Mangel an verwandte Ressourcen12zu sammeln. Die gefrorene Gewebeproben für ICP-MS-Analyse liegen nicht einfach aus Platzgründen begrenzt Kältetechnik und gefrorene Gewebeproben können aufgrund der gebrochenen Kältetechnik Anlagen12verworfen werden. Diese vorgenannten Hindernisse erschweren Untersuchungen der Kontamination in Wale Geweben von ICP-MS-Analyse mit gefrorene Gewebeproben. Im Gegensatz dazu Formalin fixiert Gewebeproben sind relativ einfach, während der Autopsie der Toten-Stranded Wale zu sammeln. Daher ist es notwendig, eine benutzerfreundliche und kostengünstige Methode, um erkennen/Schwermetalle in Wale Geweben Messen mit Formalin fixiert Gewebeproben zu entwickeln.
Obwohl die Unterorgan Distributionen und Konzentrationen von Alkali- und Alkali-Erden-Metalle während der Formalin fixiert verändert werden können, Paraffin-eingebetteten (FFPE) Prozess, nur weniger Auswirkungen auf die Übergangsmetalle wie Ag, wurden bekannte16. Daher galt als ideale Probe Ressource für Metall Lokalisierung und Messungen16,17FFPE Gewebe. Autometallography (AMG), eine histochemische Prozess können Schwermetalle als variabel Größe goldgelb bis schwarz AMG positive Signale auf FFPE Gewebe Abschnitte zu verstärken, und diese verstärkt Schwermetalle unter Lichtmikroskopie18, visualisiert werden 19 , 20 , 21. daher die AMG-Methode informiert über die Unterorgan Verteilungen von Schwermetallen. Es kann wichtige zusätzliche Informationen für das Studium der Stoffwechselwege von Schwermetallen in biologischen Systemen, weil ICP-MS nur, die Konzentration von Schwermetallen an der Orgel Level18 messen könnenbieten. Darüber hinaus hat die Quantitative Analyse der histologischen Gewebe Abschnitte22,23digitale Bildanalyse-Software, wie z. B. ImageJ, zugewiesen. Variabel-Größe goldgelb bis schwarz AMG positive Signale der FFPE Gewebe Abschnitte kann quantifiziert und verwendet, um die Konzentrationen von Schwermetallen zu schätzen. Obwohl die absolute Konzentration Ag direkt nach der AMG-Methode mit quantitativen Bildanalyse bestimmt werden kann, kann es geschätzt werden durch ein Regressionsmodell, basierend auf den Daten aus der quantitativen Bildanalyse und ICP-MS, die Cetacean benannt ist histologischen Ag-Assay (CHAA). Angesichts der Schwierigkeiten bei der Messung der Ag-Konzentrationen durch ICP-MS-Analyse in die meisten gestrandeten Walen, CHAA ist eine wertvolle adjuvante Methode zur Ag-Konzentrationen im Wal Gewebe zu schätzen, die von ICP-MS-Analyse aufgrund der fehlenden nicht ermittelbar eingefroren Gewebeproben. Dieses Papier beschreibt das Protokoll einer histochemische Technik (AMG-Methode) zur Lokalisierung Ag auf Unterorgan Ebene und ein Test namens CHAA, die Ag-Konzentrationen in der Leber und Niere Gewebe von Walen zu schätzen.
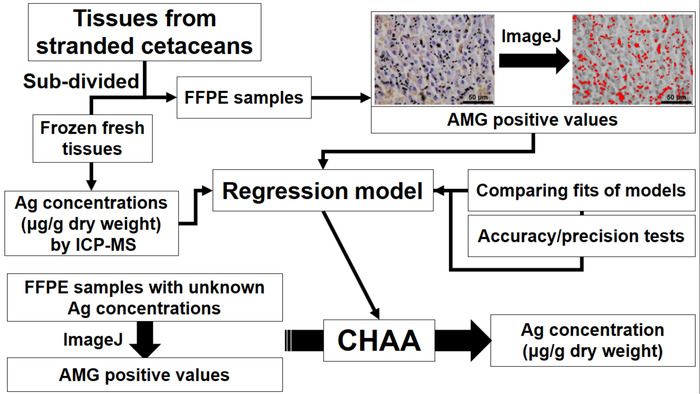
Abbildung 1: Flussdiagramm Darstellung der Einrichtung und Anwendung der Wale histologischen Ag-Assay (CHAA) für die Schätzung der Konzentration Ag. CHAA = Wal histologischen Ag-Assay, Proteinkinase = Formalin fixiert, Paraffin-eingebetteten, ICP-MS = induktiv gekoppelten Plasma Massenspektroskopie. Bitte klicken Sie hier für eine größere Version dieser Figur.
Protocol
Representative Results
Discussion
Der Zweck der Artikel Studie soll eine adjuvante Methode, Ag Quantil Unterorgan Ebenen und Ag-Konzentrationen im Gewebe Wale abzuschätzen. Die aktuellen Protokolle umfassen (1) Ermittlung der Ag-Konzentrationen in Wale Geweben von ICP-MS, (2) AMG Analyse von paar abgestimmt Gewebeproben mit bekannten Ag Konzentrationen (3) Einrichtung des Regressionsmodells (CHAA) für die Schätzung der Ag-Konzentrationen von AMG positive Werte, 4) Bewertung der Genauigkeit und Präzision von CHAA und 5) Schätzung der Ag-Konzentration…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Wir danken dem Taiwan Cetacean Verseilung Netzwerk für Probenentnahme und Lagerung, einschließlich der Taiwan Cetacean Society, Taipei; Das Cetacean Research Laboratory (Prof. Lien-Siang Chou), das Institut für Ökologie und Evolutionsbiologie, National Taiwan University, Taipei; das National Museum of Natural Science (Dr. Chiou-Ju Yao), Taichung; und die Meeresbiologie und Cetacean Research Center, National Cheng-Kung University. Wir danken auch der Forestry Bureau, Rat für Landwirtschaft, Exekutiv-Yuan für ihre Genehmigung.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

