Uso di Autometallography per localizzare e semi-quantificare argento nei tessuti dei cetacei
Summary
Un protocollo è presentato per localizzare Ag nei tessuti dei cetacei di fegato e reni di autometallography. Inoltre, un nuovo dosaggio, denominato il dosaggio di Ag istologico dei cetacei (CHAA) è stato sviluppato per stimare le concentrazioni di Ag in quei tessuti.
Abstract
Nanoparticelle d’argento (AgNPs) sono stati ampiamente utilizzate in prodotti commerciali, tra cui tessuti, cosmetici e articoli sanitari, a causa della loro forte effetti antimicrobici. Essi inoltre possono essere rilasciate nell’ambiente e si accumulano nell’oceano. Pertanto, AgNPs sono la fonte principale di contaminazione Ag e sta aumentando la consapevolezza pubblica della tossicità ambientale di Ag. Precedenti studi hanno dimostrato il bioaccumulo (tra i produttori) e l’ingrandimento (in consumatori/predatori) di Ag. Cetacei, come i superpredatori dell’oceano, possono essere negativamente influenzate dai composti Ag/Ag. Sebbene le concentrazioni dei composti di Ag/Ag nei tessuti dei cetacei possono essere misurate dalla spettroscopia di massa di plasma accoppiato induttivamente (ICP-MS), l’uso dell’ICP-MS è limitata dal suo alto costo di capitale e l’obbligo di deposito/preparazione di tessuti. Di conseguenza, un metodo autometallography (AMG) con un’analisi quantitativa di immagine utilizzando, formalina-fisse, paraffina-incastonato del tessuto (FFPE) può essere un metodo di adiuvante per localizzare la distribuzione Ag a livello suborgan e stimare la concentrazione di Ag in cetaceo tessuti. I segnali positivi di AMG sono principalmente marroni a neri granuli di varie dimensioni nel citoplasma dell’epitelio tubolare renale prossimale, epatociti e cellule di Kupffer. Occasionalmente, alcuni amorfo giallo dorato al marroni segnali positivi di AMG sono notati nel lume e della membrana dello scantinato di alcuni tubuli renali prossimali. Il dosaggio per stimare la concentrazione di Ag è denominato il cetaceo istologico Ag Assay (CHAA), che è un modello di regressione stabilito dai dati immagine analisi quantitativa del metodo AMG e ICP-MS. L’uso di AMG con CHAA per localizzare e semi-quantificare metalli pesanti fornisce una metodologia conveniente per studi spazio-temporali e cross-specie.
Introduction
Nanoparticelle d’argento (AgNPs) sono stati ampiamente utilizzate in prodotti commerciali, tra cui elementi di assistenza sanitaria, a causa di loro grandi effetti antimicrobici1,2, cosmetici e tessili. Pertanto, la produzione di AgNPs e il numero di prodotti contenenti AgNP sono aumentati nel corso del tempo3,4. Tuttavia, AgNPs possono essere rilasciati nell’ambiente e si accumulano in oceano5,6. Essi sono diventati la principale fonte di contaminazione Ag, e sta aumentando la consapevolezza del pubblico della tossicità ambientale di Ag.
Lo stato di AgNPs e Ag nell’ambiente marino è complessa e in costante evoluzione. Gli studi precedenti hanno indicato che AgNPs può rimanere come particelle, aggregazione, sciogliere, reagiscono con diverse specie chimiche o essere rigenerate da ioni Ag+ 7,8. Diversi tipi di composti Ag, come AgCl, sono stati trovati nei sedimenti marini, dove può essere ingeriti, da organismi bentonici e immettere la catena alimentare9,10. Secondo un precedente studio condotto nella zona Chi-ku laguna lungo la costa sud-occidentale di Taiwan, le concentrazioni di Ag di sedimenti marini sono estremamente basse e simili all’abbondanza della crosta terrestre, e quelle del tessuto di fegato di pesce sono di solito sotto il rilevamento limitare (< 0,025 μg/g bagnato/bagnato)11. Tuttavia, gli studi precedenti condotti in diversi paesi hanno dimostrato relativamente alte concentrazioni di Ag nei fegati di cetacei12,13. La concentrazione di Ag nei fegati dei cetacei è età-dipendente, suggerendo che la fonte di Ag nei loro corpi è più probabile loro preda12. Questi risultati ulteriori suggeriscono la biomagnificazione di Ag negli animali a livelli trofici superiori. Cetacei, come i predatori di vertice nell’oceano, potrebbero aver subito impatti negativi sulla salute causati dall’Ag/Ag composti12,13,14. La cosa più importante, come cetacei, gli esseri umani sono mammiferi e la salute negativa impatto causato dai composti di Ag/Ag in cetacei può verificarsi anche negli esseri umani. In altre parole, cetacei potrebbero essere animali sentinella per la salute dell’ambiente marino e gli esseri umani. Di conseguenza, gli effetti sulla salute, la distribuzione tissutale e concentrazione di Ag in cetacei sono motivo di grande preoccupazione.
Sebbene le concentrazioni dei composti di Ag/Ag nei tessuti dei cetacei possono essere misurate dalla spettroscopia di massa di plasma accoppiato induttivamente (ICP-MS), l’uso dell’ICP-MS è limitata dal suo alto costo di capitale (strumento e manutenzione) e i requisiti per la conservazione del tessuto /Preparation12,15. Inoltre, è solitamente difficile da raccogliere campioni di tessuto completo in tutte le indagini di casi di cetacei incagliati a causa di difficoltà logistiche, una carenza di manodopera e una mancanza di risorse correlate12. I campioni di tessuto congelato per analisi ICP-MS non vengono facilmente a causa dello spazio limitato di refrigerazione, e campioni di tessuto congelato possono essere scartati a causa di attrezzature di refrigerazione rotto12. Questi ostacoli suddetti ostacolano le indagini di livelli di contaminazione nei tessuti dei cetacei di analisi ICP-MS utilizzando campioni di tessuto congelato. Al contrario, formalina riparata campioni di tessuto sono relativamente facili da raccogliere durante l’autopsia di cetacei morti-stranded. Pertanto, è necessario sviluppare un metodo economico e facile da usare per rilevare/misura i metalli pesanti nei tessuti dei cetacei con formalina riparata campioni di tessuto.
Anche se le distribuzioni suborgan e le concentrazioni di metalli alcalini e alcalino-terrosi possono essere modificate durante la formalina-fisse, paraffina (FFPE) processo, solo minori effetti su metalli di transizione, come Ag, stato notato16. Quindi, tessuto FFPE è stato considerato come una risorsa di campione ideale per la localizzazione del metallo e misure16,17. Autometallography (AMG), un processo di istochimico, può amplificare i metalli pesanti come variabile graduato giallo dorato al neri segnali positivi di AMG su sezioni di tessuto FFPE e questi metalli pesanti amplificati può essere visualizzati sotto microscopia chiara18, 19 , 20 , 21. di conseguenza, il metodo AMG fornisce informazioni sulle distribuzioni suborgan di metalli pesanti. Può fornire ulteriori informazioni importanti per lo studio delle vie metaboliche di metalli pesanti nei sistemi biologici perché ICP-MS può solo misurare la concentrazione di metalli pesanti al livello dell’organo18. Inoltre, il software di analisi di immagine digitale, come ad esempio ImageJ, è stato applicato l’analisi quantitativa di tessuto istologico sezioni22,23. Il giallo dorato variably dimensioni al neri segnali positivi di AMG di sezioni di tessuto FFPE può essere quantificato e utilizzato per stimare le concentrazioni di metalli pesanti. Anche se la concentrazione di Ag assoluta non può essere determinata direttamente mediante il metodo AMG con analisi quantitativa delle immagini, si può stimare da un modello di regressione basato sui dati ottenuti dall’analisi quantitativa delle immagini e ICP-MS, che è il nome dei cetacei analisi istologica di Ag (CHAA). Considerando le difficoltà nella misurazione delle concentrazioni di Ag di analisi ICP-MS in cetacei non più recuperabili, CHAA è un metodo prezioso coadiuvante per stimare le concentrazioni di Ag nei tessuti dei cetacei, che non possono essere determinati mediante analisi ICP-MS a causa della mancanza di congelati campioni di tessuto. Questo articolo descrive il protocollo di una tecnica istochimica (metodo AMG) per la localizzazione di Ag a livello suborgan e un test denominato CHAA per stimare le concentrazioni di Ag nei tessuti del rene e fegato di cetacei.
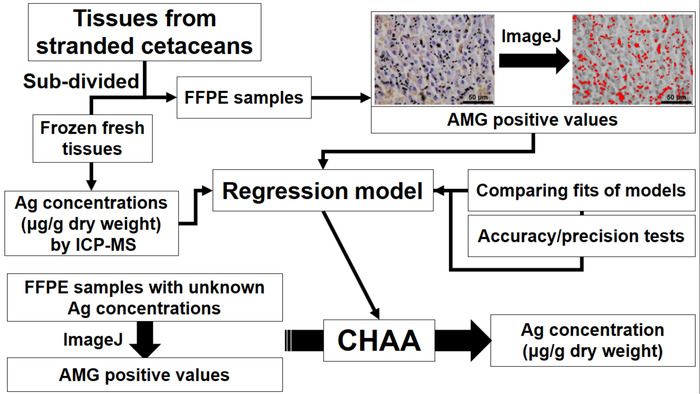
Figura 1: diagramma di flusso che raffigura l’istituzione e l’applicazione di test di cetacei istologico Ag (CHAA) per stimare le concentrazioni di Ag. CHAA = analisi istologica dei cetacei di Ag, FFPE = formalina-fisse, paraffina-incastonato, ICP-MS = plasma accoppiato induttivamente spettroscopia di massa. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Lo scopo dello studio articolo è quello di stabilire un metodo di adiuvante per valutare la distribuzione di Ag a livelli suborgan e per stimare le concentrazioni di Ag nei tessuti dei cetacei. Gli attuali protocolli includono 1) determinazione delle concentrazioni di Ag nei tessuti dei cetacei da ICP-MS, analisi 2) AMG dei campioni di tessuto paio abbinato con concentrazioni note di Ag, 3) la creazione del modello di regressione (CHAA) per stimare le concentrazioni di Ag di valori positivi di AMG, 4) valutazione dell’a…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ringraziamo la rete arenamento dei cetacei Taiwan per esempio raccolta e conservazione, tra cui la società di cetaceo di Taiwan, Taipei; il laboratorio di ricerca sui cetacei (prof. ssa Lien-Siang Chou), l’Istituto di ecologia e biologia evolutiva, Università nazionale di Taiwan, Taipei; il Museo Nazionale di scienze naturali (Dr. Chiou-Ju Yao), Taichung; e la biologia marina & Cetacean Research Center, National Cheng Kung University. Ringraziamo anche la silvicoltura Bureau, Consiglio dell’agricoltura, Executive Yuan per il loro permesso.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

