Uso de Autometallography para localizar y plata semi-cuantificar en cetáceos tejidos
Summary
Se presenta un protocolo para localizar Ag en tejidos de hígado y riñón cetáceos por autometallography. Además, un nuevo ensayo, llamado el análisis histológico cetáceo de Ag (CHAA) es desarrollado para estimar las concentraciones de Ag en los tejidos.
Abstract
Nanopartículas de plata (AgNPs) se han utilizado en productos comerciales, incluyendo textiles, cosméticos y artículos de salud, debido a sus fuertes efectos antimicrobianos. También se pueden liberar en el medio ambiente y se acumulan en el océano. Por lo tanto, AgNPs son la principal fuente de contaminación del Ag, y es cada vez mayor conciencia de la toxicidad ambiental de Ag. Estudios previos han demostrado la bioacumulación (de productores) y ampliación (en consumidores o predadores) de Ag. Cetáceos, como los depredadores ápice del océano, pueden haber sido afectados negativamente por los compuestos de Ag/Ag. Aunque las concentraciones de compuestos de Ag/Ag en tejidos de cetáceos pueden ser medidas por espectrometría de masas de plasma acoplado inductivamente (ICP-MS), el uso de ICP-MS es limitado por su alto costo de capital y los requisitos para almacenamiento y preparación de tejido. Por lo tanto, un método de autometallography (AMG) con un análisis cuantitativo de imagen mediante el uso de formalina-fijos, parafina-encajado (FFPE) tejido puede ser un método coadyuvante para localizar la distribución de Ag a nivel suborgan y calcular la concentración de Ag en cetáceos tejidos. Las señales positivas de AMG son principalmente marrones a negro gránulos de diferentes tamaños en el citoplasma del epitelio tubular renal proximal, hepatocitos y células de Kupffer. Ocasionalmente, se observan algunos amorfo amarillo oro a marrón señales positivas de AMG en la luz y la membrana del sótano de algunos túbulos renales proximales. El análisis para estimar la concentración de Ag es llamado el cetáceo histológica Ag ensayo (CHAA), que es un modelo de regresión establecido por los datos de análisis de imagen cuantitativo del método AMG y ICP-MS. El uso de AMG con CHAA localizar y semi-cuantificar los metales pesados proporciona una metodología conveniente para estudios espacio-temporales y entre especies.
Introduction
Nanopartículas de plata (AgNPs) se han utilizado en productos comerciales, incluyendo textiles, cosméticos y artículos de salud, debido a sus grandes efectos antimicrobianos1,2. Por lo tanto, se aumentan la producción de AgNPs y el número de productos que contengan AgNP tiempo3,4. Sin embargo, AgNPs se pueden liberar en el medio ambiente y se acumulan en el océano5,6. Se han convertido en la principal fuente de contaminación del Ag, y el conocimiento público de la toxicidad ambiental de Ag está aumentando.
El estado de AgNPs y Ag en el medio marino es complicado y cambiante. Estudios previos han indicado que AgNPs puede permanecer como partículas, agregadas, disolverán, reaccionan con diferentes especies químicas o ser regeneradas a partir de los iones de Ag+ 7,8. Varios tipos de compuestos de Ag, como AgCl, se han encontrado en sedimentos marinos, donde puede ser ingeridos por organismos bentónicos y entrar en la cadena alimentaria9,10. Según un estudio anterior realizado en la zona de la laguna Chi-ku a lo largo de la costa suroeste de Taiwán, las concentraciones de Ag de los sedimentos marinos son extremadamente baja y similar a la abundancia de la corteza, y los de tejido de hígado de pescado son generalmente por debajo de la detección límite (< 0.025 μg/g húmedo/húmedo)11. Sin embargo, estudios anteriores realizados en diferentes países han demostrado relativamente altas concentraciones de Ag en los hígados de cetáceos12,13. La concentración de Ag en los hígados de los cetáceos es dependiente de la edad, sugiriendo que la fuente de Ag en sus cuerpos es más probable es que su presa12. Estos resultados más futuros sugieren la biomagnificación de Ag en los animales en niveles tróficos superiores. Cetáceos, como los depredadores del ápice en el océano, pueden haber sufrido impactos negativos en la salud causados por compuestos de Ag/Ag12,13,14. Lo más importante, como cetáceos, los seres humanos son mamíferos y los impactos causados por compuestos de Ag/Ag en cetáceos pueden también ocurrir en seres humanos negativos para la salud. En otras palabras, cetáceos podrían ser animales Centinela para la salud del medio ambiente marino y los seres humanos. Por lo tanto, los efectos sobre la salud, distribución en los tejidos y la concentración de Ag en cetáceos son motivo de gran preocupación.
Aunque las concentraciones de compuestos de Ag/Ag en tejidos de cetáceos pueden ser medidas por espectrometría de masas de plasma acoplado inductivamente (ICP-MS), el uso de ICP-MS es limitado por su alto costo capital (instrumento y mantenimiento) y los requisitos para el almacenamiento de tejido /Preparation12,15. Además, es generalmente difícil recoger muestras de tejido integral en todas las investigaciones de casos de cetáceos varados debido a dificultades logísticas, falta de mano de obra y la falta de recursos relacionados12. Las muestras congeladas del tejido para análisis de ICP-MS no se almacenan fácilmente debido a espacio limitado de la refrigeración, y las muestras de tejido congelado pueden ser descartadas debido a equipo de refrigeración roto12. Estos obstáculos mencionados obstaculizan las investigaciones de los niveles de contaminación en los tejidos cetáceos por ICP-MS análisis usando muestras de tejido congelado. Por el contrario, formalina fijado muestras de tejido son relativamente fáciles de recoger durante la necropsia de los cetáceos varados muertos. Por lo tanto, es necesario desarrollar un método fácil de usar y de bajo costo para detectar/medida de los metales pesados en tejidos de cetáceos mediante el uso de formalina fijado muestras de tejido.
Aunque las concentraciones de los metales alcalinos y alcalinotérreos y distribuciones de suborgan se pueden alterar durante la formalina-fijos, parafina-encajado (FFPE) proceso sólo menores efectos sobre los metales de transición como el Ag, han sido conocido16. Por lo tanto, tejido FFPE ha sido considerada como un recurso de muestra ideal para localización de metal y las mediciones16,17. Autometallography (AMG), un proceso histoquímico, puede amplificar los metales pesados como variable tamaño amarillo oro al negro señales positivas de AMG en secciones de tejido FFPE, y estos metales pesados amplificados se puede visualizar bajo microscopia ligera18, 19 , 20 , 21. por lo tanto, el método AMG proporciona información sobre la distribución de suborgan de metales pesados. Puede proporcionar información adicional importante para el estudio de las vías metabólicas de metales pesados en los sistemas biológicos porque ICP-MS sólo puede medir la concentración de metales pesados en el órgano nivel18. Además, el software de análisis de imagen digital, como el ImageJ, se ha aplicado para el análisis cuantitativo de las secciones de tejido histológico22,23. El amarillo dorado al negro señales positivas de AMG de las secciones de tejido FFPE tamaño variable puede ser cuantificado y utilizado para estimar las concentraciones de metales pesados. Aunque la concentración de Ag absoluta no puede determinarse directamente mediante el método AMG con análisis de imagen cuantitativo, puede ser estimado por un modelo de regresión basado en los datos obtenidos en el análisis cuantitativo de imagen e ICP-MS, que es el nombre de cetáceos análisis histológico de Ag (CHAA). Teniendo en cuenta las dificultades en la medición de las concentraciones de Ag por análisis de ICP-MS en cetáceos varados más, CHAA es un método coadyuvante valioso para estimar las concentraciones de Ag en tejidos cetáceos, que no se puede determinar por análisis de ICP-MS debido a la falta de congelados muestras de tejido. Este documento describe el protocolo de una técnica histoquímica (método de AMG) para localización de Ag a nivel suborgan y un ensayo llamado CHAA para estimar las concentraciones de Ag en los tejidos de hígado y riñón de los cetáceos.
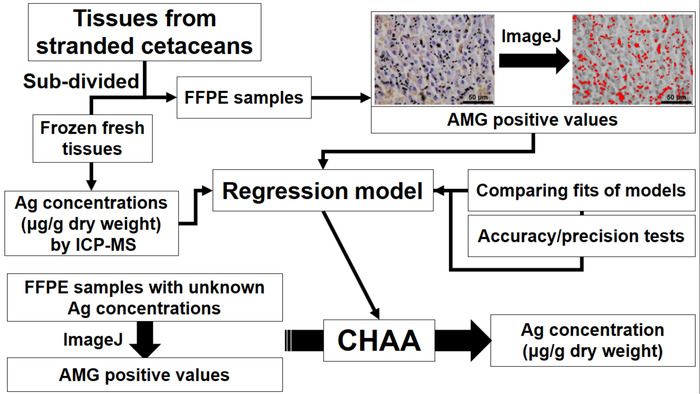
Figura 1: Diagrama de flujo que representa la creación y aplicación de cetáceos análisis histológicos de Ag (CHAA) para estimar las concentraciones de Ag. CHAA = cetáceos análisis histológico de la Ag, FFPE = formalina-fijos, parafina-encajado, ICP-MS = plasma acoplado inductivamente espectrometría de masas. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El propósito del artículo estudio es establecer un método coadyuvante para evaluar la distribución de Ag a nivel suborgan y para estimar las concentraciones de Ag en tejidos cetáceos. Los protocolos actuales incluyen 1) determinación de las concentraciones de Ag en tejidos cetáceos por ICP-MS, análisis 2) AMG de muestras de tejido par emparejado con concentraciones conocidas de Ag, 3) el establecimiento del modelo de regresión (CHAA) para estimar las concentraciones de Ag por valores positivos de AMG, 4) evaluac…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Agradecemos a la red de varamientos Taiwán cetáceos para recogida de muestras y almacenamiento, incluyendo la sociedad de cetáceos de Taiwán, Taipei; el laboratorio de investigación de cetáceos (Prof. Lien-Siang Chou), el Instituto de Ecología y biología evolutiva, Universidad Nacional de Taiwán, Taipei; el Museo Nacional de Ciencias naturales (Dr. Chiou-Ju Yao), Taichung; Biología Marina y centro de investigación de cetáceos, Universidad Nacional Cheng-Kung. También agradecemos a la oficina forestal, Consejería de agricultura, Yuan Ejecutivo su permiso.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

