Protocollo clinico di produrre tessuto adiposo-derivato Stromal frazione vascolare per potenziale rigenerazione della cartilagine
Summary
Qui, presentiamo un protocollo per la produzione di una frazione di vascolare stromal derivate da tessuto adiposo e la sua applicazione per migliorare le funzioni del ginocchio eseguendo la rigenerazione della cartilagine-come il tessuto in pazienti umani con l’osteoartrite.
Abstract
L’osteoartrite (OA) è uno dei più comuni disturbi debilitanti. Recentemente, numerosi tentativi apportati per migliorare le funzioni delle ginocchia utilizzando diverse forme di cellule staminali mesenchimali (MSCs). In Corea, concentrati di midollo osseo e cavo di cellule staminali derivate dal sangue sono state approvate dalla Korean Food and Drug Administration (KFDA) per la rigenerazione della cartilagine. Inoltre, una tessuto adiposo-derivato stromal vascolare frazione (SVF) è stato permesso del KFDA per iniezioni congiunte in pazienti umani. SVF derivate da tessuto adiposo autologo contiene la matrice extracellulare (ECM) oltre alle cellule staminali mesenchimali. ECM secerne varie citochine che, insieme con acido ialuronico (HA) e plasma ricco di piastrine (PRP) attivato dal cloruro di calcio, possono aiutare MSCs per rigenerare la cartilagine e migliorare le funzioni del ginocchio. In questo articolo, abbiamo presentato un protocollo per migliorare le funzioni del ginocchio eseguendo la rigenerazione della cartilagine-come il tessuto in pazienti umani con OA. Il risultato del protocollo in primo luogo è stato segnalato nel 2011, seguita da alcuni ulteriori pubblicazioni. Il protocollo coinvolge liposuzione per ottenere lipoaspirates autologhi che si mescolano con collagenasi. Questa miscela di lipoaspirates-collagenasi è poi tagliare e omogeneizzata per rimuovere grande tessuto fibroso che può intasare l’ago durante l’iniezione. In seguito, la miscela viene incubata per ottenere tessuto adiposo-derivato SVF. La SVF risultante tessuto adiposo-derivato, contenente sia il tessuto adiposo-derivato MSCs e resti di ECM, viene iniettato nel ginocchio dei pazienti, combinati con l’HA e cloruro di calcio attivato PRP. Sono inclusi tre casi di pazienti che sono stati trattati con il nostro protocollo conseguente miglioramento del dolore al ginocchio, il gonfiamento e la gamma di movimento insieme a prova di MRI di cartilagine ialina-come il tessuto.
Introduction
Cellule staminali mesenchimali (MSCs) sono noti per avere la capacità di rigenerare la cartilagine1,2,3,4,5,6. Possono essere facilmente ottenuti da varie fonti: midollo osseo, sangue del cordone ombelicale e tessuto adiposo tra molti altri. Tra queste fonti, il tessuto adiposo è l’unica fonte dove un numero sufficiente di cellule staminali mesenchimali possa essere ottenuto senza alcuna espansione di cultura per rigenerare la cartilagine nelle regolazioni cliniche7,8. Autologous del midollo osseo stromale vascolare frazione (SVF) può essere facilmente ottenuto pure. Tuttavia, il numero delle cellule staminali contenute nel midollo espanso non-cultura è molto basso7,8. Sangue del cordone può contenere un numero sufficiente di cellule staminali mesenchimali. Tuttavia, sangue del cordone ombelicale non è una fonte prontamente disponibile di SVF autologo.
Numerosi metodi di lavorazione il tessuto adiposo per ottenere SVF sono disponibili per applicazioni cliniche. Tra questi, il metodo di ottenimento MSCs dal tessuto adiposo mediante collagenasi, sviluppato e confermata da Zuk et al. 5 , 6, è molto ben accettato. Questo metodo di utilizzo della collagenosi è stato modificato per applicazioni cliniche in ortopedia. Per poter essere applicati a contesti clinici, il sistema deve essere un sistema chiuso per garantire la sterilità, mantenendo la comodità. Una modifica particolare presentata in questo articolo comporta l’omogeneizzazione della lipoaspirates. Piccole dimensioni lipoaspirates sono digeriti relativamente più velocemente di quelle di grandi dimensioni che risultano nella ripartizione irregolare del tessuto adiposo. Inoltre, questi lipoaspirates di dimensioni più grandi possono produrre tessuti fibrosi che possono intasare le siringhe e gli aghi durante l’esecuzione di iniezioni congiunta9,10. Per evitare questi problemi, il lipoaspirates può essere omogeneizzato da tagliare e sminuzzare la lipoaspirates prima l’incubazione con collagenasi. La SVF tessuto adiposo-derivato risultante potrebbe contenere più uniforme matrice extracellulare (ECM) rispetto a lipoaspirates che non sono omogeneizzati11. L’ECM scassata contenuta nella SVF funzionino come un’ impalcatura12.
Nel 2009, SVF derivate da tessuto adiposo autologo è stato permesso dalla Korean Food and Drug Administration (KFDA) durante l’elaborazione all’interno di una struttura medica con trattamento minimo da un medico13. In seguito, SVF derivate da tessuto adiposo autologo è stata utilizzata come agente potenziale per migliorare le funzioni del ginocchio nei pazienti di osteoartrite (OA) potenzialmente rigenerando cartilagine-come il tessuto10,14,15 , 16 , 17 , 18 .
Nel 2011, Pak ha mostrato per la prima volta che tessuto adiposo cellule staminali derivate (ASCs) contenute nella SVF tessuto adiposo-derivato può migliorare le funzioni del ginocchio potenzialmente rigenerazione della cartilagine-come il tessuto nei pazienti affetti da OA quando iniettato con piastrina-ricco plasma (PRP) 14. Inoltre, Pak et al sono riportati dati di sicurezza nel 2013 su 91 pazienti. Il tasso di efficacia media segnalato in questi dati di sicurezza era 67%15. Successivamente, ulteriori studi di Pak et al hanno dimostrato ginocchio migliorata funzioni potenzialmente grazie alla rigenerazione del tessuto della cartilagine-come in pazienti con un menisco lacrima e Condromalacia della rotula10,16,17 ,18. Basato sugli articoli segnalati, è noto che il numero delle cellule staminali contenute in 100 g di tessuto adiposo elaborato dal protocollo presentato in questo articolo può variare da 1.000.000-40.000.000 a seconda delle caratteristiche dei pazienti8, 19 , 20 , 21 , 22 , 23.
Qui, presentiamo un protocollo clinico di osteoartrosi del ginocchio umano utilizzando SVF derivate da tessuto adiposo autologo con HA e PRP attivato con cloruro di calcio. La prima versione di questo protocollo clinico, che coinvolge un sistema chiuso, manuale per mantenere la sterilità, è stata segnalata nel 201114. Il protocollo identico è stato ottimizzato, mantenere la sterilità ed è stato segnalato nel 2013 e 201610,15. Qui, è presentato il protocollo ottimizzato. La presentazione schematica del protocollo è presentato nella Figura 1.
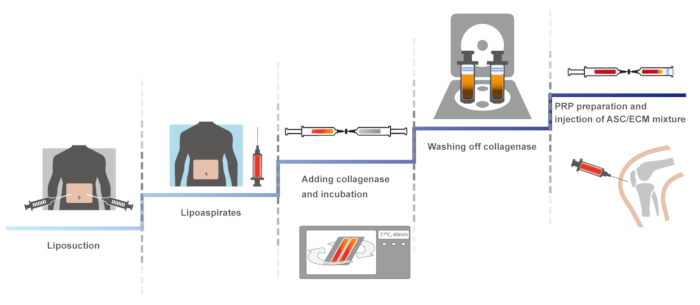
Figura 1: Panoramica schematica del protocollo. Clicca qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Nel 2001, Zuk et al. cellule staminali isolate dal tessuto adiposo, abbattendo la matrice del collagene con collagenasi6. In seguito, il gruppo ha mostrato che queste cellule staminali isolate da tessuto adiposo potrebbe trasformare in cartilagine e altri tessuti del mesoderma in origine, dimostrando che non c’erano queste cellule staminali mesenchimali in origine.
Allo stesso modo, la procedura presentata in questo articolo è un protocollo modificato per appl…
Divulgations
The authors have nothing to disclose.
Acknowledgements
L’autore riconosce il sostegno da parte del personale della clinica medica Mipro e il disegno di figura di Jaepil/David Lee. Questo lavoro è stato sostenuto da borse di ricerca dal Bio & programma di sviluppo tecnologia medicale della NRF finanziata da MSIT (numero NRF-2017M3A9E4078014); e nazionali Research Foundation di Corea (NRF) finanziato dal Ministero della scienza e ICT (numeri NRF-2017R1A2B4002315 e NRF-2016R1C1B2010308).
Materials
| Material | |||
| 5% Betadine (povidone-iodine) | Firson Co., Ltd. | 657400260 | |
| 2% Lidocaine | Daehan Pharmaceutical Co. | 670603480 | |
| Tumescent solution | Myungmoon Pharm. Co. Ltd. | N01BB01 | The solution was composed of 500 mL normal saline, 40 mL 2% lidocaine, 20 mL 0.5% marcaine, and 0.5 mL epinephrine 1:1000. |
| Liberase TL and TM research grade | Roche Applied Science | 5401020001 | |
| D5LR | Dahan Pharm. Co., Ltd. | 645101072 | Dextrose 5% in lactated Ringer's solution |
| Anticoagulant citrate dextrose solution | Fenwal, Inc. | NDC:0942-0641 | The solution was composed of 0.8% citric acid, 0.22% sodium citrate, and 0.223% dextrose. |
| 3% (w/v) Calcium chloride | Choongwae Pharmaceutical Co. | 644902101 | |
| 0.5% (w/v) HA (Hyaluronic acid ) | Dongkwang pharm. Co., Ltd. | 645902030 | |
| 0.25% Ropivacaine | Huons Co., Ltd. | 670600150 | |
| Equipment | |||
| 3.0 mm Cannula | WOOJU Medical Instruments Co. | ML30200 | |
| 60-mL Luer-Lock syringe | BD (Becton Dickinson) | 309653 | |
| Centrifuge Barrel Kit | CPL Co., Ltd. | 30-0827044 | |
| Tissue homogenizer that contains blades | CPL Co., Ltd. | 30-0827045 | |
| Rotating incubator mixer | Medikan Co., Ltd | MS02060092 | |
| Centrifuge | Hanil Scientific Inc. | CE1133 | |
| Magnetic Resonance Imaging | Philips Medical Systems Inc. | 18068 | |
| Ultrasound Imaging System | Samsung Medison co., Ltd | CT-LK-V10-ICM-09.05.2007 |
References
- Arnoczky, S. P. Building a meniscus. Biologic considerations. Clinical Orthopaedics and Related Research. (367 Suppl), S244-S253 (1999).
- Barry, F. P. Mesenchymal stem cell therapy in joint disease. Novartis Foundation Symposium. 249, 86-241 (2003).
- Usuelli, F. G., et al. Adipose-derived stem cells in orthopaedic pathologies. British Medical Bulletin. 124 (1), 31-54 (2017).
- Zhang, H. N., Li, L., Leng, P., Wang, Y. Z., Lv, C. Y. Uninduced adipose-derived stem cells repair the defect of full-thickness hyaline cartilage. Chinese Journal of Traumatology. 12 (2), 92-97 (2009).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular Biology of the Cell. 13 (12), 4279-4295 (2002).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engineering. 7 (2), 211-228 (2001).
- Baer, P. C., Geiger, H. Adipose-derived mesenchymal stromal/stem cells: tissue localization, characterization, and heterogeneity. Stem Cells International. 2012, 812693 (2012).
- Zhu, Y., et al. Adipose-derived stem cell: a better stem cell than BMSC. Cell Biochemistry and Function. 26 (6), 664-675 (2008).
- Bellei, B., Migliano, E., Tedesco, M., Caputo, S., Picardo, M. Maximizing non-enzymatic methods for harvesting adipose-derived stem from lipoaspirate: technical considerations and clinical implications for regenerative surgery. Scientific Reports. 7 (1), 10015 (2017).
- Pak, J., Lee, J. H., Park, K. S., Jeong, B. C., Lee, S. H. Regeneration of Cartilage in Human Knee Osteoarthritis with Autologous Adipose Tissue-Derived Stem Cells and Autologous Extracellular Matrix. BioResearch Open Access. 5 (1), 192-200 (2016).
- Alexander, R. W. Understanding Adipose-derived Stromal Vascular Fraction (AD-SVF) Cell Biology and Use on the Basis of Cellular, Chemical, Structural and Paracrine Components: A Concise Review. Journal of Prolotherapy. 4, e855-e869 (2012).
- Benders, K. E., et al. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 31 (3), 169-176 (2013).
- Korean Food and Drug Administration (KFDA). Cell therapy: Rules and Regulations. KFDA. , (2009).
- Pak, J. Regeneration of human bones in hip osteonecrosis and human cartilage in knee osteoarthritis with autologous adipose-tissue-derived stem cells: a case series. Journal of Medical Case Reports. 5, 296 (2011).
- Pak, J., Chang, J. J., Lee, J. H., Lee, S. H. Safety reporting on implantation of autologous adipose tissue-derived stem cells with platelet-rich plasma into human articular joints. BMC Musculoskeletal Disorders. 14, 337 (2013).
- Pak, J., Lee, J. H., Kartolo, W. A., Lee, S. H. Cartilage Regeneration in Human with Adipose Tissue-Derived Stem Cells: Current Status in Clinical Implications. BioMed Research International. 2016, 4702674 (2016).
- Pak, J., Lee, J. H., Lee, S. H. A novel biological approach to treat chondromalacia patellae. PLoS One. 8 (5), e64569 (2013).
- Pak, J., Lee, J. H., Lee, S. H. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. BioMed Research International. 2014, 436029 (2014).
- Aust, L., et al. Yield of human adipose-derived adult stem cells from liposuction aspirates. Cytotherapy. 6 (1), 7-14 (2004).
- De Ugarte, D. A., et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow. Cells Tissues Organs. 174 (3), 101-109 (2003).
- Guilak, F., et al. Clonal analysis of the differentiation potential of human adipose-derived adult stem cells. Journal of Cellular Physiology. 206 (1), 229-237 (2006).
- Mitchell, J. B., et al. Immunophenotype of human adipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. 24 (2), 376-385 (2006).
- Oedayrajsingh-Varma, M. J., et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 8 (2), 166-177 (2006).
- . Liberase TL information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/05401020001?lang=en®ion=US (2018)
- . Liberase TM information available from Sigma Millipore online Available from: https://www.sigmaaldrich.com/catalog/product/roche/Libtmro?lang=en®ion=US (2018)
- Childs, J. D., Piva, S. R. Psychometric properties of the functional rating index in patients with low back pain. European Spine Journal. 14 (10), 1008-1012 (2005).
- Price, D. D., McGrath, P. A., Rafii, A., Buckingham, B. The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17 (1), 45-56 (1983).
- Pilgaard, L., Lund, P., Rasmussen, J. G., Fink, T., Zachar, V. Comparative analysis of highly defined proteases for the isolation of adipose tissue-derived stem cells. Regenerative Medicine. 3 (5), 705-715 (2008).
- D’Ambrosi, R., Indino, C., Maccario, C., Manzi, L., Usuelli, F. G. Autologous Microfractured and Purified Adipose Tissue for Arthroscopic Management of Osteochondral Lesions of the Talus. Journal of Visualized Experiments. (131), e56395 (2018).
- Packer, J. D., Chang, W. T., Dragoo, J. L. The use of vibrational energy to isolate adipose-derived stem cells. Plastic Reconstructive Surgery-Global Open. 6 (1), e1620 (2018).
- Hanke, C. W., Bernstein, G., Bullock, S. Safety of tumescent liposuction in 15,336 patients. National survey results. Dermatologic Surgery. 21 (5), 459-462 (1995).
- Illouz, Y. G. Complications of liposuction. Clinics in Plastic Surgery. 33 (1), 129-163 (2006).
- Dixit, V. V., Wagh, M. S. Unfavourable outcomes of liposuction and their management. Indian Journal of Plastic Surgery. 46 (2), 377-392 (2013).
- Lehnhardt, M., et al. Major and lethal complications of liposuction: a review of 72 cases in Germany between 1998 and 2002. Plastic and Reconstructive Surgery. 121 (6), 396e-403e (2008).
- Iyer, S. S., Rojas, M. Anti-inflammatory effects of mesenchymal stem cells: novel concept for future therapies. Expert Opinion on Biological Therapy. 8 (5), 569-581 (2008).
- Zhang, J., Middleton, K. K., Fu, F. H., Im, H. J., Wang, J. H. HGF mediates the anti-inflammatory effects of PRP on injured tendons. PLoS One. 8 (6), e67303 (2013).
- Li, N. Y., Yuan, R. T., Chen, T., Chen, L. Q., Jin, X. M. Effect of platelet-rich plasma and latissimus dorsi muscle flap on osteogenesis and vascularization of tissue-engineered bone in dogs. Journal of Oral and Maxillofacial Surgery. 67 (9), 1850-1858 (2009).
- Parsons, P., et al. The biological effect of platelet rich-plasma on the fracture healing process. The Journal of bone and joint surgery. British volume. 91-B, 293 (2009).
- Wu, W., Chen, F., Liu, Y., Ma, Q., Mao, T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. Journal of Oral and Maxillofacial Surgery. 65 (10), 1951-1957 (2007).
- Cooper, T. W., Eisen, A. Z., Stricklin, G. P., Welgus, H. G. Platelet-derived collagenase inhibitor: characterization and subcellular localization. Proceedings of the National Academy of Sciences of the United States of America. 82 (9), 2779-2783 (1985).
- Uzuki, M., Sawai, T. A. A comparison of the affinity of sodium hyaluronate of various molecular weights for degenerated cartilage: a histochemical study using hyaluronic acid binding protein. International Congress Series. 1223, 279-284 (2001).
- Pagano, C., et al. Molecular and morphometric description of adipose tissue during weight changes: a quantitative tool for assessment of tissue texture. International Journal of Molecular Medicine. 14 (5), 897-902 (2004).

