Un dosage de spectroscopie par Fluorescence Fluctuation d’Interactions protéine-protéine à Contacts cellule-cellule
Summary
Ce protocole décrit une approche d’axée sur la spectroscopie de fluorescence fluctuation pour étudier les interactions entre protéines médiant les interactions cellule-cellule, c’est-à-dire des protéines localisées dans les jonctions cellulaires, directement dans les cellules vivantes. Nous fournissons des lignes directrices détaillées sur l’étalonnage de l’instrument, d’acquisition de données et l’analyse, y compris les corrections apportées aux sources de l’artefact possible.
Abstract
Une variété de processus biologiques implique des interactions cellule-cellule, généralement véhiculées par les protéines qui interagissent à l’interface entre les cellules voisines. D’intérêt, seulement quelques essais sont capables de sonder précisément ces interactions directement dans les cellules vivantes. Nous présentons ici un test pour mesurer la liaison des protéines exprimées à la surface des cellules voisines, aux contacts de cellules. Ce test comprend deux étapes : mélange des cellules exprimant les protéines d’intérêt fusionné à différentes protéines fluorescentes, suivie de mesures de spectroscopie de fluorescence fluctuation aux contacts de cellules à l’aide d’un laser confocal microscope à balayage. Nous démontrer la faisabilité de ce test dans un contexte biologiquement pertinent en mesurant les interactions de la protéine amyloïde de précurseurs comme 1 (APLP1) jonctions cellule-cellule. Nous fournissons des protocoles détaillés sur l’acquisition de données à l’aide de techniques axées sur la fluorescence (analyse spectroscopie de corrélation de fluorescence, nombre de corrélation croisée et l’analyse de la luminosité) et l’étalonnage de l’instrument requis. De plus, nous discutons des étapes essentielles dans l’analyse des données et la façon d’identifier et de corriger les variations de signal externe, parasites, telles que celles dues à un mouvement de photoblanchiment ou cellule.
En général, l’analyse présentée est applicable à tout homo – ou d’une interaction de protéines hétérotypiques à contacts de cellule-cellule, entre les cellules des types identiques ou différents et peut être implémentée sur un laser confocal commercial microscope à balayage. Une exigence importante est la stabilité du système, qui doit être suffisante pour sonder par diffusion dynamique des protéines d’intérêt pendant plusieurs minutes.
Introduction
Beaucoup de processus biologiques se produire sur les sites des interactions cellule-cellule, par exemple, cellules adhérence1,2,3, cellule-cellule fusion4 et reconnaissance cellulaire5. Ces événements sont particulièrement importants lors du développement des organismes pluricellulaires et pour la communication de cellule-cellule, par exemple, au cours de la réponse immunitaire. Ces processus sont généralement véhiculées par des protéines qui sont localisés à la surface, c’est-à-dire à la membrane plasmique (PM) des cellules voisines et subissent des interactions spécifiques au contact cellule-cellule qui sont précisément réglementées dans l’espace et le temps. Dans de nombreux cas, ces interactions sont directement homo – ou des interactions protéine-protéine hétérotypiques trans , mais peuvent aussi comporter des ions ou des ligands agissant comme linkers extracellulaire1. Bien que d’une importance fondamentale, il y a un manque d’essais probing ces interactions protéine-protéine spécifique directement dans l’environnement natif des cellules vivantes. Plusieurs méthodes nécessitent soit désorganisation cellulaire (par exemple, des tests biochimiques comme co-immunoprécipitation6), la fixation (par exemple, certaines des techniques de microscopie optique de Super-résolution et microscopie électronique de cellules contacts7), ou sont non spécifiques, par exemple, agrégation / adhérence dosages8,9. Pour résoudre ce problème, techniques de fluorescence ont été appliquées à l’issu de la fluorescence resonance energy transfert (FRET)10 ou fluorescence complémentation11. Toutefois, pour atteindre suffisamment petites distances entre les fluorophores, ces méthodes nécessitent des étiquettes fluorescentes du côté extracellulaire des protéines10, potentiellement interférer avec des interactions de trans .
Nous présentons ici une analyse alternative de basés sur la fluorescence pour interactions protéine-protéine à contacts cellule-cellule. Cette approche combine des approches de corrélation de fluorescence (balayage spectroscopie de corrélation de fluorescence (sFCCS), nombre de corrélation croisée et la luminosité (ccN & B)) et le mélange des cellules exprimant une construction de fusion de la protéine de intérêt, par exemple, un récepteur d’adhésion. Les récepteurs étudiés dans les deux cellules qui interagissent sont étiquetés avec deux protéines fluorescentes spectralement séparés (FPs), de l’intracellulaire (voir Figure 1 a).
Les méthodes employés reposent sur l’analyse statistique des variations de fluorescence induite par le mouvement diffusif fluorescent des protéines de fusion par le biais du volume focal d’un confocal laser scanning microscope. Plus en détail, le test des sondes la diffusion conjointe des protéines d’intérêt dans les deux voisins PMs à contacts cellule-cellule. Si les protéines subissent des interactions de trans , ces complexes trans portera des protéines fluorescentes émettant dans les deux canaux spectraux, provoquant des fluctuations de corrélation de fluorescence des deux émetteurs. En revanche, si aucune liaison se produit, les fluctuations des protéines numéros face à PMs sera indépendantes, ne causant aucune fluctuation corrélées. L’acquisition peut être effectuée de deux façons : 1) sFCCS repose sur une analyse en forme de ligne au travers le contact de cellule-cellule et sondes efficacement les interactions dans un endroit situé dans la région de contact. Grâce à une analyse temporelle des variations de fluorescence, sFCCS renseigne aussi dynamique, c’est-à-dire, les coefficients de diffusion des complexes protéiques ; 2) ccN & B repose sur une analyse d’un d’une séquence d’images acquises dans les régions de contact cellule-cellule. Il a une capacité à sonder et le long de l’ensemble des interactions de carte contact région (dans un plan focal), mais ne fournit pas d’informations sur la dynamique. Les deux méthodes peuvent être combinées avec une analyse de la luminosité moléculaire, c’est-à-dire le signal de fluorescence moyenne émise dans l’unité de temps par simple diffusion complexes de protéines et, ainsi, fournir des estimations de la stoechiométrie des complexes protéiques au contacts de cellule-cellule.
Dans cet article, nous fournissons des protocoles détaillés pour la préparation des échantillons, d’étalonnage des instruments, d’acquisition de données et d’analyse effectuer l’essai présenté sur un laser confocal commercial microscope à balayage. Les expériences peuvent être effectuées sur n’importe quel instrument équipé de comptage de photons ou détecteurs analogiques et un objectif à grande ouverture numérique. Plus loin, nous discutons des étapes critiques du protocole et fournissent des systèmes de correction pour plusieurs processus causant des fluctuations artéfactuelles signal, par exemple, bruit de détecteur, photoblanchiment ou cellule mouvement. Développé à l’origine pour sonder les interactions entre cellules adhérentes, l’essai peut être modifié pour les cellules en suspension, ou adaptée aux systèmes à membrane modèle, par exemple, les vésicules unilamellaires géant (GUVs) ou le plasma géant vésicules de la membrane (GPMVs), ce qui permet la quantification des interactions dans des environnements différents lipides ou en l’absence d’un cytosquelette organisé12,13.
Spectroscopie de corrélation de fluorescence de balayage est une version modifiée de la spectroscopie de corrélation de fluorescence14 et a été spécialement conçu pour sonder la lente par diffusion dynamique de membranes lipidiques15. Il repose sur une acquisition de balayage ligne perpendiculaire à la PM contenant les protéines fluorescentes d’intérêt. Pour sonder les interactions entre les deux espèces de protéines marquées différemment, l’acquisition est effectuée en deux canaux spectraux en utilisant deux lignes laser et deux fenêtres de détection de fluorophores spectralement séparés. En raison de la dynamique de diffusion lente des protéines dans la MP (D≤ ~ 1 µm2/s), une mesure cross-talk-gratuit peut être effectuée en alternance le régime de l’excitation de la ligne à la ligne15. L’analyse commence par : 1) l’alignement algorithme correction de mouvement latéral cellulaire basé sur block-wise avec une moyenne de ~ 1000 lignes, 2) Détermination de la position avec fluorescence maximum signal, c’est-à-dire la PM position dans chaque bloc et 3) shifting de tous les blocs d’une commune origine12,15, séparément pour chaque voie. Puis, une sélection automatique des pixels correspondant à la PM est exécutée en sélectionnant la zone centrale d’un ajustement gaussien de la somme de toutes les lignes alignées (c.-à-d., Centre ± 2.5σ). Intégration du signal de chaque ligne donne la série temporelle de fluorescence membranaire f (t) dans chaque canal (g = vert canal, r = canal rouge). Notez que la taille du pixel doit être assez petit par exemple, < 200 nm, pour reconstruire la forme du point de fonction d’étalement et de trouver son centre, correspondant à la position de la MP. En présence de photoblanchiment substantiel, les séries chronologiques de fluorescence dans chaque canal peuvent être modélisés par une fonction exponentielle double et puis corrigés avec la formule suivante :16
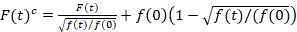 . (1)
. (1)
Il est important de noter que cette formule corrige efficacement tant les amplitudes et les heures de diffusion obtenues par l’analyse de corrélation de f (t)c, par rapport aux estimations de paramètre qui seraient obtenues à partir du non corrigée f (t). Ensuite, les fonctions auto – et la corrélation croisée (ACFs / CCP) de la fluorescence des signaux sont calculées :
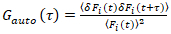 , (2).
, (2).
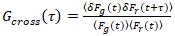 , (3).
, (3).
où δFj’ai = Fi(t) – 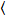 Fi(t)
Fi(t)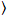 et i = g, r.
et i = g, r.
Un modèle de diffusion bidimensionnelle est ensuite ajusté à toutes les fonctions de corrélation (CFs) :
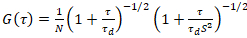 . (4)
. (4)
Ici, N désigne le nombre de protéines fluorescentes dans le volume de l’observation et τd le temps de diffusion pour chaque canal. Ce modèle prend en compte que dans le cadre expérimental décrit, diffusion des protéines dans la MP se produit dans le plan x-z, contrairement à la configuration courante de corrélation de fluorescence spectroscopy (FCS) expériences sur les membranes de palpage diffusion dans le plan x-y du confocal volume17. La taille w0 et le facteur de structure S, décrivant l’allongement wz du volume focal en z, S = wz/w0, sont obtenues à partir d’une mesure de calibration de FCS point effectuée avec colorants spectralement similaires et les mêmes paramètres optiques à l’aide de valeurs déjà disponibles pour le coefficient de diffusion Dcolorant:
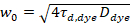 , (5).
, (5).
où τd, colorant est le temps de diffusion moyenne mesurée des molécules de colorant, obtenu à partir d’un modèle pour la diffusion en trois dimensions des données, compte tenu des transitions de compte d’une fraction T de toutes les molécules de N à un état triplet avec une constante de temps ττ:
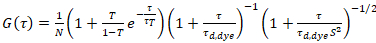 . (6)
. (6)
Enfin, les coefficients de diffusion (D), les valeurs de luminosité moléculaire (ε) et la corrélation croisée relative des données sFCCS (rel.cc.) sont calculées comme suit :
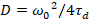 , (7).
, (7).
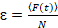 , (8).
, (8).
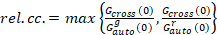 , (9).
, (9).
où GCroix(0) est l’amplitude de la fonction de corrélation croisée et 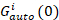 est l’amplitude de la fonction d’autocorrélation dans le canal du je-th.
est l’amplitude de la fonction d’autocorrélation dans le canal du je-th.
Cette définition de la relative corrélation croisée, c’est-à-dire à l’aide de max au lieu de signifier l’équation 9, tient compte du fait que le nombre maximal de complexes des deux espèces de protéines présents à des concentrations différentes est limité par la espèces présentes dans un nombre inférieur.
Luminosité et nombre de corrélation croisée repose sur une analyse de l’instant de l’intensité de fluorescence pour chaque pixel d’une image de pile a acquis au fil du temps à une position fixe dans l’échantillon, généralement composé de ~ 100-200 cadres, avec deux spectrale des canaux () g = vert canal, r = canal rouge). D’après la moyenne temporelle 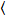 je
je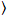 et la variance
et la variance 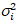 , la luminosité moléculaire εi et numéro nj’ai sont calculées dans chaque pixel et de canaux spectraux (j’ai = g, r)18:
, la luminosité moléculaire εi et numéro nj’ai sont calculées dans chaque pixel et de canaux spectraux (j’ai = g, r)18:
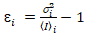 , (10).
, (10).
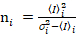 . (11)
. (11)
Il est important de noter que les équations données s’appliquent pour le cas idéal d’un vrai détecteur de comptage de photons. Pour les systèmes de détection analogique, les équations suivantes s’appliquent à19,20:
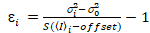 , (12).
, (12).
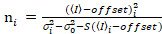 . (13)
. (13)
Ici, S est le facteur de conversion entre les photons détectés et les comtes numériques enregistrées, 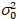 est le bruit de lecture et offset fait référence à l’offset d’intensité de détecteur. Généralement, ces quantités doivent être étalonnées, pour n’importe quel type de détecteur, basée sur la mesure de la variance du détecteur en fonction de l’intensité d’éclairage constant19, par exemple, une surface métallique réfléchissante ou solution de colorant séchées. Le décalage peut être déterminé en mesurant le taux de comptage pour un échantillon sans lumière d’excitation. En effectuant une régression linéaire de la variance associée à détecteur
est le bruit de lecture et offset fait référence à l’offset d’intensité de détecteur. Généralement, ces quantités doivent être étalonnées, pour n’importe quel type de détecteur, basée sur la mesure de la variance du détecteur en fonction de l’intensité d’éclairage constant19, par exemple, une surface métallique réfléchissante ou solution de colorant séchées. Le décalage peut être déterminé en mesurant le taux de comptage pour un échantillon sans lumière d’excitation. En effectuant une régression linéaire de la variance associée à détecteur 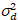 contre le tracé de l’intensité (I), S et
contre le tracé de l’intensité (I), S et 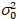 peut être déterminée19:
peut être déterminée19:
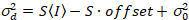 . (14)
. (14)
Enfin, la luminosité de la corrélation croisée est calculée dans chaque pixel et est définie en général comme21
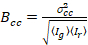 , (15).
, (15).
où 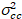 est la Croix et la variance
est la Croix et la variance 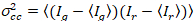 .
.
Pour filtrer les fluctuations à long terme, toutes les ccN & calculs B sont effectuées suivant un wagon couvert, filtrage, indépendamment pour chaque pixel22. En bref, ni, εj’ai (j’ai = g, r) et Bcc sont calculées en glissant des segments de p. ex. cadres de 8-15. Les valeurs ainsi obtenues peuvent être ensuite la moyenne pour obtenir le pixel final les valeurs de nombre et de la luminosité.
Analyse de stoechiométrie
Afin d’estimer la stoechiométrie des complexes protéiques à contacts cellule-cellule, la luminosité moléculaire peut être analysée séparément pour chaque voie spectral pour le sFCCS ou le ccN & B data. Dans sFCCS, une valeur de luminosité est obtenue par la mesure de chaque canal. Dans la ccN & B, on obtient un histogramme de luminosité des pixels situés correspondant au contact cellule-cellule et la valeur moyenne (ou médiane) peut servir de luminosité représentative pour la mesure. En effectuant la même analyse sur une référence monomère, toutes les valeurs de luminosité peuvent être normalisées pour obtenir directement l’État oligomère moyenne des complexes protéine détectée. À ce stade, il est important de corriger la présence de FPs non fluorescent pouvant entraîner une sous-estimation de l’État oligomère. Ceci est généralement effectuée par la mesure de la luminosité d’un homo-dimère référence protéine23,24 utilisant une couleur SCTS-m ou le numéro et la luminosité (N & B).
Protocol
Representative Results
Discussion
La procédure expérimentale décrite ici permet l’étude des protéines des interactions trans à contacts de cellule-cellule, employant des techniques de spectroscopie par fluorescence fluctuation, à savoir sFCCS et ccN & B. Ces méthodes impliquent une analyse statistique des variations de fluorescence émise par deux FPs spectralement séparés fusionnés pour les protéines d’intérêt au contact de deux cellules voisines, chacune exprimant l’un ou l’autre protéine de fusion. La présence de compl…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été partiellement soutenu par la Deutsche Forschungsgemeinschaft (DFG) accorder 254850309. Les auteurs remercient Madlen Luckner pour une lecture critique du manuscrit.
Materials
| DMEM growth medium | PAN-Biotech | P04-01548 | |
| DPBS w/o: Ca2+ and Mg2+ | PAN-Biotech | P04-36500 | |
| DPBS w: Ca2+ and Mg2+ | PAN-Biotech | P04-35500 | |
| Trypsin EDTA | PAN-Biotech | P10-023100 | |
| TurboFect Transfection Reagent | Thermo Fisher Scientific | R0531 | |
| HEK 293T cells | DSMZ | ACC 635 | |
| Alexa Fluor 488 NHS Ester | Thermo Fisher Scientific | A20000 | |
| Rhodamine B | Sigma-Alderich | 83689-1G | |
| Plasmid DNA | Addgene | NA | See reference 12 (Dunsing et. al., MBoC 2017),for a detailed description of all plasmids |
| 6-well plate | Starlab | CC7672-7506 | |
| 35-mm glass bottom dishes | CellVis | D35-14-1.5-N | |
| Zeiss LSM780 confocal | Carl Zeiss | NA | |
| MATLAB software package | MathWorks | 2015b | |
| Neubauer cell counting chamber | Marienfeld | 640110 |
References
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (2002).
- Tepass, U., Truong, K., Godt, D., Ikura, M., Peifer, M. Cadherins in embryonic and neural morphogenesis. Nature Reviews Molecular Cell Biology. 1 (2), 91-100 (2000).
- Harris, T. J. C., Tepass, U. Adherens junctions: from molecules to morphogenesis. Nature Reviews Molecular Cell Biology. 11 (7), 502-514 (2010).
- Hernández, J. M., Podbilewicz, B. The hallmarks of cell-cell fusion. Development. 144 (24), 4481-4495 (2017).
- Huppa, J. B., Davis, M. M. T-cell-antigen recognition and the immunological synapse. Nature Reviews Immunology. 3 (12), 973-983 (2003).
- Kaden, D., Voigt, P., Munter, L. -. M., Bobowski, K. D., Schaefer, M., Multhaup, G. Subcellular localization and dimerization of APLP1 are strikingly different from APP and APLP2. Journal of cell science. 122, 368-377 (2009).
- Yap, A. S., Michael, M., Parton, R. G. Seeing and believing: recent advances in imaging cell-cell interactions. F1000Research. 4, 273 (2015).
- Kashef, J., Franz, C. M. Quantitative methods for analyzing cell-cell adhesion in development. Biologie du développement. 401 (1), 165-174 (2015).
- Soba, P., et al. Homo- and heterodimerization of APP family members promotes intercellular adhesion. The EMBO Journal. 24 (20), 3624-3634 (2005).
- Kim, S. A., Tai, C. -. Y., Mok, L. -. P., Mosser, E. A., Schuman, E. M. Calcium-dependent dynamics of cadherin interactions at cell-cell junctions. Proceedings of the National Academy of Sciences of the United States of America. 108 (24), 9857-9862 (2011).
- Feinberg, E. H., et al. GFP Reconstitution Across Synaptic Partners (GRASP) Defines Cell Contacts and Synapses in Living Nervous Systems. Neuron. 57 (3), 353-363 (2008).
- Dunsing, V., Mayer, M., Liebsch, F., Multhaup, G., Chiantia, S. Direct evidence of amyloid precursor-like protein 1 trans interactions in cell-cell adhesion platforms investigated via fluorescence fluctuation spectroscopy. Molecular biology of the cell. 28 (25), 3609-3620 (2017).
- Schneider, F., et al. Diffusion of lipids and GPI-anchored proteins in actin-free plasma membrane vesicles measured by STED-FCS. Molecular Biology of the Cell. 28 (11), 1507-1518 (2017).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature methods. 3 (2), 83-89 (2006).
- Ries, J., Schwille, P. Studying Slow Membrane Dynamics with Continuous Wave Scanning Fluorescence Correlation Spectroscopy. Biophysical Journal. 91 (5), 1915-1924 (2006).
- Ries, J., Chiantia, S., Schwille, P. Accurate Determination of Membrane Dynamics with Line-Scan FCS. Biophysical Journal. 96 (5), 1999-2008 (2009).
- Chiantia, S., Ries, J., Schwille, P. Fluorescence correlation spectroscopy in membrane structure elucidation. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1788 (1), 225-233 (2009).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical journal. 94 (6), 2320-2332 (2008).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy research and technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of Molecular Concentration and Brightness from Fluorescence Fluctuation Data with an Electron Multiplied CCD Camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Digman, M. A., Wiseman, P. W., Choi, C., Horwitz, A. R., Gratton, E. Stoichiometry of molecular complexes at adhesions in living cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2170-2175 (2009).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. The FASEB journal official publication of the Federation of American Societies for Experimental Biology. 25 (9), 2883-2897 (2011).
- Dunsing, V., Luckner, M., Zühlke, B., Petazzi, R. A., Herrmann, A., Chiantia, S. Optimal fluorescent protein tags for quantifying protein oligomerization in living cells. Scientific Reports. 8 (1), 10634 (2018).
- Chen, Y., Johnson, J., Macdonald, P., Wu, B., Mueller, J. D. Observing Protein Interactions and Their Stoichiometry in Living Cells by Brightness Analysis of Fluorescence Fluctuation Experiments. Methods in enzymology. 472, 345-363 (2010).
- . Absolute Diffusion Coefficients: Compilation of Reference Data for FCS Calibration Available from: https://www.picoquant.com/images/uploads/page/files/7353/appnote_diffusioncoeffients.pdf (2010)
- Foo, Y. H., Naredi-Rainer, N., Lamb, D. C., Ahmed, S., Wohland, T. Factors affecting the quantification of biomolecular interactions by fluorescence cross-correlation spectroscopy. Biophysical journal. 102 (5), 1174-1183 (2012).
- Baum, M., Erdel, F., Wachsmuth, M., Rippe, K. Retrieving the intracellular topology from multi-scale protein mobility mapping in living cells. Nature Communications. 5, 4494 (2014).
- Wohland, T., Rigler, R., Vogel, H. The standard deviation in fluorescence correlation spectroscopy. Biophysical journal. 80 (6), 2987-2999 (2001).
- Ries, J., et al. Automated suppression of sample-related artifacts in Fluorescence Correlation Spectroscopy. Optics Express. 18 (11), 11073 (2010).
- Ries, J., Schwille, P. New concepts for fluorescence correlation spectroscopy on membranes. Physical Chemistry Chemical Physics. 10 (24), 3487 (2008).
- Mayer, M. C., et al. Amyloid precursor-like protein 1 (APLP1) exhibits stronger zinc-dependent neuronal adhesion than amyloid precursor protein and APLP2. Journal of Neurochemistry. 137 (2), 266-276 (2016).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Nolan, R., et al. nandb-number and brightness in R with a novel automatic detrending algorithm. Bioinformatics. 33 (21), 3508-3510 (2017).
- Hammond, G. R. V., Sim, Y., Lagnado, L., Irvine, R. F. Reversible binding and rapid diffusion of proteins in complex with inositol lipids serves to coordinate free movement with spatial information. The Journal of cell biology. 184 (2), 297-308 (2009).
- Hendrix, J., Dekens, T., Schrimpf, W., Lamb, D. C. Arbitrary-Region Raster Image Correlation Spectroscopy. Biophysical journal. 111 (8), 1785-1796 (2016).
- Hendrix, J., et al. Live-cell observation of cytosolic HIV-1 assembly onset reveals RNA-interacting Gag oligomers. The Journal of cell biology. 210 (4), 629-646 (2015).
- Hendrix, J., Schrimpf, W., Höller, M., Lamb, D. C. Pulsed Interleaved Excitation Fluctuation Imaging. Biophysical Journal. 105 (4), 848-861 (2013).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5 (1), 5412 (2014).
- Chojnacki, J., et al. Envelope glycoprotein mobility on HIV-1 particles depends on the virus maturation state. Nature Communications. 8 (1), 545 (2017).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Müller, J. D., Chen, Y., Gratton, E. Resolving Heterogeneity on the Single Molecular Level with the Photon-Counting Histogram. Biophysical Journal. 78 (1), 474-486 (2000).
- Kim, S. A., Heinze, K. G., Bacia, K., Waxham, M. N., Schwille, P. Two-Photon Cross-Correlation Analysis of Intracellular Reactions with Variable Stoichiometry. Biophysical Journal. 88 (6), 4319-4336 (2005).
- Jenkins, E., et al. Reconstitution of immune cell interactions in free-standing membranes. Journal of cell science. 132 (4), (2018).

