Флуоресценции колебания спектроскопии Assay белок белковых взаимодействий в ячейке контакты
Summary
Этот протокол описывает флуоресценции колебания спектроскопии-подход на основе для изучения взаимодействия белков, посредничество ячеек взаимодействия, т.е. белки локализованы в ячейке развязок, непосредственно в живых клетках. Мы предоставляем подробные руководящие принципы по калибровке, сбора и анализа данных, включая исправления возможных артефакт источникам.
Abstract
Целый ряд биологических процессов предполагает взаимодействие ячеек, обычно при посредничестве белки, которые взаимодействуют на уровне интерфейса между соседними ячейками. Интерес только несколько анализов способны конкретно зондирующего такого взаимодействия непосредственно в живых клетках. Здесь мы представляем assay измерить связывания белков, выраженных на поверхности соседние клетки, в ячейке контактов. Этот assay состоит из двух этапов: Микширование клеток, выражая протеинов интереса, сливается с различными флуоресцентных белков, следуют флуоресценции колебания спектроскопии измерений в ячейке контактов с помощью конфокальный лазерный сканирующий микроскоп. Мы продемонстрировать возможности этот assay в биологически соответствующий контекст путем измерения взаимодействия белков амилоида прекурсоров как 1 (APLP1) через узлы ячеек. Мы предоставляем подробные протоколы на сбор данных, используя методы, основанные на флуоресцирования (сканирование флуоресцентной спектроскопии кросс корреляции, номер кросс корреляции и анализа яркости) и требуемый инструмент калибровки. Кроме того мы обсуждаем важнейшие шаги в анализ данных и как определить и исправить внешний, ложный сигнал вариации, например, те из-за Фотообесцвечивание или ячейки движения.
В целом представленные применима к любому гомо – или гетеротипичной протеин взаимодействия в ячейке контактов, между ячейками в одной или разных типов и могут быть реализованы на коммерческой конфокальный лазерный сканирующий микроскоп. Важным требованием является стабильность системы, которая должна быть достаточной для зонда диффузионное динамики протеинов интереса в течение нескольких минут.
Introduction
Многие биологические процессы происходят на объектах ячеек взаимодействий, например, ячеек адгезии1,2,3, слияние ячеек4 и клеточных признание5. Такие мероприятия особенно важны во время развития многоклеточных организмов и для связи ячеек, например, во время иммунных реакций. Эти процессы обычно опосредовано белки, которые локализованы на поверхности, то есть, на плазматической мембраны (PM) соседних клеток и проходят специфических взаимодействий в контакт ячеек, которые точно регулируется в пространстве и времени. Во многих случаях эти взаимодействия прямого гомо – или гетеротипичной белок белковых взаимодействий транс , но может также включать ионов или лигандов, действуя как внеклеточного линкеры1. Несмотря на основополагающее значение, отсутствует анализов зондирующего эти конкретные белок белковых взаимодействий непосредственно в родной среде живых клеток. Многие методы либо требуют разрушения клеток (например, биохимических анализов как co иммунопреципитация6), фиксация (например, некоторые методы оптической микроскопии суперразрешением и электронной микроскопии ячеек Контакты7), или являются неспецифическими, например, агрегации / сцепления assays8,9. Для преодоления этой проблемы, были выполнены флуоресценции методы, основанные на флуоресценции резонансные энергии передачи (ЛАДА)10 или флуоресценции дополнения11. Однако чтобы добиться достаточно небольших расстояниях между флуорофоров, эти методы требуют флуоресцентные метки на стороне внеклеточных белков10, потенциально мешать транс взаимодействий.
Здесь мы представляем альтернативной основе флуоресценции assay для взаимодействий протеин протеина в ячейке контактов. Этот подход сочетает в себе флуоресценции кросс корреляции подходы (сканирование флуоресценции кросс корреляции спектроскопии (sFCCS), кросс корреляции номер и яркость (ccN & B)) и смешивания клеток, выражая конструкцию синтеза белка интерес, например, рецептор адгезии. Исследованы рецепторов в двух взаимодействующих клеток помечены с двумя спектрально разлученных флуоресцентных белков (FPs), от внутриклеточного стороне (см. рис. 1A).
Занятых методы основаны на статистическом анализе флуоресценции колебаний, вызванных диффузионного движения флуоресцентные синтез белков через фокуса тома конфокальный лазерный сканирующий микроскоп. Более подробно, assay зонды совместное распространение протеинов интереса в обеих соседних PMs в ячейке контактов. Если белки проходят транс взаимодействий, эти комплексы транс будет нести флуоресцентных белков в обоих спектральных каналов, вызывая колебания коррелированных флуоресценции обоих излучателей. С другой стороны если привязка не происходит, число колебаний белков сталкивается ПМС будет независимым, вызывая не коррелированные колебания. Приобретение может быть выполнена двумя способами: 1) sFCCS основана на линии образный сканирования через контакт клеток и эффективно зонды взаимодействий в месте, расположенная в регионе контакта. Через временной анализ колебаний флуоресценции sFCCS обеспечивает также динамика информацию, т.е. коэффициенты диффузии белковых комплексов; 2) ccN b & B на основе pixel-wise анализа последовательности изображений, приобретенных в регионах контактных ячеек. Он имеет возможность зонда и карта взаимодействия вдоль всего связаться региона (в одной фокальной плоскости), но не предоставляет информацию о динамике. Оба метода могут быть объединены с анализ молекулярных яркость, т.е. средняя флуоресценции сигнал излучаемый одного диффундирующих белковых комплексов в единицу времени и, таким образом, дают оценки стехиометрии белковых комплексов в Контакты ячеек.
В этой статье мы предоставляем подробные протоколы для пробоподготовки, поверки, сбора и анализа данных для выполнения представленных пробу на коммерческих конфокальный лазерный сканирующий микроскоп. Эксперименты могут выполняться на любом инструменте, оснащенных Фотон подсчета или аналоговые датчики и объективным с высоким числовая апертура. Мы далее обсудить важнейшие шаги протокола и обеспечивают коррекцию схемы для нескольких процессов, вызывая колебания артефакта сигнала, например, детектор шум, Фотообесцвечивание или ячейки движения. Первоначально разработанный прозондирует область взаимодействия между адэрентных клеток, assay может быть изменена для подвески клетки, или адаптированы к модели мембранных систем, например, гигантский однослойных везикул (GUVs) или гигантский плазменный мембрана везикулы (GPMVs), что позволяет количественное определение взаимодействий в средах различных липидов или в отсутствие организованной цитоскелета12,13.
Сканирование на страницу отдела Флуоресценция кросс корреляции представляет собой модифицированную версию флуоресцентной спектроскопии кросс корреляции14 и была специально разработана для зонда медленно диффузионное динамика в липидных мембран15. Он основан на линии сканирования приобретение перпендикулярно вечера, содержащий флуоресцентные белки интерес. Прозондирует область взаимодействия двух видов по-разному помечены белка, приобретение осуществляется в двух спектральных каналов, с помощью двух лазерных линий и два окна обнаружения для спектрально разлученных флуорофоров. Из-за медленного распространения динамики белков в ТЧ (D≤ ~ 1 мкм2/s), кросс talk свободные измерения могут быть выполнены путем чередования схемы возбуждения от линии к линии15. Анализ начинается с: 1) выравнивания алгоритм исправления для боковых клеточного движения на основе block-wise в среднем ~ 1000 линий, 2) определение положения с максимальной флуоресценции сигналато есть, вечера позиции, в каждом блоке и 3) Ветра из всех блоков для общего происхождения12,15, отдельно в каждом канале. Затем автоматический выбор пикселов, соответствующих вечера выполняется, выбрав Центральный регион от Гаусса fit суммы все выровненные линии (т.е., центр ± 2.5σ). Интеграция сигнала в каждой строке дает мембраны флуоресценции рядов F(t) в каждом канале (g = зеленый канал, r = красный канал). Обратите внимание, что размер пикселя должна быть небольшой достаточно, например, < 200 Нм, чтобы восстановить форму точки распространения функция и найти свой центр, соответствующие положения пп. При наличии существенных Фотообесцвечивание, флуоресценции временных рядов в каждом канале может быть смоделированы с двойной экспоненциальная функция и затем исправлены с помощью следующей формулы:16
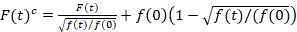 . (1)
. (1)
Важно отметить, что эта формула эффективно исправляет амплитуд и диффузии раз, полученные из корреляционного анализа F(t)c, по сравнению с оценки параметров, которые будут получены от нескорректированной F(t). Затем, функции auto – и кросс корреляции (ACFs / РСС) флуоресценции сигналы рассчитываются:
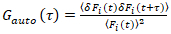 , (2).
, (2).
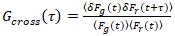 , (3).
, (3).
где δF,я = F,я(t) – 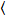 F,я(t)
F,я(t)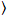 и я = g, r.
и я = g, r.
Двумерный диффузионная модель после этого приспособлена для всех корреляционных функций (CFs):
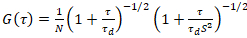 . (4)
. (4)
Здесь N обозначает количество флуоресцентных белков объема наблюдения и τd диффузии время для каждого канала. Эта модель принимает во внимание, что в параметре описанных экспериментальных, диффузии белков в Личку происходит в плоскости x-z, в отличие от часто используемые конфигурации флуоресценции корреляции спектроскопии (FCS) экспериментов на мембраны зондирование Диффузия в плоскости x-y конфокальный объем17. Талии w0 и структура фактора S, описывая удлинение wz фокуса тома в z, S = wz/w0, полученные из измерения Калибровка точки FCS, выступал с спектрально аналогичные красители и оптических параметров используя уже имеющиеся значения для коэффициента диффузии Dкраска:
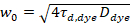 , (5).
, (5).
где τd, краска это измеренное среднее диффузии время краситель молекулы, полученные из установки модели для трехмерных распространения данных, принимая во внимание переходы дроби T всех N молекул в триплет государство с константой времени ττ:
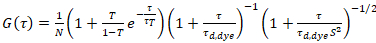 . (6)
. (6)
Наконец коэффициенты диффузии (D), значения молекулярных яркости (ε) и относительной кросс корреляции данных sFCCS (rel.cc.) рассчитываются следующим образом:
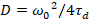 , (7).
, (7).
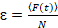 , (8).
, (8).
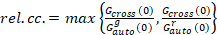 , (9).
, (9).
где Gкрест(0) является амплитуда функции кросс корреляции и 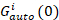 – амплитуда автокорреляционной функции в i-й канал.
– амплитуда автокорреляционной функции в i-й канал.
Это определение относительной кросс-корреляции, т.е. вместо Макс означает в уравнение 9, принимает во внимание, что максимальное количество комплексов двух видов белка в различных концентрациях ограничен в меньшее число видов.
Кросс корреляции номер и яркость основан на момент анализа интенсивности флуоресценции для каждого пикселя стека изображений приобрели со временем в фиксированном положении в образце, обычно состоящая из ~ 100-200 фоторамки, с двумя спектральных каналов () g = зеленый канал, r = красный канал). От височной среднего 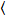 я
я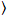 я и дисперсией
я и дисперсией 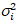 , молекулярный яркость εi и число n,я рассчитываются каждый пиксель и спектральных каналов (я = g, r)18:
, молекулярный яркость εi и число n,я рассчитываются каждый пиксель и спектральных каналов (я = g, r)18:
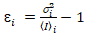 , (10).
, (10).
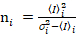 . (11)
. (11)
Важно отметить, что данного уравнения применяются в идеальном случае истинный Фотон подсчет детектора. Для обнаружения аналоговых систем следующие уравнения применяются19,20:
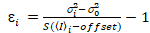 , (12).
, (12).
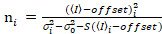 . (13)
. (13)
Здесь, S является коэффициент пересчета между обнаруженные фотоны и записи цифровых отсчетов, 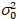 это шум считывания и смещение ссылается на смещение интенсивности детектор. Как правило эти количества должны калиброванные, для любого типа детектора, основанный на измерении детектор дисперсии в зависимости от интенсивности для постоянного освещения19, например, отражающей поверхности металла или сушеные краситель решение. Смещение может быть определена путем измерения скорость счета для образца без возбуждения света. Выполнив линейную регрессию детектор связанные дисперсии
это шум считывания и смещение ссылается на смещение интенсивности детектор. Как правило эти количества должны калиброванные, для любого типа детектора, основанный на измерении детектор дисперсии в зависимости от интенсивности для постоянного освещения19, например, отражающей поверхности металла или сушеные краситель решение. Смещение может быть определена путем измерения скорость счета для образца без возбуждения света. Выполнив линейную регрессию детектор связанные дисперсии 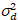 против интенсивности (я) сюжет, S и
против интенсивности (я) сюжет, S и 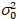 могут быть определены19:
могут быть определены19:
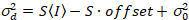 . (14)
. (14)
Наконец яркость кросс корреляции вычисляется в каждом пикселе и определяется в целом как21
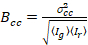 , (15).
, (15).
где 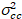 является кросс дисперсии
является кросс дисперсии 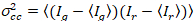 .
.
Чтобы отфильтровать долгоживущих колебания, все ccN & B расчеты выполняются после крытые вагоны, фильтрация, независимо для каждого пикселя22. Вкратце, ni, ε,я (я = g, r) и Bcc рассчитываются в скольжения сегментов например, 8-15 кадров. Таким образом полученные значения можно затем усредняются для получения последней точки номер и яркости.
Стехиометрия анализ
Для того чтобы оценить стехиометрии белковых комплексов в ячейке контактов, молекулярные яркости могут анализироваться отдельно в каждом спектральных канала для sFCCS или ccN & B данных. В sFCCS одно значение яркости получается за измерения в каждом канале. В ccN b & B гистограмма яркости всех пикселей, соответствующий контакт ячеек получается и значение средняя (или средний) может использоваться как представитель яркость для измерения. Выполняя такой же анализ на мономерных ссылку, все значения яркости могут быть нормированы непосредственно получить средний олигомерных состояние обнаруженного белковых комплексов. На данный момент важно исправить на наличие не флуоресцентные FPs, что может привести к недооценке олигомерных государства. Обычно это выполняется путем измерения яркости гомо димерной ссылкой белка23,–24 с помощью одно цвет sFCS или номер и яркость (N & B).
Protocol
Representative Results
Discussion
Экспериментальная процедура, описанная здесь позволяет расследование протеин транс взаимодействий в ячейке контактов, флуоресценции колебания спектроскопии методы, а именно sFCCS и ccN & B. Эти методы включают статистический анализ флуоресценции колебаний, излучаемых два спектральн…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Эта работа была частично поддерживается, Deutsche Forschungsgemeinschaft (DFG) Грант 254850309. Авторы благодарят Мадлен Luckner для критических чтении рукописи.
Materials
| DMEM growth medium | PAN-Biotech | P04-01548 | |
| DPBS w/o: Ca2+ and Mg2+ | PAN-Biotech | P04-36500 | |
| DPBS w: Ca2+ and Mg2+ | PAN-Biotech | P04-35500 | |
| Trypsin EDTA | PAN-Biotech | P10-023100 | |
| TurboFect Transfection Reagent | Thermo Fisher Scientific | R0531 | |
| HEK 293T cells | DSMZ | ACC 635 | |
| Alexa Fluor 488 NHS Ester | Thermo Fisher Scientific | A20000 | |
| Rhodamine B | Sigma-Alderich | 83689-1G | |
| Plasmid DNA | Addgene | NA | See reference 12 (Dunsing et. al., MBoC 2017),for a detailed description of all plasmids |
| 6-well plate | Starlab | CC7672-7506 | |
| 35-mm glass bottom dishes | CellVis | D35-14-1.5-N | |
| Zeiss LSM780 confocal | Carl Zeiss | NA | |
| MATLAB software package | MathWorks | 2015b | |
| Neubauer cell counting chamber | Marienfeld | 640110 |
References
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (2002).
- Tepass, U., Truong, K., Godt, D., Ikura, M., Peifer, M. Cadherins in embryonic and neural morphogenesis. Nature Reviews Molecular Cell Biology. 1 (2), 91-100 (2000).
- Harris, T. J. C., Tepass, U. Adherens junctions: from molecules to morphogenesis. Nature Reviews Molecular Cell Biology. 11 (7), 502-514 (2010).
- Hernández, J. M., Podbilewicz, B. The hallmarks of cell-cell fusion. Development. 144 (24), 4481-4495 (2017).
- Huppa, J. B., Davis, M. M. T-cell-antigen recognition and the immunological synapse. Nature Reviews Immunology. 3 (12), 973-983 (2003).
- Kaden, D., Voigt, P., Munter, L. -. M., Bobowski, K. D., Schaefer, M., Multhaup, G. Subcellular localization and dimerization of APLP1 are strikingly different from APP and APLP2. Journal of cell science. 122, 368-377 (2009).
- Yap, A. S., Michael, M., Parton, R. G. Seeing and believing: recent advances in imaging cell-cell interactions. F1000Research. 4, 273 (2015).
- Kashef, J., Franz, C. M. Quantitative methods for analyzing cell-cell adhesion in development. Biologie du développement. 401 (1), 165-174 (2015).
- Soba, P., et al. Homo- and heterodimerization of APP family members promotes intercellular adhesion. The EMBO Journal. 24 (20), 3624-3634 (2005).
- Kim, S. A., Tai, C. -. Y., Mok, L. -. P., Mosser, E. A., Schuman, E. M. Calcium-dependent dynamics of cadherin interactions at cell-cell junctions. Proceedings of the National Academy of Sciences of the United States of America. 108 (24), 9857-9862 (2011).
- Feinberg, E. H., et al. GFP Reconstitution Across Synaptic Partners (GRASP) Defines Cell Contacts and Synapses in Living Nervous Systems. Neuron. 57 (3), 353-363 (2008).
- Dunsing, V., Mayer, M., Liebsch, F., Multhaup, G., Chiantia, S. Direct evidence of amyloid precursor-like protein 1 trans interactions in cell-cell adhesion platforms investigated via fluorescence fluctuation spectroscopy. Molecular biology of the cell. 28 (25), 3609-3620 (2017).
- Schneider, F., et al. Diffusion of lipids and GPI-anchored proteins in actin-free plasma membrane vesicles measured by STED-FCS. Molecular Biology of the Cell. 28 (11), 1507-1518 (2017).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature methods. 3 (2), 83-89 (2006).
- Ries, J., Schwille, P. Studying Slow Membrane Dynamics with Continuous Wave Scanning Fluorescence Correlation Spectroscopy. Biophysical Journal. 91 (5), 1915-1924 (2006).
- Ries, J., Chiantia, S., Schwille, P. Accurate Determination of Membrane Dynamics with Line-Scan FCS. Biophysical Journal. 96 (5), 1999-2008 (2009).
- Chiantia, S., Ries, J., Schwille, P. Fluorescence correlation spectroscopy in membrane structure elucidation. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1788 (1), 225-233 (2009).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical journal. 94 (6), 2320-2332 (2008).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy research and technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of Molecular Concentration and Brightness from Fluorescence Fluctuation Data with an Electron Multiplied CCD Camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Digman, M. A., Wiseman, P. W., Choi, C., Horwitz, A. R., Gratton, E. Stoichiometry of molecular complexes at adhesions in living cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2170-2175 (2009).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. The FASEB journal official publication of the Federation of American Societies for Experimental Biology. 25 (9), 2883-2897 (2011).
- Dunsing, V., Luckner, M., Zühlke, B., Petazzi, R. A., Herrmann, A., Chiantia, S. Optimal fluorescent protein tags for quantifying protein oligomerization in living cells. Scientific Reports. 8 (1), 10634 (2018).
- Chen, Y., Johnson, J., Macdonald, P., Wu, B., Mueller, J. D. Observing Protein Interactions and Their Stoichiometry in Living Cells by Brightness Analysis of Fluorescence Fluctuation Experiments. Methods in enzymology. 472, 345-363 (2010).
- . Absolute Diffusion Coefficients: Compilation of Reference Data for FCS Calibration Available from: https://www.picoquant.com/images/uploads/page/files/7353/appnote_diffusioncoeffients.pdf (2010)
- Foo, Y. H., Naredi-Rainer, N., Lamb, D. C., Ahmed, S., Wohland, T. Factors affecting the quantification of biomolecular interactions by fluorescence cross-correlation spectroscopy. Biophysical journal. 102 (5), 1174-1183 (2012).
- Baum, M., Erdel, F., Wachsmuth, M., Rippe, K. Retrieving the intracellular topology from multi-scale protein mobility mapping in living cells. Nature Communications. 5, 4494 (2014).
- Wohland, T., Rigler, R., Vogel, H. The standard deviation in fluorescence correlation spectroscopy. Biophysical journal. 80 (6), 2987-2999 (2001).
- Ries, J., et al. Automated suppression of sample-related artifacts in Fluorescence Correlation Spectroscopy. Optics Express. 18 (11), 11073 (2010).
- Ries, J., Schwille, P. New concepts for fluorescence correlation spectroscopy on membranes. Physical Chemistry Chemical Physics. 10 (24), 3487 (2008).
- Mayer, M. C., et al. Amyloid precursor-like protein 1 (APLP1) exhibits stronger zinc-dependent neuronal adhesion than amyloid precursor protein and APLP2. Journal of Neurochemistry. 137 (2), 266-276 (2016).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Nolan, R., et al. nandb-number and brightness in R with a novel automatic detrending algorithm. Bioinformatics. 33 (21), 3508-3510 (2017).
- Hammond, G. R. V., Sim, Y., Lagnado, L., Irvine, R. F. Reversible binding and rapid diffusion of proteins in complex with inositol lipids serves to coordinate free movement with spatial information. The Journal of cell biology. 184 (2), 297-308 (2009).
- Hendrix, J., Dekens, T., Schrimpf, W., Lamb, D. C. Arbitrary-Region Raster Image Correlation Spectroscopy. Biophysical journal. 111 (8), 1785-1796 (2016).
- Hendrix, J., et al. Live-cell observation of cytosolic HIV-1 assembly onset reveals RNA-interacting Gag oligomers. The Journal of cell biology. 210 (4), 629-646 (2015).
- Hendrix, J., Schrimpf, W., Höller, M., Lamb, D. C. Pulsed Interleaved Excitation Fluctuation Imaging. Biophysical Journal. 105 (4), 848-861 (2013).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5 (1), 5412 (2014).
- Chojnacki, J., et al. Envelope glycoprotein mobility on HIV-1 particles depends on the virus maturation state. Nature Communications. 8 (1), 545 (2017).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Müller, J. D., Chen, Y., Gratton, E. Resolving Heterogeneity on the Single Molecular Level with the Photon-Counting Histogram. Biophysical Journal. 78 (1), 474-486 (2000).
- Kim, S. A., Heinze, K. G., Bacia, K., Waxham, M. N., Schwille, P. Two-Photon Cross-Correlation Analysis of Intracellular Reactions with Variable Stoichiometry. Biophysical Journal. 88 (6), 4319-4336 (2005).
- Jenkins, E., et al. Reconstitution of immune cell interactions in free-standing membranes. Journal of cell science. 132 (4), (2018).

