Un análisis de espectroscopia de fluorescencia fluctuación de interacciones de proteínas en los contactos célula-célula
Summary
Este protocolo describe un enfoque basado en la espectroscopia de la fluorescencia fluctuación para investigar las interacciones entre las proteínas median las interacciones célula-célula, es decir, proteínas localizadas en las ensambladuras de la célula, directamente en las células vivas. Ofrecemos directrices detalladas sobre la calibración del instrumento, adquisición de datos y análisis, incluyendo las correcciones a las fuentes de posible artefacto.
Abstract
Una variedad de procesos biológicos implica las interacciones célula-célula, generalmente mediadas por las proteínas que interactúan en la interfaz entre células vecinas. De interés, sólo algunos ensayos son capaces de sondear específicamente tales interacciones directamente en las células vivas. Aquí, presentamos un ensayo para medir la Unión de las proteínas expresadas en las superficies de las células vecinas, en los contactos célula-célula. Este análisis consisten de dos pasos: mezcla de células que expresan las proteínas de interés unida a diversas proteínas fluorescentes, seguido por las medidas de espectroscopia de fluorescencia fluctuación en los contactos de la célula usando un láser confocal de barrido microscopio. Demostramos la factibilidad de este ensayo en un contexto biológico pertinente mediante la medición de las interacciones de la proteína amiloidea del precursor-como 1 (APLP1) a través de las ensambladuras de la célula. Ofrecemos protocolos detallados en la adquisición de datos usando técnicas basadas en fluorescencia (análisis de espectroscopia de correlación cruzada de fluorescencia, número de la correlación cruzada y análisis de brillo) y las calibraciones del instrumento requerido. Además, discutimos los pasos críticos en el análisis de datos y cómo identificar y corregir las variaciones de la señal externa, falsas, tales como debido al movimiento de fotoblanqueo o celular.
En general, el análisis presentado es aplicable a cualquier homo – o heterotípicos proteínas interacción en los contactos de la célula, las células de las misma o diferentes tipos y pueden implementarse en un comercial láser confocal de barrido microscopio. Un requisito importante es la estabilidad del sistema, que debe ser suficiente para sondear la dinámica de difusión de las proteínas de interés durante varios minutos.
Introduction
Muchos procesos biológicos ocurren en los sitios de las interacciones célula-célula, por ejemplo, célula adhesión1,2,3, célula fusion4 y reconocimiento celular5. Estos eventos son particularmente importantes durante el desarrollo de los organismos multicelulares y para la comunicación de la célula, por ejemplo, durante la respuesta inmune. Estos procesos son típicamente mediados por las proteínas que se localizan en la superficie, es decir, en la membrana plasmática (PM) de los vecinos de las células y sufren interacciones en el contacto de la célula que son precisamente regulado en espacio y tiempo. En muchos casos, estas interacciones son directo homo – o heterotípicos proteínas trans interacciones, pero pueden también implicar iones o ligandos actuando como enlazadores extracelulares1. Aunque de fundamental importancia, hay una falta de análisis de sondeo estas interacciones proteína-proteína específica directamente en el ambiente natural de las células vivas. Muchos métodos requieren o interrupción de la célula (por ejemplo, ensayos bioquímicos tales como co-inmunoprecipitación6), fijación (por ejemplo, algunas de las técnicas de súper-resolución de microscopía óptica y microscopia electrónica de la célula contacto con7), o son no específicos, por ejemplo, la agregación / ensayos de adherencia8,9. Para resolver este problema, se han implementado técnicas de fluorescencia basada en fluorescencia de resonancia energética transferencia (traste)10 o fluorescencia complementación11. Sin embargo, para lograr distancias suficientemente pequeñas entre fluoróforos, estos métodos requieren etiquetas fluorescentes en el lado extracelular de las proteínas10, potencialmente interferir con las interacciones trans .
Aquí, presentamos un ensayo alternativo basado en la fluorescencia para las interacciones proteína-proteína en los contactos célula-célula. Este enfoque combina enfoques de cross-correlación de fluorescencia (análisis espectroscopia de correlación cruzada de fluorescencia (sFCCS), número de la correlación cruzada y brillo (ccN & B)) y la mezcla de células que expresan un concepto de fusión de la proteína de interés, por ejemplo, un receptor de adhesión. Los receptores investigados en las dos células interactuantes están marcados con dos proteínas fluorescentes separadas espectralmente (FPs), desde el intracelular lado (ver figura 1A).
Los métodos empleados se basan en el análisis estadístico de las fluctuaciones de la fluorescencia inducida por el movimiento difusivo de las proteínas fluorescentes de fusión a través del volumen focal de un láser confocal de barrido microscopio. Más detalladamente, el análisis de sondas la difusión conjunta de las proteínas de interés en ambos vecinos PMs en los contactos célula-célula. Si las proteínas se someten a las interacciones trans , estos complejos trans llevará a proteínas fluorescentes emiten en dos canales espectrales, causando fluorescencia correlacionada fluctuaciones de ambos emisores. Por otro lado, si se produce no vinculante, las fluctuaciones del número de proteínas frente a PMs será independientes, no causando fluctuaciones correlacionadas. La adquisición puede realizarse de dos maneras: 1) sFCCS se basa en un análisis en forma de línea a través del contacto célula-célula y efectiva puntas de prueba de las interacciones en un lugar situado en la región de contacto. A través de un análisis temporal de las fluctuaciones de la fluorescencia, sFCCS proporciona también información dinámica, es decir, los coeficientes de difusión de complejos de proteína; 2) ccN & B se basa en un análisis pixel-wise de una secuencia de imágenes adquiridas en las regiones de contacto célula-célula. Tiene capacidad para sondear y mapa interacciones a lo largo de toda la región (en un plano focal) de contacto, pero no proporciona información sobre la dinámica. Ambos métodos pueden combinarse con un análisis de la luminosidad molecular, es decir, la señal de fluorescencia promedio emitida en la unidad de tiempo por solo difunde complejos de proteína y, así, proporcionar estimaciones de la estequiometría de los complejos de proteína en contactos de la célula.
En este artículo, le ofrecemos protocolos detallados para la preparación de la muestra, calibración del instrumento, adquisición de datos y análisis realizar el ensayo presentado en un comercial láser confocal de barrido microscopio. Los experimentos pueden realizarse en cualquier instrumento equipado con conteo de fotones o detectores analógicos y un objetivo con alta apertura numérica. Además discutir pasos críticos del protocolo y proporcionar esquemas de corrección para varios procesos causando fluctuaciones de señal artefactual, p. ej., detector ruido, movimiento fotoblanqueo o celular. Originalmente desarrollado para probar las interacciones entre las células adherentes, el ensayo puede ser modificado para que las células de suspensión, o adaptados a los sistemas modelo de membranas, por ejemplo, propiedades gigantes vesículas (2.fino) o plasma gigante vesículas de membrana (GPMVs), que permite la cuantificación de las interacciones en entornos diferentes lípidos o en la ausencia de un citoesqueleto organizado12,13.
Análisis de espectroscopia de fluorescencia de la correlación cruzada es una versión modificada de la espectroscopia de correlación cruzada de fluorescencia14 y fue diseñado específicamente para sonda lenta dinámica difusión en membranas de lípidos15. Se basa en una adquisición de exploración de línea perpendicular a la PM que contiene las proteínas fluorescentes de interés. Para probar las interacciones de dos especies de proteínas diferentemente etiquetadas, la adquisición se realiza en dos canales espectrales usando dos líneas láser y dos ventanas de detección de fluoróforos espectralmente separados. Debido a la dinámica de la difusión lenta de las proteínas en el PM (D≤ ~ 1 μm2/s), puede realizarse una medición libre de charla Cruz alternando el esquema de excitación de la línea a la línea15. El análisis comienza con: 1) un algoritmo de alineamiento corregir para el movimiento lateral de la célula basado en block-wise con un promedio de ~ 1000 líneas, 2) determinación de la posición con fluorescencia máxima señales decir, el PM posición, en cada bloque y cambio de 3) de todos los bloques a un común origen12,15, por separado en cada canal. A continuación, una selección automática de píxeles correspondiente a la PM se realiza seleccionando la región central de un ajuste gaussiano de la suma de todas las líneas alineadas (es decir, centro ± 2.5σ). Integración de la señal en cada línea produce la membrana fluorescencia serie f (t) en cada canal (g = green canal, r = canal rojo). Nota que el tamaño del pixel ha de ser pequeño, por ejemplo, < 200 nm, para reconstruir la forma del punto de difundir la función y encontrar su centro, correspondiente a la posición de la PM. En presencia de fotoblanqueo substancial, la serie de tiempo de fluorescencia en cada canal puede modelada con una función doble exponencial y luego corregir con la fórmula siguiente:16
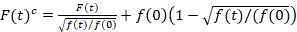 . (1)
. (1)
Es importante tener en cuenta que esta fórmula corrige eficazmente las amplitudes y tiempos de difusión obtenidos del análisis de correlación de f (t)c, en comparación con las estimaciones del parámetro que se obtendría de la no corregida f (t). Entonces, las funciones de auto – y la correlación cruzada (ACFs / CCFs) de la fluorescencia señales se calculan:
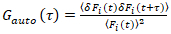 , (2).
, (2).
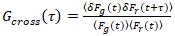 , (3).
, (3).
donde δF = F(t) – 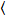 F(t)
F(t)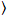 y = g, r.
y = g, r.
Un modelo de difusión bidimensional entonces se acopla a todas las funciones de correlación (SFC):
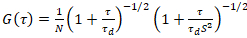 . (4)
. (4)
Aquí N denota el número de proteínas fluorescentes en el volumen de observación y τd el tiempo de difusión para cada canal. Este modelo toma en cuenta que en la configuración experimental descrita, difusión de proteínas en la PM se presenta en el plano x-z, en contraste con la configuración de uso general de correlación de fluorescencia espectroscopia (FCS) experimentos en las membranas de sondeo difusión en el plano x-y del confocal volumen17. La cintura w0 y el factor de estructura S, describiendo la elongación wz del volumen focal en z, S = wz/w0, se obtienen de una medida de calibración punto de FCS realizada con tintes espectral similares y misma configuración óptica utilizando valores ya están disponibles para el coeficiente de difusión Dtinte:
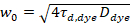 , (5).
, (5).
donde τd, tinte es el tiempo medido medio difusión de las moléculas de colorante, de un modelo de difusión tridimensional de los datos, teniendo en las transiciones de la cuenta de una fracción T de todas las moléculas de N a una Estado triplete con una constante de tiempo ττ:
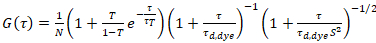 . (6)
. (6)
Por último, coeficientes de difusión (D), los valores de brillo molecular (ε) y la relativa correlación cruzada de datos sFCCS (rel.cc.) se calculan como sigue:
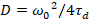 , (7).
, (7).
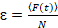 , (8).
, (8).
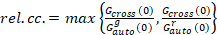 , (9).
, (9).
donde GCruz(0) es la amplitud de la función de correlación cruzada y 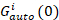 es la amplitud de la función de autocorrelación en el -ésimo canal.
es la amplitud de la función de autocorrelación en el -ésimo canal.
Esta definición de la relativa correlación cruzada, es decir, utilizando máximo en lugar de decir en la ecuación 9, toma en cuenta que el número máximo de conjuntos de dos especies de proteínas presentes en diferentes concentraciones se ve limitado por la especies presentes en un número inferior.
Brillo y el número de la correlación cruzada se basa en un análisis del momento de la intensidad de fluorescencia para cada píxel de una pila de imagen adquirida con el tiempo en una posición fija en la muestra, por lo general consisten en ~ 100-200 marcos, con dos espectral canales () g = green canal, r = canal rojo). De la media temporal 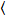 I
I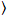 i y varianza
i y varianza 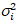 , el brillo molecular εi y número n se calculan en cada pixel y canal espectral ( = g, r)18:
, el brillo molecular εi y número n se calculan en cada pixel y canal espectral ( = g, r)18:
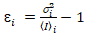 , (10).
, (10).
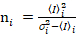 . (11)
. (11)
Es importante tener en cuenta que las ecuaciones dadas se aplican al caso ideal de un verdadero detector de recuento de fotones. Las ecuaciones siguientes aplican para sistemas de detección analógico,19,20:
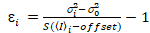 , (12).
, (12).
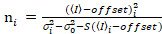 . (13)
. (13)
Aquí, S es el factor de conversión entre fotones detectados y las cuentas de digitales grabadas, 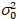 es el ruido de lectura y offset se refiere a la compensación de la intensidad de detector. Por lo general, estas cantidades se deberán calibrar, para cualquier tipo de detector, basado en la medición de la variación del detector en función de la intensidad de iluminación constante19, p. ej., una superficie metálica reflectora o solución colorante seco. El offset puede determinarse midiendo la tasa de conteo para una muestra sin luz de excitación. Realizando una regresión lineal de la varianza asociados detector
es el ruido de lectura y offset se refiere a la compensación de la intensidad de detector. Por lo general, estas cantidades se deberán calibrar, para cualquier tipo de detector, basado en la medición de la variación del detector en función de la intensidad de iluminación constante19, p. ej., una superficie metálica reflectora o solución colorante seco. El offset puede determinarse midiendo la tasa de conteo para una muestra sin luz de excitación. Realizando una regresión lineal de la varianza asociados detector 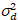 contra la trama de la intensidad (), S y
contra la trama de la intensidad (), S y 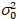 puede ser resuelto19:
puede ser resuelto19:
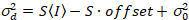 . (14)
. (14)
Por último, el brillo de la correlación cruzada se calcula en cada pixel y se define en general como21
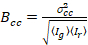 , (15).
, (15).
donde 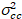 es la varianza de la Cruz
es la varianza de la Cruz 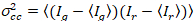 .
.
Para filtrar las fluctuaciones de larga duración, todos ccN y cálculos de B se realizan siguiendo un furgón filtrado, independientemente para cada pixel22. En Resumen, ni, ε ( = g, r) y Bcc se calculan en desplazamiento de segmentos de p. ej., 8-15 marcos. Los valores así obtenidos pueden ser promediados entonces para obtener el pixel final valores de número y brillo.
Análisis de la estequiometría
Para estimar la estequiometría de los complejos de la proteína en los contactos célula-célula, el brillo molecular puede analizarse por separado en cada canal espectral para la sFCCS o ccN y B los datos. En sFCCS, un valor de brillo se obtiene por medición de cada canal. En ccN y B, se obtiene un histograma de brillo de los píxeles correspondientes al contacto célula-célula y el valor promedio (o mediano) puede utilizarse como brillo representativo para la medición. Por realizar el mismo análisis en referencia monomérica, todos los valores de brillo pueden ser normalizados para obtener directamente el estado oligomérico promedio de los complejos de proteína detectado. En este punto, es importante corregir la presencia de FPs no fluorescente que puede resultar en una subestimación del estado oligomérico. Normalmente esto se realiza midiendo el brillo de un homo dimérico referencia proteína23,24 con sFCS un color o número y el brillo (N & B).
Protocol
Representative Results
Discussion
El procedimiento experimental que se describe aquí permite la investigación de proteínas trans interacciones en los contactos célula-célula, empleando técnicas de espectroscopia fluctuación de fluorescencia, a saber sFCCS y ccN & B. Estos métodos implican un análisis estadístico de las fluctuaciones de la fluorescencia emitida por dos separados espectralmente FPs fusionado a la proteína de interés en un contacto de dos células vecinas, cada una expresando uno o la otra proteína de fusión. La prese…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue parcialmente financiado por la Deutsche Forschungsgemeinschaft (DFG) conceder 254850309. Los autores agradecen Madlen Luckner para lectura crítica del manuscrito.
Materials
| DMEM growth medium | PAN-Biotech | P04-01548 | |
| DPBS w/o: Ca2+ and Mg2+ | PAN-Biotech | P04-36500 | |
| DPBS w: Ca2+ and Mg2+ | PAN-Biotech | P04-35500 | |
| Trypsin EDTA | PAN-Biotech | P10-023100 | |
| TurboFect Transfection Reagent | Thermo Fisher Scientific | R0531 | |
| HEK 293T cells | DSMZ | ACC 635 | |
| Alexa Fluor 488 NHS Ester | Thermo Fisher Scientific | A20000 | |
| Rhodamine B | Sigma-Alderich | 83689-1G | |
| Plasmid DNA | Addgene | NA | See reference 12 (Dunsing et. al., MBoC 2017),for a detailed description of all plasmids |
| 6-well plate | Starlab | CC7672-7506 | |
| 35-mm glass bottom dishes | CellVis | D35-14-1.5-N | |
| Zeiss LSM780 confocal | Carl Zeiss | NA | |
| MATLAB software package | MathWorks | 2015b | |
| Neubauer cell counting chamber | Marienfeld | 640110 |
References
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P. . Molecular biology of the cell. , (2002).
- Tepass, U., Truong, K., Godt, D., Ikura, M., Peifer, M. Cadherins in embryonic and neural morphogenesis. Nature Reviews Molecular Cell Biology. 1 (2), 91-100 (2000).
- Harris, T. J. C., Tepass, U. Adherens junctions: from molecules to morphogenesis. Nature Reviews Molecular Cell Biology. 11 (7), 502-514 (2010).
- Hernández, J. M., Podbilewicz, B. The hallmarks of cell-cell fusion. Development. 144 (24), 4481-4495 (2017).
- Huppa, J. B., Davis, M. M. T-cell-antigen recognition and the immunological synapse. Nature Reviews Immunology. 3 (12), 973-983 (2003).
- Kaden, D., Voigt, P., Munter, L. -. M., Bobowski, K. D., Schaefer, M., Multhaup, G. Subcellular localization and dimerization of APLP1 are strikingly different from APP and APLP2. Journal of cell science. 122, 368-377 (2009).
- Yap, A. S., Michael, M., Parton, R. G. Seeing and believing: recent advances in imaging cell-cell interactions. F1000Research. 4, 273 (2015).
- Kashef, J., Franz, C. M. Quantitative methods for analyzing cell-cell adhesion in development. Biologie du développement. 401 (1), 165-174 (2015).
- Soba, P., et al. Homo- and heterodimerization of APP family members promotes intercellular adhesion. The EMBO Journal. 24 (20), 3624-3634 (2005).
- Kim, S. A., Tai, C. -. Y., Mok, L. -. P., Mosser, E. A., Schuman, E. M. Calcium-dependent dynamics of cadherin interactions at cell-cell junctions. Proceedings of the National Academy of Sciences of the United States of America. 108 (24), 9857-9862 (2011).
- Feinberg, E. H., et al. GFP Reconstitution Across Synaptic Partners (GRASP) Defines Cell Contacts and Synapses in Living Nervous Systems. Neuron. 57 (3), 353-363 (2008).
- Dunsing, V., Mayer, M., Liebsch, F., Multhaup, G., Chiantia, S. Direct evidence of amyloid precursor-like protein 1 trans interactions in cell-cell adhesion platforms investigated via fluorescence fluctuation spectroscopy. Molecular biology of the cell. 28 (25), 3609-3620 (2017).
- Schneider, F., et al. Diffusion of lipids and GPI-anchored proteins in actin-free plasma membrane vesicles measured by STED-FCS. Molecular Biology of the Cell. 28 (11), 1507-1518 (2017).
- Bacia, K., Kim, S. A., Schwille, P. Fluorescence cross-correlation spectroscopy in living cells. Nature methods. 3 (2), 83-89 (2006).
- Ries, J., Schwille, P. Studying Slow Membrane Dynamics with Continuous Wave Scanning Fluorescence Correlation Spectroscopy. Biophysical Journal. 91 (5), 1915-1924 (2006).
- Ries, J., Chiantia, S., Schwille, P. Accurate Determination of Membrane Dynamics with Line-Scan FCS. Biophysical Journal. 96 (5), 1999-2008 (2009).
- Chiantia, S., Ries, J., Schwille, P. Fluorescence correlation spectroscopy in membrane structure elucidation. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1788 (1), 225-233 (2009).
- Digman, M. A., Dalal, R., Horwitz, A. F., Gratton, E. Mapping the number of molecules and brightness in the laser scanning microscope. Biophysical journal. 94 (6), 2320-2332 (2008).
- Dalal, R. B., Digman, M. A., Horwitz, A. F., Vetri, V., Gratton, E. Determination of particle number and brightness using a laser scanning confocal microscope operating in the analog mode. Microscopy research and technique. 71 (1), 69-81 (2008).
- Unruh, J. R., Gratton, E. Analysis of Molecular Concentration and Brightness from Fluorescence Fluctuation Data with an Electron Multiplied CCD Camera. Biophysical Journal. 95 (11), 5385-5398 (2008).
- Digman, M. A., Wiseman, P. W., Choi, C., Horwitz, A. R., Gratton, E. Stoichiometry of molecular complexes at adhesions in living cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (7), 2170-2175 (2009).
- Hellriegel, C., Caiolfa, V. R., Corti, V., Sidenius, N., Zamai, M. Number and brightness image analysis reveals ATF-induced dimerization kinetics of uPAR in the cell membrane. The FASEB journal official publication of the Federation of American Societies for Experimental Biology. 25 (9), 2883-2897 (2011).
- Dunsing, V., Luckner, M., Zühlke, B., Petazzi, R. A., Herrmann, A., Chiantia, S. Optimal fluorescent protein tags for quantifying protein oligomerization in living cells. Scientific Reports. 8 (1), 10634 (2018).
- Chen, Y., Johnson, J., Macdonald, P., Wu, B., Mueller, J. D. Observing Protein Interactions and Their Stoichiometry in Living Cells by Brightness Analysis of Fluorescence Fluctuation Experiments. Methods in enzymology. 472, 345-363 (2010).
- . Absolute Diffusion Coefficients: Compilation of Reference Data for FCS Calibration Available from: https://www.picoquant.com/images/uploads/page/files/7353/appnote_diffusioncoeffients.pdf (2010)
- Foo, Y. H., Naredi-Rainer, N., Lamb, D. C., Ahmed, S., Wohland, T. Factors affecting the quantification of biomolecular interactions by fluorescence cross-correlation spectroscopy. Biophysical journal. 102 (5), 1174-1183 (2012).
- Baum, M., Erdel, F., Wachsmuth, M., Rippe, K. Retrieving the intracellular topology from multi-scale protein mobility mapping in living cells. Nature Communications. 5, 4494 (2014).
- Wohland, T., Rigler, R., Vogel, H. The standard deviation in fluorescence correlation spectroscopy. Biophysical journal. 80 (6), 2987-2999 (2001).
- Ries, J., et al. Automated suppression of sample-related artifacts in Fluorescence Correlation Spectroscopy. Optics Express. 18 (11), 11073 (2010).
- Ries, J., Schwille, P. New concepts for fluorescence correlation spectroscopy on membranes. Physical Chemistry Chemical Physics. 10 (24), 3487 (2008).
- Mayer, M. C., et al. Amyloid precursor-like protein 1 (APLP1) exhibits stronger zinc-dependent neuronal adhesion than amyloid precursor protein and APLP2. Journal of Neurochemistry. 137 (2), 266-276 (2016).
- Linkert, M., et al. Metadata matters: access to image data in the real world. The Journal of Cell Biology. 189 (5), 777-782 (2010).
- Trullo, A., Corti, V., Arza, E., Caiolfa, V. R., Zamai, M. Application limits and data correction in number of molecules and brightness analysis. Microscopy Research and Technique. 76 (11), 1135-1146 (2013).
- Nolan, R., et al. nandb-number and brightness in R with a novel automatic detrending algorithm. Bioinformatics. 33 (21), 3508-3510 (2017).
- Hammond, G. R. V., Sim, Y., Lagnado, L., Irvine, R. F. Reversible binding and rapid diffusion of proteins in complex with inositol lipids serves to coordinate free movement with spatial information. The Journal of cell biology. 184 (2), 297-308 (2009).
- Hendrix, J., Dekens, T., Schrimpf, W., Lamb, D. C. Arbitrary-Region Raster Image Correlation Spectroscopy. Biophysical journal. 111 (8), 1785-1796 (2016).
- Hendrix, J., et al. Live-cell observation of cytosolic HIV-1 assembly onset reveals RNA-interacting Gag oligomers. The Journal of cell biology. 210 (4), 629-646 (2015).
- Hendrix, J., Schrimpf, W., Höller, M., Lamb, D. C. Pulsed Interleaved Excitation Fluctuation Imaging. Biophysical Journal. 105 (4), 848-861 (2013).
- Honigmann, A., et al. Scanning STED-FCS reveals spatiotemporal heterogeneity of lipid interaction in the plasma membrane of living cells. Nature Communications. 5 (1), 5412 (2014).
- Chojnacki, J., et al. Envelope glycoprotein mobility on HIV-1 particles depends on the virus maturation state. Nature Communications. 8 (1), 545 (2017).
- Godin, A. G., et al. Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis. Proceedings of the National Academy of Sciences of the United States of America. 108 (17), 7010-7015 (2011).
- Müller, J. D., Chen, Y., Gratton, E. Resolving Heterogeneity on the Single Molecular Level with the Photon-Counting Histogram. Biophysical Journal. 78 (1), 474-486 (2000).
- Kim, S. A., Heinze, K. G., Bacia, K., Waxham, M. N., Schwille, P. Two-Photon Cross-Correlation Analysis of Intracellular Reactions with Variable Stoichiometry. Biophysical Journal. 88 (6), 4319-4336 (2005).
- Jenkins, E., et al. Reconstitution of immune cell interactions in free-standing membranes. Journal of cell science. 132 (4), (2018).

