Utilisation d’unique molécule fluorescente hybridation In Situ (FISH-SM) afin de quantifier et Localize ARNm dans les ovocytes murin
Summary
Pour compter reproductible les numéros des ARNm dans les ovocytes, in situ en fluorescence seule molécule RNA hybridation (RNA-poisson) a été optimisée pour les cellules non adhérentes. Ovocytes ont été recueillis, hybridaient avec des sondes spécifiques de transcription et quantifiées à l’aide d’un logiciel de quantification d’image.
Abstract
Cours méthodes couramment utilisées pour quantifier les ARNm d’ovocytes et d’embryons incluent réaction en chaîne de polymérase de transcription inverse numérique (dPCR), RT-PCR quantitative, en temps réel (RT-qPCR) et le séquençage de RNA. Lorsque ces techniques sont effectuées à l’aide d’un seul ovocyte ou embryon, ARNm de faibles copies n’est pas détectées avec fiabilité. Pour surmonter ce problème, des ovocytes ou des embryons peuvent être regroupés ensemble pour l’analyse ; Toutefois, cela conduit souvent à la grande variabilité entre les échantillons. Dans ce protocole, nous décrivons l’utilisation de l’hybridation in situ fluorescence (FISH) à l’aide de chimie de l’ADN ramifié. Cette technique identifie la répartition spatiale des ARNm dans les cellules individuelles. Lorsque la technique est associée à la recherche de Spot et logiciels de suivi, l’abondance des ARNm dans les cellules peut également être quantifiée. En utilisant cette technique, il existe une variabilité réduite au sein d’un groupe expérimental et moins des ovocytes et des embryons sont nécessaires pour détecter des différences significatives entre les groupes expérimentaux. Disponible dans le commerce ramifiée ADN-SM-kits de poissons ont été optimisés pour détecter les ARNm de coupes de tissus ou cellules adhérentes sur des lames. Cependant, les ovocytes n’adhèrent pas efficacement aux diapositives et certains réactifs de la trousse ont été trop sévères, aboutissant à la lyse de l’ovocyte. Pour éviter cette lyse, plusieurs modifications ont été apportées au kit de poissons. Plus précisément, tampons conçus pour l’immunofluorescence des ovocytes et des embryons de la perméabilisation et lavage ovocyte remplacé les tampons exclusifs. La perméabilisation, lavages et incubations avec amplificateur et sondes ont été réalisées en plaques 6 puits et ovocytes ont été placés sur des lames à la fin du protocole à l’aide de supports de montage. Ces modifications ont été en mesure de surmonter les limitations de la trousse disponible dans le commerce, en particulier, la lyse de l’ovocyte. Pour avec précision et de façon reproductible, compter le nombre des ARNm dans les ovocytes, logiciels a été utilisé. Ensemble, ce protocole représente une alternative à la PCR et séquençage de comparer l’expression des transcriptions précises dans des cellules individuelles.
Introduction
La transcriptase inverse amplification génique (PCR) a été l’étalon-or pour le dosage de l’ARNm. Deux essais, digital PCR (dPCR)1 et quantitative, real time PCR (qPCR)2 sont actuellement utilisés. De ces deux techniques PCR, dPCR a une plus grande sensibilité que qPCR suggérant qu’il pourrait être utilisé pour mesurer l’abondance d’ARNm dans les cellules. Toutefois, dans nos mains, dPCR analyse des ARNm de faible abondance dans les piscines de 5 à 10 ovocytes par chaque échantillon expérimental a produit des données avec faible reproductibilité et de la forte variation3. C’est probablement à cause de l’erreur expérimentale, associé à l’extraction de l’ARN et l’efficacité de la transcriptase inverse. Séquençage de RNA a également effectué à l’aide d’une seule souris et les ovocytes humains4,5. Cette technique requiert des étapes d’amplification de cDNA requis pour la génération de la bibliothèque qui augmente probablement la variabilité au sein d’un groupe expérimental. En outre, les transcriptions de faible abondance ne peuvent pas être détectables. Bien que les prix de séquençage ont baissé ces dernières années, il peut encore être coût prohibitif en raison du coût élevé des analyses bioinformatiques. Enfin, localisation de l’ARNm est un processus dynamique avec des changements spatiaux contribuant à la fonction de protéine6. Par conséquent, nous partîmes à adopter une technique qui produirait des mesures quantitatives précises et reproductibles et localisation des différents mRNAs dans les ovocytes unique.
ADN ramifié couplé à l’hybridation in situ fluorescence amplifie le signal de fluorescence plutôt qu’amplification RNA/cDNA habilitante détection seul ARNm dans les cellules individuelles 7,8,9. L’analyse est réalisée à travers une série d’hybridation, amplification (en utilisant l’ADN ramifié) et fluorescence d’étiquetage afin d’amplifier le signal de fluorescence7étapes. La technique commence par liaison de paires de sonde oligonucléotide de 18 à 25 la base qui sont complémentaires à un8,3,d’ARNm spécifiques10. Quinze à vingt paires de sonde sont conçues pour chaque spécificité de veiller à ce que de transcription pour la transcription de la cible. L’hybridation de l’ARNm spécifique est suivie d’un préamplificateur et amplificateur des sondes qui forment une configuration ramifiée. Environ 400 étiquette fluorophores lier à chaque amplificateur, résultant en une 8000-fold augmentation de fluorescence permettant la détection des différents mRNAs (Figure 1)11.
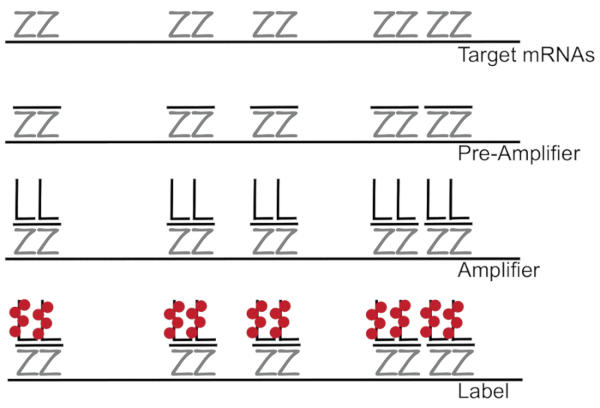
Figure 1 : schéma du protocole SM-poisson. Séquentielle hybridation d’une sonde spécifique de transcription, ramifiée amplificateur ADN et fluorophore vers une cible apparaît à l’ARNm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Des études antérieures utilisant des molécules simples fluorescence in situ hybridation (SM-FISH) localisée β-actine ARNm dans différents neurones12 et virus du papillome humain ADN dans le cancer du col utérin cellule lignes7. Les logiciels Spot trouver et Tracking Program identifie chaque signal fluorescent ponctuée et a été utilisé avec succès pour quantifier le nombre des ARNm dans chaque cellule3,13.
Selon les résultats de détection de l’ARNm dans les neurones12, nous avons supposé que SM-poisson s’avérera un outil utile pour quantifier les niveaux de transcription en murines ovocytes et d’embryons, y compris les ARNm de faible abondance. Cependant, la technique est optimisée pour une utilisation avec les cellules adhérentes fixes et formaldéhyde fixé paraffine intégrée des sections de tissu (FFIP). Ovocytes ne peuvent adhérer à une diapositive, même lorsqu’ils sont revêtus de la Poly-L-lysine. En outre, ils sont plus fragiles que les cellules somatiques et des sections de tissu ce qui entraîne la lyse des cellules lorsqu’elles sont soumises à certains des tampons exclusifs dans les kits disponibles dans le commerce3. Pour surmonter ces défis, les ovocytes ont été fixe et transférées manuellement entre les gouttes des tampons. En outre, tampons perméabilisation et de lavage dans les kits ont été remplacés pour réduire la lyse cellulaire. Sondes prédéfinis sont achetées aux côtés de la trousse de poissons ou des relevés de notes spécifiques peuvent être demandés. Chaque propriétaire de sonde est disponible dans l’un des trois canaux de fluorescence (C1, C2 et C3) permettant de multiplexage. Dans l’expérience actuelle, murins ovocytes étaient chiffrés à l’aide d’une sonde de C2 Nanog et une sonde de C3 Pou5f1 et double marquage. Ces sondes ont été choisis sur l’expression signalée de Nanog et Pou5f1 d’ovocytes et d’embryons. À l’issue de la procédure d’hybridation, ovocytes ont été placés en gouttes de supports de montage de l’anti-fondu pour application à histologiques. Images confocales ont été utilisées pour quantifier le nombre de signaux fluorescents ponctuées, qui représentent différents mRNAs. En plus de la quantification de l’ARNm, imagerie a également montré la distribution spatiale de l’ARNm spécifique dans la cellule, quelles autres méthodes de quantification ARN sont incapables d’atteindre. Cette technique s’est avérée pour avoir faible variabilité au sein d’un groupe expérimental permettant l’utilisation de plus petits nombres d’ovocytes dans chaque groupe expérimental afin d’identifier des différences significatives entre les groupes expérimentaux3.
Protocol
Representative Results
Discussion
Une série de mesures mineures pendant le protocole assurera succès fluorescence et comptages précis des ARNm. Tout d’abord, le protocole doit être effectué immédiatement après la collecte et la fixation des ovocytes. Notez que le PVP est ajoutée au tampon de fixation paraformaldéhyde à 4 % pour empêcher des ovocytes de coller les uns aux autres. Nous avons constaté qu’il est nécessaire réaliser l’expérience immédiatement après la collecte et la fixation des ovocytes. Tout retard entraîne un beauco…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Nous remercions le Dr Daniel R. Larson pour son aide généreuse avec l’installation et l’utilisation de la recherche de Spot et de Tracking Program 13 et l’appui technique de l’Université du Nebraska Lincoln microscopie Core pour l’imagerie de la microscopie confocale. Cette étude représente une contribution de l’Université du Nebraska Agricultural Research Division, Lincoln, Nebraska et a été soutenue par des fonds de Hatch UNL (NEB-26-206/numéro d’ordre-232435 et NEB-26-231/numéro d’ordre-1013511).
Materials
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
References
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).

