マウス卵母細胞における定量化するため、Localize Mrna に単一分子蛍光そのままの交配 (SM 魚) の使用
Summary
再現性をもって RNA の単一分子蛍光 in-situ 個々 卵母細胞における Mrna の数字をカウントするには、交配 (RNA 魚) 非付着性のセルの最適化を行った。卵子採取、トラン スクリプトの特定プローブとハイブリダイズし、画像定量化ソフトウェアを用いて定量化します。
Abstract
デジタルの逆転写ポリメラーゼ連鎖反応 (dPCR)、量的、リアルタイム RT-PCR (RT qPCR) RNA シーケンスなど日常的に卵子および胚の mRNA を定量化するために使用する現在の方法。これらの技術を実行するには、単一の卵や胚を使用して、低コピー Mrna は確実に検出されません。この問題を克服するために卵子や胚をプールできる一緒に分析。しかし、これは多くの場合サンプルの中で高い可変性に します。このプロトコルでは、蛍光 in situ ハイブリダイゼーション (魚) 分岐 DNA 化学を使用しての使用を記述します。この手法は、個々 の細胞における Mrna の空間パターンを識別します。スポットを見つけると追跡コンピューター ソフトウェア技術を結合すると、細胞における Mrna の豊かさも定量化することができます。実験グループ内で減少の変動は, この手法を使用して、および少数の卵子および胚は実験群間に有意差を検出するために必要な。市販の分岐 DNA SM-魚キットは、断面化された組織またはスライド上の付着性のセルの Mrna を検出する最適化されています。しかし、卵子がスライドに効果的に準拠していない、いくつかの試薬キットであった卵母細胞の換散の結果があまりにも厳しかった。この溶解を防ぐためには、魚のキットにいくつかの変更が行われました。具体的には、卵子および胚の蛍光用に設計された卵母細胞透過および洗浄バッファーでは、独自のバッファーが置き換えられます。6 ウェル プレートで透過、洗浄、およびプローブ増幅器と孵化を行ったし、メディアをマウントを使用するプロトコルの最後にスライドに卵が置かれました。卵母細胞の換散特に、市販キットの限界を克服するためには、これらの変更ができた。正確かつ再現性をもって個々 の卵母細胞における Mrna の数をカウントする、コンピューターのソフトウェアを使用しました。一緒に、このプロトコルは PCR とシーケンスは、単一セルの特定のコピーの式を比較する方法を表します。
Introduction
逆転写酵素ポリメラーゼ連鎖反応 (PCR) mRNA 定量の金の標準となっています。2 つの試金、デジタル PCR (dPCR)1および定量的なリアル タイム PCR (qPCR)2現在使用されます。2 つの PCR 技術の dPCR は qPCR 示唆それは単一細胞における mRNA 量測定に使用することができるよりも高い感度です。しかし、私たちの手で各実験サンプルあたり 5 に 10 卵母細胞のプールで低豊富 dPCR 解析は低再現性と高いバリエーション3データを生産しています。これは RNA の抽出および逆のトランスクリプションの効率性に関連する実験的なエラー可能性があります。RNA シーケンスも単一のマウスと人間の卵子4,5を使用して行われています。この手法には、ライブラリを生成可能性が実験群内変動を増加させるために必要な cDNA 増幅手順が必要です。さらに、低豊富な成績証明書を検出できない場合があります。シーケンスの価格は、ここ数年ダウンしている、バイオインフォマティクス解析のコストが高いため法外なコストすることができます。最後に、mRNA の局在は、タンパク質機能6に貢献して空間的変化とダイナミックなプロセスです。そのため、正確かつ再現可能な量的および単一卵母細胞個々 の mRNAs のローカリゼーションを生成する手法を採用に着手しました。
蛍光 in situ ハイブリダイゼーションと結合した分岐 DNA 増幅蛍光信号ではなく、個々 のセル7,8,9の単一の Mrna の増幅の RNA/cDNA 有効に検出します。アッセイは、一連のハイブリダイゼーション、増幅 (分岐 DNA を使用)、および蛍光蛍光信号7を増幅するための手順によって行われます。技術は、特定の mRNA3,8,10を補足 18-25 ベース オリゴヌクレオチド プローブ ペアの結合に始まります。15 ~ 20 プローブ ペアはターゲット トラン スクリプトの各トラン スクリプトの特異性確保のために設計されています。MRNA 固有の交配には分岐の構成を形成する前置増幅器と増幅器のプローブが続きます。約、400 ラベル fluorophores が付いては、各増幅器、蛍光は、個々 の mRNAs (図 1)11の検出の 8000-fold 増加の結果にバインドします。
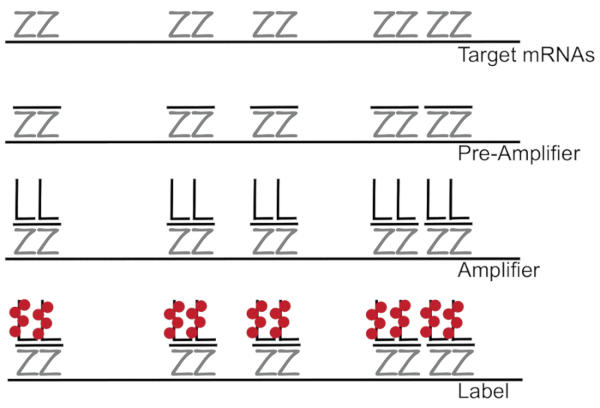
図 1: SM 魚のプロトコルの概略図。トラン スクリプト特定のプローブの連続交配が枝分かれしたは、DNA 増幅器、蛍光 mRNA を示すターゲットに。この図の拡大版を表示するのにはここをクリックしてください。
個々 のニューロン12及び子宮頚癌におけるひと乳頭腫ウイルス DNA にその場交配 (SM 魚) ローカライズされた β-アクチン Mrna の 1 分子蛍光を使った過去の研究は、ライン7 をセルします。ソフト スポットを見つけると追跡プログラム個々 の点状蛍光信号を識別し、正常に各セル3,13における Mrna の数を定量化するために使用されています。
ニューロン12の mRNA の検出の結果に基づき、我々 は SM 魚、マウス卵子および胚など低豊富な Mrna の転写レベルを量的に便利なツールを証明することを仮定しました。しかし、付着固定細胞用技術に最適化されて、ホルムアルデヒド固定パラフィン包が (FFPE) ティッシュ セクションを埋め込んだ。卵母細胞は、ポリ L リジン コーティングしている場合でも、スライドに従うことはできません。さらに、彼らは体細胞およびティッシュ セクションのセル換散市販キット3で独自のバッファーの一部を受けたときの結果より壊れやすい。これらの課題を克服するために卵母細胞は固定され手動でバッファーの滴間で転送されます。さらに、キットに透過し、洗浄バッファーは、セル換散を減らすために取り替えられました。あらかじめデザインされたプローブは魚キットと一緒にご購入または特定のコピーを要求することができます。独自のプローブ セットは、3 つの蛍光チャンネル (C1、C2、および C3) を可能にする多重化の一つで利用可能です。現在の実験では、マウス卵母細胞がデュアル染色と定量化された C2 Nanogプローブと C3 Pou5f1プローブを使います。これらのプローブは、卵子および胚のNanogおよびPou5f1の報告された式に基づいて選ばれました。交配の手順の最後に、卵母細胞は組織学的のスライド用耐フェード マウント メディアの滴に置かれました。共焦点画像は、個々 の mRNAs を表す点状蛍光信号の数を定量化するために使用されました。定量化、Mrna イメージングも、セルの特定の mRNA の分布を示した他の RNA 定量メソッドもない達成することができます。この手法は、実験群3の重要な違いを識別するために各実験群の卵母細胞の小さい数字の使用を許可する実験群内変動の少ないを持っている証明しました。
Protocol
Representative Results
Discussion
一連のプロトコル間のマイナーなステップは、成功した蛍光・ Mrna の正確な数を確保します。まず、プロトコルはコレクションおよび卵子の固定後すぐに行う必要があります。PVP が卵母細胞が互いに付着するを防ぐために 4% パラホルムアルデヒド固定バッファーに追加されることに注意してください。コレクションおよび卵子の固定後すぐに実験を行うことが必要だとわかった。任意の遅?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
博士ダニエル ・ r ・ ラーソンは、インストールとスポットを見つけると追跡プログラム13の使用と共焦点顕微鏡イメージングのためのネブラスカ大学リンカーン顕微鏡コアの技術的なサポートの彼の寛大な助けを感謝いたします。本研究は、UNL ハッチ資金 (NEB-26-206/受入番号-232435 とくちばし-26-231/受入番号-1013511) によって支えられ、ネブラスカ州農業研究部、リンカーン、ネブラスカの大学の貢献を表します。
Materials
| (±)-α-Lipoic acid | Sigma-Aldrich | T1395 | Alpha Lipoic Acid |
| Albumin, Bovine Serum, Low Fatty Acid | MP Biomedicals, LLC | 199899 | FAF BSA |
| BD 10mL TB Syringe | Becton, Dickinson and Company | 309659 | 10 mL syringe |
| BD PrecisionGlide Needle | Becton, Dickinson and Company | 305109 | 27 1/2 gauge needle |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | CaCl2-2H2O |
| Citric acid | Sigma-Aldrich | C2404 | Citrate |
| D-(+)-Glucose | Sigma-Aldrich | G6152 | Glucose |
| Disodium phosphate | Na2HPO4 | ||
| Easy Grip Petri Dish | Falcon Corning | 351008 | 35 mm dish |
| Edetate Disodium | Avantor | 8994-01 | EDTA |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | Straight, Sharp/Sharp, non-serrated, 13mm cutting edge scissors |
| Fetal Bovine Serum | Atlanta biologicals | S10250 | FBS |
| Gentamicin Reagent Solution | gibco | 15710-064 | Gentamicin |
| GlutaMAX-I (100X) | gibco | 35050-061 | Glutamax |
| Gold Seal Micro Slides | Gold Seal | 3039 | 25 x 75mm slides |
| Gonadotropin, From Pregnant Mares' Serum | Sigma | G4877 | eCG |
| hCG recombinant | NHPP | AFP8456A | hCG |
| Hyaluronidase, Type IV-S: From Bovine Testes | Sigma-Aldrich | H3884 | Hyaluronidase |
| Jewelers Style Forceps | Integra | 17-305X | Forceps 4-3/8", Style 5F, Straight, Micro Fine Jaw |
| L-(+)-Lactic Acid, free acid | MP Biomedicals, LLC | 190228 | L-Lactate |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M2773 | MgSO4-7H2O |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | NEAA |
| Microscope Cover Glass | Fisher Scientific | 12-542-C | 25 x 25x 0.15 mm cover slips |
| Mm-Nanog-O2-C2 RNAscope Probe | Advanced Cell Diagnostics | 501891-C2 | Nanog Probe |
| Mm-Pou5f1-O1-C3 RNAscope Probe | Advanced Cell Diagnostics | 501611-C3 | Pou5f1 Probe |
| MOPS | Sigma-Aldrich | M3183 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | Paraformaldehyde |
| PES 0.22 um Membrane -sterile | Millex-GP | SLGP033RS | 0.22 um filters |
| Polyvinylpyrrolidone | Sigma-Aldrich | P0930 | PVP |
| Potassium chloride | Sigma-Aldrich | 60128 | KCl |
| Potassium phosphate monobasic | Sigma-Aldrich | 60218 | KH2PO4 |
| Prolong Gold antifade reagent | invitrogen | P36934 | Antifade reagent without DAPI |
| RNAscope DAPI | Advanced Cell Diagnostics | 320858 | DAPI |
| RNAscope FL AMP 1 | Advanced Cell Diagnostics | 320852 | Amplifier 1 |
| RNAscope FL AMP 2 | Advanced Cell Diagnostics | 320853 | Amplifier 2 |
| RNAscope FL AMP 3 | Advanced Cell Diagnostics | 320854 | Amplifier 3 |
| RNAscope FL AMP 4 ALT A | Advanced Cell Diagnostics | 320855 | Amplifier 4 ALT A |
| RNAscope FL AMP 4 ALT B | Advanced Cell Diagnostics | 320856 | Amplifier 4 ALT B |
| RNAscope FL AMP 4 ALT C | Advanced Cell Diagnostics | 320857 | Amplifier 4 ALT C |
| RNAscope Fluorescent Multiplex Detection Reagents Kit | Advanced Cell Diagnostics | 320851 | FISH Reagent Kit |
| RNAscope Probe 3-plex Negative Control Probe | Advanced Cell Diagnostics | 320871 | Negative Control |
| RNAscope Probe 3-plex Positive Control | Advanced Cell Diagnostics | 320881 | Positive Control |
| RNAscope Probe Diluent | Advanced Cell Diagnostics | 300041 | Probe Diluent |
| RNAscope Protease III | Advanced Cell Diagnositics | 322337 | Protease III |
| RNAscope Protease III & IV Reagent Kit | Advanced Cell Diagnostics | 322340 | FISH Protease Kit |
| RNAscope Protease IV | Advanced Cell Diagnostics | 322336 | Protease IV |
| S/S Needle with Luer Hub 30G | Component Supply Co. | NE-301PL-50 | blunt 30 gauge needle |
| Sodium bicarbonate | Sigma-Aldrich | S6297 | NaHCO3 |
| Sodium chloride | Sigma-Aldrich | S6191 | NaCl |
| Sodium hydroxide | Sigma-Aldrich | 306576 | NaOH |
| Sodium pyruvate, >= 99% | Sigma-Aldrich | P5280 | Pyruvate |
| Solution 6 Well Dish | Agtechinc | D18 | 6 well dish |
| Taurine | Sigma-Aldrich | T8691 | Taurine |
| Tissue Culture Dish | Falcon Corning | 353002 | 60 mm dish |
| Triton X-100 | Sigma-Aldrich | X100 | Triton X-100 |
References
- Vogelstein, B., Kinzler, K. W. Digital PCR. Proceedings of the National Academy of Sciences. 96 (16), 9236-9241 (1999).
- MacK, E. M., Smith, J. E., Kurz, S. G., Wood, J. R. CAMP-dependent regulation of ovulatory response genes is amplified by IGF1 due to synergistic effects on Akt phosphorylation and NF-kB transcription factors. Reproduction. 144 (5), 595-602 (2012).
- Xie, F., Timme, K. A., Wood, J. R. Using Single Molecule mRNA Fluorescent in Situ Hybridization (RNA-FISH) to Quantify mRNAs in Individual Murine Oocytes and Embryos. Scientific Reports. 8 (1), 7930 (2018).
- Ruebel, M. L., et al. Obesity modulates inflammation and lipidmetabolism oocyte gene expression: A single-cell transcriptome perspective. Journal of Clinical Endocrinology and Metabolism. 102 (6), 2029-2038 (2017).
- Borensztein, M., Syx, L., Servant, N., Heard, E. . Mouse Oocyte Development. 1818, 51-65 (2018).
- Jansova, D., Tetkova, A., Koncicka, M., Kubelka, M., Susor, A. Localization of RNA and translation in the mammalian oocyte and embryo. PLoS ONE. 13 (3), 1-25 (2018).
- Player, A. N., Shen, L. P., Kenny, D., Antao, V. P., Kolberg, J. A. Single-copy gene detection using branched DNA (bDNA) in situ hybridization. Journal of Histochemistry and Cytochemistry. 49 (5), 603-611 (2001).
- Wang, F., et al. RNAscope: A novel in situ RNA analysis platform for formalin-fixed, paraffin-embedded tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Itzkovitz, S., van Oudenaarden, A. Validating transcripts with probes and imaging technology. Nature Methods. 8 (4), S12-S19 (2011).
- Derti, A., et al. ProbeDesigner: for the design of probesets for branched DNA (bDNA) signal amplification assays. Bioinformatics. 15 (5), 348-355 (1999).
- Larson, B., Malayter, D., Shure, M. Multiplexed Detection of Cytokine Cancer Biomarkers using Fluorescence RNA In Situ Hybridization and Cellular Imaging. BioTek Application Notes. , 1-5 (2016).
- Buxbaum, A. R., Wu, B., Singer, R. H. Single β-Actin mRNA Detection in Neurons Reveals a Mechanism for Regulating Its Translatability. Science. 343 (6169), 419-422 (2014).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Herrick, J. R., Paik, T., Strauss, K. J., Schoolcraft, W. B., Krisher, R. L. Building a better mouse embryo assay: effects of mouse strain and in vitro maturation on sensitivity to contaminants of the culture environment. Journal of Assisted Reproduction and Genetics. 33 (2), 237-245 (2016).
- Pohlmeier, W. E., Xie, F., Kurz, S. G., Lu, N., Wood, J. R. Progressive obesity alters the steroidogenic response to ovulatory stimulation and increases the abundance of mRNAs stored in the ovulated oocyte. Molecular Reproduction and Development. 81 (8), 735-747 (2014).
- Xie, F., Anderson, C. L., Timme, K. R., Kurz, S. G., Fernando, S. C., Wood, J. R. Obesity-dependent increases in oocyte mRNAs are associated with increases in proinflammatory signaling and gut microbial abundance of lachnospiraceae in female mice. Endocrinology. 157 (4), 1630-1643 (2016).
- Hirao, Y., Yanagimachi, R. Detrimental effect of visible light on meiosis of mammalian eggs in vitro. Journal of Experimental Zoology. , (1978).
- Takenaka, M., Horiuchi, T., Yanagimachi, R. Effects of light on development of mammalian zygotes. Proceedings of the National Academy of Sciences. 104 (36), 14293-14293 (2007).
- Komminoth, P., Werner, M. Target and signal amplification: Approaches to increase the sensitivity of in situ hybridization. Histochemistry and Cell Biology. 108 (4-5), 325-333 (1997).
- Hornick, J. E., Duncan, F. E., Shea, L. D., Woodruff, T. K. Multiple follicle culture supports primary follicle growth through paracrine-acting signals. Reproduction. 145 (1), 19-32 (2013).
- Vlasova-St. Louis, I., Bohjanen, P. Feedback Regulation of Kinase Signaling Pathways by AREs and GREs. Cells. 5 (1), 4 (2016).
- Gilbert, C., Svejstrup, J. Q. RNA Immunoprecipitation for Determining RNA-Protein Associations In Vivo. Current Protocols in Molecular Biology. 75 (1), 27.4.1-27.4.11 (2006).
- Kwon, S., Chin, K., Nederlof, M., Gray, J. W. Quantitative, in situ analysis of mRNAs and proteins with subcellular resolution. Scientific Reports. 7 (1), 16459 (2017).
- Voigt, F., et al. Single-Molecule Quantification of Translation-Dependent Association of mRNAs with the Endoplasmic Reticulum. Cell Reports. 21 (13), 3740-3753 (2017).
- Halstead, J. M., Wilbertz, J. H., Wippich, F., Lionnet, T., Ephrussi, A., Chao, J. A. TRICK: A Single-Molecule Method for Imaging the First Round of Translation in Living Cells and Animals. Methods in Enzymology. 572, (2016).
- Cookson, W., Liang, L., Abecasis, G., Moffatt, M., Lathrop, M. Mapping complex disease traits with global gene expression. Nature Reviews Genetics. 10 (3), 184-194 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: the next challenge. Nature Reviews Genetics. 11, 855 (2010).
- Freimer, N., Sabatti, C. The Human Phenome Project. Nature Genetics. 34, 15 (2003).

