Образование карбоната кальция в присутствии биополимерных добавок
Summary
Мы описываем протокол для осадков и характеристики кристаллов карбоната кальция, которые образуются в присутствии биополимеров.
Abstract
Биоминерализация – это образование минералов в присутствии органических молекул, часто связанных с функциональными и/или структурными ролями в живых организмах. Это сложный процесс и, следовательно, простой, in vitro, система необходима, чтобы понять влияние изолированных молекул на процесс биоминерализации. Во многих случаях биоминерализация направлена биополимерами во внеклеточной матрице. Для того, чтобы оценить влияние изолированных биополимеров на морфологию и структуру кальцита in vitro, мы использовали метод диффузии пара для выпадения карбоната кальция, сканирования электронной микроскопии и микро-Раман для характеристики, и ультрафиолетовое (УФ/Вис) абсорбция для измерения количества биополимера в кристаллах. В этом методе мы подвергаем изолированные биополимеры, растворенные в растворе хлорида кальция, газоемкому аммиаку и углекислому газу, которые происходят из разложения твердого карбоната аммония. В условиях, когда растворительный продукт карбоната кальция достигается, образуются карбонат кальция и кристаллы. Карбонат кальция имеет различные полиморфы, которые отличаются по своей термодинамической стабильности: аморфный карбонат кальция, ватерит, арагонит и кальцит. При отсутствии биополимеров, в чистых условиях, карбонат кальция в основном присутствует в форме кальцита, который является наиболее термодинамически стабильной полиморфной карбоната кальция. Этот метод исследует влияние биополимерных добавок на морфологию и структуру кристаллов карбоната кальция. Здесь мы демонстрируем протокол путем изучения внеклеточного бактериального белка TapA, на образование кристаллов карбоната кальция. В частности, мы сосредоточиваемся на экспериментальных методах и методах характеристик, таких как оптическая и электронная микроскопия, а также раманской спектроскопии.
Introduction
Биоминерализация – это образование минералов в присутствии органических молекул, часто связанных с функциональными и/или структурными ролями в живых организмах. Биоминерализация может быть внутриклеточной, как при образовании магнетита внутри магнитотаксических бактерий1,или внеклеточной, так как при образовании карбоната кальция в морском еже шипы2, гидроксиапатит, который связан с коллагеном в кости3 и эмали, что связано с амелологином в зубах4. Биоминерализация – это сложный процесс, который зависит от многих параметров живого организма. Поэтому для упрощения исследуемой системы необходимо оценить влияние отдельных компонентов на процесс. Во многих случаях биоминерализация индуцируется наличием внеклеточных биополимеров. Цель метода, представленного здесь, заключается в следующем: (1) Формирование кристаллов карбоната кальция в присутствии изолированных биополимеров in vitro, используя метод диффузии паров. (2) Изучить влияние биополимеров на морфологию и структуру карбоната кальция.
Три основных метода осаждения карбоната кальция in vitro вприсутствии органических добавок используются 5,6. Первый метод, который мы будем называть методом раствора, основан на смешивании растворимых соли кальция (например, CaCl2) с растворимым солью карбоната (например, карбонат натрия). Процесс смешивания может быть выполнен несколькими способами: внутри реактора стремя клетками, которые разделены пористыми мембранами 7. Здесь каждая из наружных клеток содержит растворимую соль, а центральная клетка содержит раствор с добавкой для тестирования. Кальций и карбонат диффундуют от внешней к средней клетке, в результате чего выпадает менее растворимый карбонат кальция, когда концентрации кальция и карбоната превышают их растворительный продукт, Ksp и «Ca2» 2-я-К. Дополнительным методом смешивания является двухструйная процедура8. В этом методе каждая растворимые соли вводят из отдельного шприца в перемешиваемый раствор, содержащий добавку, где осаждается карбонат кальция. Здесь, инъекции и, следовательно, скорость смешивания хорошо контролируется, в отличие от предыдущего метода, где смешивание контролируется диффузии.
Второй метод, используемый для кристаллизации CaCO3 является метод Китано9. Этот метод основан на карбонатном/ водородном карбонатном равновесии (2HCO 3– (aq) – Ca 2(aq) 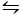 CaCO3 (ы) Здесь CO2 пузырится в раствор, содержащий CaCO3 в твердой форме, сдвигая равновесие влево и, следовательно, растворяя карбонат кальция. Нерастворенный карбонат кальция фильтруется, а желаемые добавки добавляются в раствор, богатый бикарбонатом. CO2 затем разрешается испаряться, тем самым смещая реакцию вправо, образуя карбонат кальция в присутствии добавок.
CaCO3 (ы) Здесь CO2 пузырится в раствор, содержащий CaCO3 в твердой форме, сдвигая равновесие влево и, следовательно, растворяя карбонат кальция. Нерастворенный карбонат кальция фильтруется, а желаемые добавки добавляются в раствор, богатый бикарбонатом. CO2 затем разрешается испаряться, тем самым смещая реакцию вправо, образуя карбонат кальция в присутствии добавок.
Третий метод кристаллизации карбоната кальция, который мы опишите здесь, является метод диффузии пара10. В этой установке органическая добавка, растворенный в растворе хлорида кальция, помещается в закрытую камеру вблизи карбоната аммония в виде порошка. Когда карбонат аммония разлагается на углекислый газ и аммиак, они рассеивается в раствор, содержащий ионы кальция (например, CaCl2),и карбонат кальция осаждается (см. рисунок 1 для иллюстрации). Кристаллы карбоната кальция могут расти медленными осадками или быстрыми осадками. Для медленного выпадения осадков раствор, содержащий добавку в растворе CaCl 2, помещается в раствор рядом с карбонатным порошком аммония. При быстром осадке, подробно описанном в протоколе, как аддитивный раствор, так и карбонат аммония помещаются ближе друг к другу в многослойную пластину. Метод медленного выпадения осадков приведет к уменьшению количества нуклеационных центров и более крупных кристаллов, а быстрые осадки приведут к большему количеству нуклеационных центров и меньших кристаллов.
Описанные выше методы отличаются по своей технической сложности, уровню контроля и скорости процесса выпадения осадков. Метод смешивания требует специальной настройки6 как для двойной струи, так и для трехклеточной системы. В методе смешивания, наличие других растворимых встречных ионов (например, Naq, Cl–)6 неизбежно, в то время как в методе Китано, кальций и (би) карбонат являются единственными ионами в растворе и не связаны с наличием дополнительных встречные ионы (например, Naq,Cl–). Кроме того, метод смешивания требует относительно больших объемов и поэтому не подходит для работы с дорогими биополимерами. Преимущество двойной струи в том, что можно контролировать скорость инъекций раствора и что это быстрый процесс по сравнению с другими методами.
Преимущество метода Китано и метода диффузии пара заключается в том, что образование карбоната кальция контролируется путем диффузии CO2 в/из раствора CaCl2, что позволяет зондировать более медленные процессы ядер и осадков 11 Год , 12. Кроме того, образование карбоната кальция путем распространения CO2 может напоминать процессы кальцификации в vivo13,14,15. В этом методе образуются четко определенные и разделенные кристаллы16. Наконец, влияние одиночных или множественных биополимеров на образование карбоната кальция может быть проверено. Это позволяет систематически изучать влияние ряда концентраций добавок на образование карбоната кальция, а также изучение смесей биополимеров – все это осуществляется контролируемым образом. Этот метод подходит для использования с большим диапазоном концентраций и объемов добавок. Минимальный объем используется примерно 50 Зл, и поэтому этот метод является выгодным, когда есть ограниченное количество доступных биополимеров. Максимальный объем зависит от доступности более крупной скважины, или изобезливки, в которую должна быть вставлена пластина или стакан, содержащий CaCl 2. Метод, описанный ниже, был оптимизирован для работы в 96-хорошо пластины с биополимером выбрали для белка TapA17.
Protocol
Representative Results
Discussion
Описанный здесь метод направлен на формирование кристаллов карбоната кальция в присутствии органических добавок и оценку влияния органических биополимеров на морфологию и структуру кристаллов карбоната кальция in vitro. Метод основан на сравнении кристаллов, образуювшихся в присутств?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить профессора Лию Аддади, профессора Джонатана Эреза и д-ра Яэля Полити за плодотворные дискуссии. Это исследование было поддержано Израильским научным фондом (ISF), грантом 1150/14.
Materials
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
References
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).

