Cuantificación de tres lesiones de ADN por espectrometría de masas y evaluación de sus niveles en los tejidos de los ratones expuestos a la materia particulada fina ambiental
Summary
Describimos aquí métodos para la cuantificación sensible y precisa de las lesiones 8-oxo-7,8-dihydro-2′-deoxyguanosine (8-oxodGuo), 1,n6-etheno-2′-deoxyadenosine (1,n6-dado) y 1,n2– etheno-2′-desoxyguanosine (1,N2-DGUO) en el ADN. Los métodos se aplicaron a la evaluación de los efectos de las partículas finas ambientales (PM2,5) en los tejidos (pulmón, hígado y riñón) de ratones expuestos A/J.
Abstract
Los aductos de ADN y las bases de ADN oxidado son ejemplos de lesiones de ADN que son biomarcadores útiles para la evaluación de la toxicidad de sustancias que son electrofilicas, generan electrófilos reactivos a la biotransformación o inducen estrés oxidativo. Entre las nucleobasas oxidadas, la más estudiada es la 8-oxo-7,8-dihidroguanina (8-oxoGua) o 8-oxo-7,8-dihydro-2′-desoxyguanosine (8-oxodGuo), un biomarcador de daño base inducido oxidativamente en el ADN. Los aldehídos y los epoxialdehídos resultantes del proceso de peroxidación lipídica son moléculas electrofílicas capaces de formar aductos de ADN exocíclico mutagénico, tales como los aductos de etheno 1,n2-etheno-2′-deoxyguanosine (1,n2– εdGuo) y 1,n6-etheno-2′-deoxyadenosine (1,n6-εdado), que se han sugerido como biomarcadores potenciales en la fisiopatología de la inflamación. Los métodos selectivos y sensibles para su cuantificación en el ADN son necesarios para el desarrollo de estrategias preventivas que ralentizan las tasas de mutación celular y el desarrollo crónico de la enfermedad (p. ej., cáncer, enfermedades neurodegenerativas). Entre los métodos sensibles disponibles para su detección (cromatografía líquida de alto rendimiento acoplada a detectores de espectrometría de masas en tándem o electroquímico, ensayo de cometas, inmunoensayos, 32P-etiquetado posterior), los más selectivos son los basados en cromatografía líquida de alto rendimiento acoplada a espectrometría de masas tándem (HPLC-ESI-MS/MS). La selectividad es una ventaja esencial al analizar muestras biológicas complejas y HPLC-ESI-MS/MS evolucionada como el estándar de oro para la cuantificación de nucleósidos modificados en matrices biológicas, como el ADN, la orina, el plasma y la saliva. El uso de estándares internos etiquetados isotópicamente añade la ventaja de las correcciones para las pérdidas de moléculas durante la hidrólisis del ADN y los pasos de enriquecimiento del analito, así como para las diferencias de la ionización del analito entre las muestras. También ayuda en la identificación del pico cromatográfico correcto cuando hay más de un pico presente.
Presentamos aquí métodos validados, precisos y precisos de HPLC-ESI-MS/MS que se aplicaron con éxito para la cuantificación de 8-oxodGuo, 1,N6-DAdo y 1,n2-dguo en pulmón, hígado y ADN renal de ratones A/J para la evaluación de los efectos de la exposición ambiental PM2,5 .
Introduction
Algunas especies reactivas de oxígeno (ROS) son capaces de oxidar enlaces dobles de carbono de bases de ADN y algunos carbonos en la fracción desoxirribosa, generando bases oxidadas y roturas de hebras de ADN1. Como una molécula cargada negativamente rica en átomos de nitrógeno y oxígeno, el ADN es también un objetivo para los grupos electrófilos que reaccionan covalentemente con los sitios nucleófilos (nitrógeno y oxígeno), dando productos que se denominan aductos de ADN2. Por lo tanto, los aductos de ADN y las bases de ADN oxidado son ejemplos de lesiones de ADN que son biomarcadores útiles para la evaluación de la toxicidad de sustancias que son electrofilicas, generan electrófilos reactivos sobre la biotransformación, o inducen el estrés oxidativo1, 2. Aunque las bases de ADN modificadas se pueden eliminar del ADN por la reparación de la escisión de base o nucleótido (BER o NER), la inducción de un desequilibrio entre la generación y la eliminación de las lesiones de ADN en favor de la primera conduce a un aumento neto de sus niveles en el ADN horas extras3 . Los resultados son el aumento de las tasas de mutación del ADN, la reducción de la expresión génica y la disminución de la actividad proteica2,4,5,6,7, efectos estrechamente relacionados con el desarrollo de enfermedades. Las mutaciones de ADN pueden afectar diversas funciones celulares, como la señalización celular, el ciclo celular, la integridad del genoma, la estabilidad del telómero, el epigenoma, la estructura de la cromatina, el empalme de ARN, la homeostasis proteica, el metabolismo, la apoptosis y la diferenciación celular8 ,9. Las estrategias para ralentizar las tasas de mutación celular y el desarrollo de enfermedades crónicas (p. ej., cáncer, enfermedades neurodegenerativas) pasan por el conocimiento de las fuentes de mutación, entre ellas, las lesiones de ADN y sus causas.
Los ROS generados endógenamente en exceso, debido a la exposición a los contaminantes, la inflamación persistente, la fisiopatología de la enfermedad (p. ej., diabetes), etc., son causas importantes del daño de la biomolécula, incluyendo el ADN y el daño lipídico1. Por ejemplo, el radical hidroxilo altamente reactivo (OH) formado a partir de la reducción de H2O2 por iones metálicos de transición (fe2 +, cu+) oxida las bases de ADN, la fracción de azúcar de ADN y los ácidos grasos poliinsaturados en la difusión controlada tarifas10. Entre las 80 nucleobasas oxidadas ya caracterizadas3, el más estudiado es 8-oxo-7, 8-dihydroguanine (8-oxoGua) o 8-oxo-7,8-dihydro-2′-desoxyguanosine (8-oxodGuo, figura 1), una lesión que es capaz de inducir transversiones gt en células de mamíferos10,11. Se forma por la oxidación electrónica mono de guanina, o por el ataque de oxígeno de la guanina a radical hidroxilo o singlete en el ADN1. Los ácidos grasos poliinsaturados son otros objetivos importantes de los oxidantes altamente reactivos, tales como •Oh, que inician el proceso de peroxidación lipídica1,12. Da lugar a hidroperóxidos de ácidos grasos que pueden descomponerse a aldehídos electrófilos y epoxialdehídos, tales como malondialdehído, 4-hidroxi-2-Nonenal, 2,4-Decadienal, 4, 5-epoxi-(2E)-decenal, hexenal, Acrolein, Crotonaldehído, que son puede formar aductos de ADN exocíclico mutagénico, tales como malondialdehído-, propano-, o los aductos de etheno1,12,13. Los aductos de etheno 1,n2-etheno-2′-deoxyguanosine (1,n2-εdguo , figura 1) y 1,n6-etheno-2′-deoxyadenosine (1,n6-εdado, figura 1 ) se han sugerido como biomarcadores potenciales en la fisiopatología de la inflamación14,15.
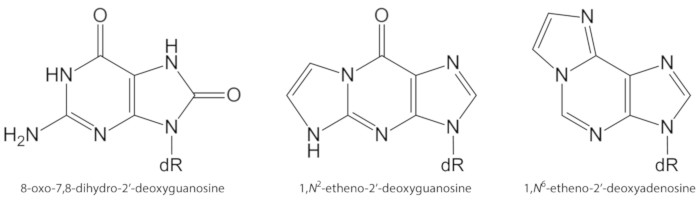
Figura 1. Estructuras químicas de las lesiones de ADN cuantificadas en el presente estudio. dR = 2 ́-desoxiribosa. Esta cifra ha sido modificada de Oliveira et al.34. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Los estudios realizados a comienzos de la década de 1980 permitieron la detección sensible de 8-oxodGuo por cromatografía líquida de alto rendimiento acoplada a la detección electroquímica (HPLC-ECD). La cuantificación de 8-oxodguo por HPLC-ECD en varios sistemas biológicos sometidos a condiciones oxidantes condujo al reconocimiento de 8-oxodguo como un biomarcador de daño base inducido oxidativamente en el ADN1,16. Aunque son robustos y permiten la cuantificación de 8-oxodGuo en la gama baja de fmol17, las mediciones de HPLC-ECD se basan en la precisión del tiempo de retención del analito para la identificación del analito y en la resolución de la cromatografía para evitar interferencias de otros componentes de la muestra. Como la detección electroquímica requiere el uso de sal (por ejemplo, fosfato de potasio, acetato de sodio) en la fase móvil, el mantenimiento de condiciones analíticas adecuadas necesita tiempo de limpieza de columna y equipo de rutina.
Alternativamente, el uso de la enzima de reparación de ADN bacteriológico formamidopirimidina ADN glicosilasa (FPG) y, después, 8-oxoguanina glucosilasa 1 (hOGG1), para la detección y eliminación de 8-oxogua de ADN, surgió como una manera de la inducción de ADN alcalino lábil Sitios. Los sitios del lábil alcalino se convierten en roturas de la hebra de ADN y permiten la cuantificación indirecta muy alta sensible de 8-oxogua por electroforesis de gel de una sola célula alcalina (“ensayo de cometa”). La alta sensibilidad y la realización de los análisis sin necesidad de extracción de ADN celular son las principales ventajas de este tipo de ensayo. Da los niveles de estado estacionario más bajos de 8-oxoGua en el ADN, típicamente 7-10 veces más bajo que los niveles obtenidos por métodos bioanalíticos basados en HPLC. Sin embargo, es una medida indirecta de 8-oxogua y algunos inconvenientes son la falta de especificidad o la eficiencia desconocida de las enzimas de reparación utilizadas1,16,18.
Los inmunoensayos son otro conjunto de métodos utilizados para la detección de aductos de ADN 8-oxoGua1 y exocíclico, tales como 1,n6-dado y 1,n2-dguo12. A pesar de la sensibilidad, una deficiencia del uso de anticuerpos para la detección de lesiones de ADN es la falta de especificidad debido a la reactividad cruzada a otros componentes de muestras biológicas, incluyendo las bases de ADN normales1,12. Los aductos de ADN exocíclico, incluyendo 1,n6-DAdo y 1,n2-dguo, también pueden ser detectados y cuantificados por los ensayos altamente sensibles de 32P-postetiquetado12. La alta sensibilidad de 32P-el etiquetado posterior permite el uso de cantidades muy pequeñas de ADN (por ejemplo, 10 μg) para la detección de aproximadamente 1 aducto por 1010 bases normales19. Sin embargo, el uso de radioquímicos, la falta de especificidad química y la baja precisión son algunas desventajas19,20.
Una limitación compartida de los métodos citados anteriormente es la baja selectividad o especificidad para la detección de las moléculas deseadas. En este escenario, la HPLC acoplada a la espectrometría de masas tándem de ionización electrospray (HPLC-ESI-MS/MS y HPLC-MS3) evolucionó como el estándar de oro para la cuantificación de nucleósidos modificados en matrices biológicas, como el ADN, la orina, el plasma y la saliva 1 , 19 , 20. las ventajas de los métodos HPLC-ESI-MS/MS son la sensibilidad (típicamente en la gama baja de fmol) y la alta especificidad proporcionada por i) la separación cromatográfica, II) el patrón característico y conocido de fragmentación molecular dentro de la masa cámara de colisión espectrómetro, y III) la medición precisa de la relación masa a carga seleccionada (m/z) en el modo de monitorización de reacción múltiple1,19. El uso de estándares internos etiquetados isotópicamente añade la ventaja de las correcciones para las pérdidas de moléculas durante la hidrólisis del ADN y los pasos de enriquecimiento del analito, así como para las diferencias de la ionización del analito entre las muestras. También ayuda en la identificación del pico cromatográfico correcto cuando hay más de un pico presente1,12,19,20.
Se han utilizado varios métodos basados en HPLC-ESI-MS/MS para la cuantificación de 8-oxodguo, 1, N6-dado y 1,n2-dguo en el ADN extraído de diferentes muestras biológicas12,15,20 ,21,22,23,24,25,26,27,28,29 . Las partículas finas (PM2,5) transportan productos químicos orgánicos e inorgánicos, tales como hidrocarburos aromáticos policíclicos (PAHs), Nitro-PAHS, aldehídos, cetonas, ácidos Carboxilicos, quinolinas, metales y iones solubles en agua, que pueden inducir inflamación y estrés oxidativo, condiciones que favorecen la ocurrencia de daño biomolecular y enfermedad30,31,32,33. Aquí presentamos métodos validados de HPLC-ESI-MS/MS que se aplicaron con éxito para la cuantificación de 8-oxodGuo, 1,N6-DAdo y 1,N2-dguo en pulmón, hígado y ADN renal de ratones A/J para la evaluación de la efectos de la exposición ambiental PM2,5 34.
Protocol
Representative Results
Discussion
Un problema importante que se encuentra en los análisis de 8-oxodguo por métodos de HPLC es la posible inducción de su formación durante los procedimientos de trabajo de extracción de ADN, hidrólisis de ADN, y la concentración de ADN hidrolizados22,38. Con el fin de minimizar el problema de la formación artística de 8-oxodGuo, se recomienda la adición de deferoxamina a todas las soluciones de extracción de ADN, almacenamiento e hidrólisis, el uso del …
Divulgations
The authors have nothing to disclose.
Acknowledgements
FAPESP (Fundação de Amparo à pesquisa do Estado de São Paulo, proc. 2012/22190-3 y 2012/08616-8), CNPq (proc. 454214/2014-6 y 429184/2016-6), CAPES, PRPUSP (Pró-Reitoria de pesquisa da Universidade de São Paulo), INCT INAIRA (MCT/CNPq/FNDCT/CAPES/ FAPEMIG/FAPERJ/FAPESP; Proc. 573813/2008-6), INCT Redoxoma (FAPESP/CNPq/CAPES; Proc. 573530/2008-4), Redoxoma NAP (PRPUSP; Proc. 2011.1.9352.1.8) y CEPID Redoxoma (FAPESP; Proc. 2013/07937-8). T. f. Oliveira y A. A. F. Oliveira recibieron becas de FAPESP (proc. 2012/21636-8, 2011/09891-0, 2012/08617-4) y CAPES (Coordenação de Aperfeiçoamento de Pessoal de nível superior). M. h. g. Medeiros, P. di Mascio, p. h. n. Saldiva, y A. p. m. Loureiro recibieron becas de CNPq.
Algunas figuras y tablas presentes en esta obra fueron publicadas originalmente en Oliveira A.A.F. et al. efectos genotóxicos y epigenotóxicos en ratones expuestos a partículas finas ambientales concentradas (PM2,5) de la ciudad de São Paulo, Brasil. De partículas y de fibra toxicológica. 15, 40 (2018).
Materials
| [15N5]-2’-deoxyadenosine | Cambridge Isotope Laboratories | NLM-3895-25 | |
| [15N5]-2’-deoxyguanosine | Cambridge Isotope Laboratories | NLM-3899-CA-10 | |
| acetonitrile | Carlo Erba Reagents | 412413000 | |
| alkaline phosphatase from bovine intestinal mucosa | Sigma | P5521 | |
| ammonium acetate | Merck | 101116 | |
| calf thymus DNA | Sigma | D1501 | |
| cell lysis solution | QIAGEN | 158908 | |
| chloroform | Carlo Erba Reagents | 412653 | |
| deferoxamine | Sigma | D9533 | |
| deoxyribonuclease I (DNase I) | Bio Basic Inc | DD0649 | |
| ethanol | Carlo Erba Reagents | 414542 | |
| formic acid | Sigma-Aldrich | F0507 | |
| HPLC-ESI-MS/MS system | HPLC: Agilent 1200 series ESI-MS/MS: Applied Biosystems/MDS Sciex Instruments | HPLC: binary pump (G1312B), isocratic pump (G1310A), column oven with a column switching valve (G1316B), diode array detector (G1315C), auto sampler (G1367C). ESI-MS/MS: Linear Quadrupole Ion Trap mass spectrometer, Model 4000 QTRAP. | |
| HPLC/DAD system | Shimadzu | Two pumps (LC-20AT), photo diode array detector (DAD-20AV), auto-injector (Proeminence SIL-20AC), column oven (CTO-10AS/VP) | |
| HPLC column (50 x 2.0 mm i.d., 2.5 µm, C18) | Phenomenex | 00B-4446-B0 | |
| HPLC column (150 x 2.0 mm i.d., 3.0 µm, C18) | Phenomenex | 00F-4251-B0 | |
| HPLC column (250 x 4.6 mm i.d., 5.0 µm, C18) | Phenomenex | 00G-4252-E0 | |
| HPLC C18 security guard cartridge (4.0 x 3.0 mm i.d.) | Phenomenex | AJO-4287 | |
| isoamyl alcohol | Sigma-Aldrich | M32658 | |
| isopropyl alcohol (isopropanol) | Carlo Erba Reagents | A412790010 | |
| ketamine | Ceva | Commercial name: Dopalen | |
| magnesium chloride | Carlo Erba Reagents | 349377 | |
| magnesium chloride | Sigma | M2393 | |
| methanol | Carlo Erba Reagents | L022909K7 | |
| phosphodiesterase I from Crotalus atrox | Sigma | P4506 | |
| protein precipitation solution | QIAGEN | 158912 | |
| proteinase K | Sigma-Aldrich | P2308 | |
| ribonuclease A | Sigma | R5000 | |
| sodium chloride | Sigma-Aldrich | S9625 | |
| SPE-C18 (Strata-X) | Phenomenex | 8B-S100-TAK | |
| tris(hydroxymethyl)-aminomethane | Carlo Erba Reagents | 489983 | |
| xylazine | Syntec do Brasil | Commercial name: Xilazin |
References
- Cadet, J., Davies, K. J. A., Medeiros, M. H. G., Di Mascio, P., Wagner, J. R. Formation and repair of oxidatively generated damage in cellular DNA. Free Radical Biology and Medicine. 107, 13-34 (2017).
- Barnes, J. L., Zubair, M., John, K., Poirier, M. C., Martin, F. L. Carcinogens and DNA damage. Biochemical Society Transactions. 46, 1213-1224 (2018).
- Cadet, J., Davies, K. J. A. Oxidative DNA damage & repair: An introduction. Free Radical Biology and Medicine. 107, 2-12 (2017).
- Cao, H., Jiang, Y., Wang, Y. Stereospecific synthesis and characterization of oligodeoxyribonucleotides containing an N2-(1-carboxyethyl)-2′-deoxyguanosine. Journal of the American Chemical Society. 129, 12123-12130 (2007).
- Breyer, V., et al. Analysis and biological relevance of advanced glycation end-products of DNA in eukaryotic cells. The FEBS Journal. 275, 914-925 (2008).
- Tamae, D., Lim, P., Wuenschell, G. E., Termini, J. Mutagenesis and repair induced by the DNA advanced glycation end product N2-1-(carboxyethyl)-2′-deoxyguanosine in human cells. Biochimie. 50, 2321-2329 (2011).
- Hecht, S. S. Lung carcinogenesis by tobacco smoke. International Journal of Cancer. 131, 2724-2732 (2012).
- Garraway, L. A., Lander, E. S. Lessons from the cancer genome. Cell. 153, 17-37 (2013).
- Ong, T. P., Loureiro, A. P. M. Nutritional interventions in age-related genetic and epigenetic instability and cancer. Anti-ageing nutrients: Evidence-based prevention of age-associated diseases. , (2015).
- Evans, M. D., Dizdaroglu, M., Cooke, M. S. Oxidative DNA damage and disease: induction, repair and significance. Mutation Research. 567, 1-61 (2004).
- Moriya, M. Single-stranded shuttle phagemid for mutagenesis studies in mammalian cells: 8-oxoguanine in DNA induces targeted GC → TA transversions in simian kidney cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 1122-1126 (1993).
- Medeiros, M. H. G. Exocyclic DNA adducts as biomarkers of lipid oxidation and predictors of disease. Challenges in developing sensitive and specific methods for clinical studies. Chemical Research in Toxicology. 22, 419-425 (2009).
- Guéraud, F. 4-Hydroxynonenal metabolites and adducts in pre-carcinogenic conditions and cancer. Free Radical Biology and Medicine. 111, 196-208 (2017).
- Nair, U., Bartsch, H., Nair, J. Lipid peroxidation-induced DNA damage in cancer-prone inflammatory diseases: A review of published adduct types and levels in humans. Free Radical Biology and Medicine. 43, 1109-1120 (2007).
- Pang, B., et al. Lipid peroxidation dominates the chemistry of DNA adduct formation in a mouse model of inflammation. Carcinogenesis. 28, 1807-1813 (2007).
- Møller, P., et al. Harmonising measurements of 8-oxo-7,8-dihydro-2′-deoxyguanosine in cellular DNA and urine. Free Radical Research. 46, 541-553 (2012).
- Hofer, T., Moller, L. Optimization of the workup procedure for the analysis of 8-oxo-7,8-dihydro-2′-deoxyguanosine with electrochemicaldetection. Chemical Research in Toxicology. 15, 426-432 (2002).
- Collins, A., El Yamani, N., Dusinska, M. Sensitive detection of DNA oxidation damage induced by nanomaterials. Free Radical Biology and Medicine. , 69-76 (2017).
- Zubel, T., Buerkle, A., Mangerich, A. Mass spectrometric analysis of sulfur mustard-induced biomolecular adducts: Are DNA adducts suitable biomarkers of exposure?. Toxicology Letters. 293, 21-30 (2018).
- Tretyakova, N., Goggin, M., Sangaraju, D., Janis, G. Quantitation of DNA adducts by stable isotope dilution mass spectrometry. Chemical Research in Toxicology. 25, 2007-2035 (2012).
- Churchwell, M. I., Beland, F. A., Doerge, D. R. Quantification of multiple DNA adducts formed through oxidative stress using liquid chromatography and electrospray tandem mass spectrometry. Chemical Research in Toxicology. 15, 1295-1301 (2002).
- Chao, M. R., Yen, C. C., Hu, C. W. Prevention of artifactual oxidation in determination of cellular 8-oxo-7,8-dihydro-2′-deoxyguanosine by isotope-dilution LC-MS/MS with automated solid-phase extraction. Free Radical Biology and Medicine. 44, 464-473 (2008).
- Danielsen, P. H., et al. Oxidative stress, inflammation, and DNA damage in rats after intratracheal instillation or oral exposure to ambient air and wood smoke particulate matter. Toxicological Sciences. 118, 574-585 (2010).
- Danielsen, P. H., et al. Oxidative stress, DNA damage, and inflammation induced by ambient air and wood smoke particulate matter in human A549 and THP-1 cell lines. Chemical Research in Toxicology. 24, 168-184 (2011).
- Garcia, C. C. M., et al. [13C2]-Acetaldehyde promotes unequivocal formation of 1,N2-propano-2′-deoxyguanosine in human cells. Journal of the American Chemical Society. 133, 9140-9143 (2011).
- Angeli, J. P. F., et al. Lipid hydroperoxide-induced and hemoglobin-enhanced oxidative damage to colon cancer cells. Free Radical Biology and Medicine. 51, 503-515 (2011).
- Yu, Y., et al. Comprehensive assessment of oxidatively induced modifications of DNA in a rat model of human Wilson’s disease. Molecular and Cellular Proteomics. 15, 810-817 (2016).
- Torres-Cuevas, I., Aupi, M., Asensi, M. A., Vento, M., Ortega, &. #. 1. 9. 3. ;., Escobar, J. 7,8-Hydroxy-2′-deoxyguanosine/2′-deoxiguanosine ratio determined in hydrolysates of brain DNA by ultrachromatrography coupled to tandem mass spectrometry. Talanta. 170, 97-102 (2017).
- Wu, D., et al. Detection of 8-hydroxydeoxyguanosine (8-OHdG) as a biomarker of oxidative damage in peripheral leukocyte DNA by UHPLC-MS/MS. Journal of Chromatography B. 1064, 1-6 (2017).
- IARC. . Monographs on the Evaluation of Carcinogenic Risks to Humans: Outdoor Air Pollution. 109, (2016).
- De Martinis, B. S., Kado, N. Y., Carvalho, L. R. F., Okamoto, R. A., Gundel, L. A. Genotoxicity of fractionated organic material in airborne particles from São. Mutation Research. 446, 83-94 (1999).
- Karlsson, H. L., Nygren, J., Möller, L. Genotoxicity of airborne particulate matter: The role of cell-particle interaction and of substances with adduct-forming and oxidizing capacity. Mutation Research. 565, 1-10 (2004).
- Bell, M. L., Dominici, F., Ebisu, K., Zeger, S. L., Samet, J. M. Spatial and temporal variation in PM2.5 chemical composition in the United States for health effects studies. Environmental Health Perspectives. 115, 989-995 (2007).
- Oliveira, A. A. F., et al. Genotoxic and epigenotoxic effects in mice exposed to concentrated ambient fine particulate matter (PM2.5) from São Paulo city, Brazil. Particle and Fibre Toxicology. 15, 40 (2018).
- Loureiro, A. P. M., Zhang, W., Kassie, F., Zhang, S., Villalta, P. W., Wang, M., Hecht, S. S. Mass spectrometric analysis of a cyclic 7,8-butanoguanine adduct of N-nitrosopyrrolidine: comparison to other N-nitrosopyrrolidine adducts in rat hepatic DNA. Chemical Research in Toxicology. 22, 1728-1735 (2009).
- Loureiro, A. P. M., Marques, S. A., Garcia, C. C. M., Di Mascio, P., Medeiros, M. H. G. Development of an on-line liquid chromatography-electrospray tandem mass spectrometry assay to quantitatively determine 1,N2-etheno-2′-deoxyguanosine in DNA. Chemical Research in Toxicology. 15, 1302-1308 (2002).
- Mangal, D., et al. Analysis of 7,8-dihydro-8-oxo-2′-deoxyguanosine in cellular DNA during oxidative stress. Chemical Research in Toxicology. 22, 788-797 (2009).
- ESCODD (European Standards Committee on Oxidative DNA Damage). Comparative analysis of baseline 8-oxo-7,8-dihydroguanine in mammalian cell DNA, by different methods in different laboratories: an approach to consensus. Carcinogenesis. 23, 2129-2133 (2002).
- Helbock, H. J., et al. DNA oxidation matters: The HPLC-electrochemical detection assay of 8-oxo-deoxyguanosine and 8-oxo-guanine. Proceedings of the National Academy of Sciences of the United States of America. 95, 288-293 (1998).
- Risom, L., et al. Oxidative DNA damage and defence gene expression in the mouse lung after short-term exposure to diesel exhaust particles by inhalation. Carcinogenesis. 24, 1847-1852 (2003).
- Risom, L., et al. Repeated inhalations of diesel exhaust particles and oxidatively damaged DNA in young oxoguanine DNA glycosylase (OGG1) deficient mice. Free Radical Research. 41, 172-181 (2007).
- Tsurudome, Y., et al. Changes in levels of 8-hydroxyguanine in DNA, its repair and OGG1 mRNA in rat lungs after intratracheal administration of diesel exhaust particles. Carcinogenesis. 20, 1573-1576 (1999).
- Marie-Desvergne, C., Maître, A., Bouchard, M., Ravanat, J. L., Viau, C. Evaluation of DNA adducts, DNA and RNA oxidative lesions, and 3-hydroxybenzo(a)pyrene as biomarkers of DNA damage in lung following intravenous injection of the parent compound in rats. Chemical Research in Toxicology. 23, 1207-1214 (2010).
- Iwai, K., et al. Early oxidative DNA damages and late development of lung cancer in diesel exhaust-exposed rats. Environmental Research. 84, 255-264 (2000).
- Ichinose, T., et al. Lung carcinogenesis and formation of 8-hydroxy-deoxyguanosine in mice by diesel exhaust particles. Carcinogenesis. 18, 185-192 (1997).
- Schmerold, I., Niedermu, H. Levels of 8-hydroxy-2′-deoxyguanosine in cellular DNA from 12 tissues of young and old Sprague Dawley rats. Experimental Gerontology. 36, 1375-1386 (2001).
- Garcia, C. C. M., Freitas, F. P., Di Mascio, P., Medeiros, M. H. G. Ultrasensitive simultaneous quantification of 1,N2-etheno-2′-deoxyguanosine and 1,N2-propano-2′-deoxyguanosine in DNA by an online liquid chromatography-electrospray tandem mass spectrometry assay. Chemical Research in Toxicology. 23, 1245-1255 (2010).
- Godshalk, R., et al. Comparison of multiple DNA adduct types in tumor adjacent human lung tissue: effect of cigarette smoking. Carcinogenesis. 23, 2081-2086 (2002).
- Dechakhamphu, S., et al. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma alpha-tocopherol and praziquantel. Cancer Epidemiology Biomarkers and Prevention. 19, 310-318 (2010).
- Arab, K., et al. Typical signature of DNA damage in white blood cells: a pilot study on etheno adducts in Danish mother-newborn child pairs. Carcinogenesis. 30, 282-285 (2009).
- Nair, J., et al. High dietary omega-6 polyunsaturated fatty acids drastically increase the formation of etheno-DNA base adducts in white blood cells of female subjects. Cancer Epidemiology Biomarkers and Prevention. 6, 597-601 (1997).

