Mesure des mécanismes neuronaux sous-jacents à la consolidation de la mémoire dépendante du sommeil pendant les naps dans la petite enfance
Summary
Ce protocole décrit les méthodes employées pour examiner les mécanismes neuronaux sous-jacents à la consolidation de mémoire sommeil-dépendante pendant des siestes dans la petite enfance. Il comprend des procédures pour examiner l’effet du sommeil sur les performances de la mémoire comportementale, ainsi que l’application et l’enregistrement de la polysomnographie et l’actigraphie.
Abstract
Le sommeil est essentiel au fonctionnement quotidien. Une fonction importante du sommeil est la consolidation des souvenirs, un processus qui les rend plus forts et moins vulnérables aux interférences. Les mécanismes neuronaux sous-jacents à l’avantage du sommeil pour la mémoire peuvent être étudiés à l’aide de la polysomnographie (PSG). PSG est une combinaison d’enregistrements physiologiques, y compris les signaux du cerveau (EEG), les yeux (EOG), et les muscles (EMG) qui sont utilisés pour classer les stades de sommeil. Dans ce protocole, nous décrivons comment le PSG peut être employé en conjonction avec des évaluations comportementales de mémoire, l’actigraphie, et le parent-rapport pour examiner la consolidation de mémoire sommeil-dépendante. L’accent de ce protocole est sur la petite enfance, une période d’importance que les enfants transition du sommeil biphasique (composé d’une sieste et le sommeil de nuit) au sommeil monophasique (sommeil de nuit seulement). Les effets du sommeil sur les performances de la mémoire sont mesurés à l’aide d’une évaluation de la mémoire visuospatiale à travers les périodes de sommeil et de repos éveillé. Une combinaison d’actigraphie et de rapport parent est utilisée pour évaluer les rythmes du sommeil (c.-à-d. caractériser les enfants comme des nappers habituels ou non habituels). Enfin, le PSG est utilisé pour caractériser les stades de sommeil et les qualités de ces stades (tels que les fréquences et la présence de fuseaux) pendant les siestes. L’avantage de l’utilisation de PSG est qu’il est le seul outil actuellement disponible pour évaluer la qualité du sommeil et l’architecture du sommeil, pointant vers l’état du cerveau pertinent qui soutient la consolidation de la mémoire. Les principales limites du PSG sont le temps qu’il faut pour préparer le montage d’enregistrement et que les enregistrements sont généralement repris sur un sommeil acheté. Ces limitations peuvent être surmontées en engageant les jeunes participants dans des tâches distrayantes pendant l’application et en combinant psg avec actigraphie et les mesures d’auto/rapport de parent pour caractériser des cycles de sommeil. Ensemble, cette combinaison unique de méthodes permet d’enquêter sur la façon dont les siestes soutiennent l’apprentissage chez les enfants d’âge préscolaire.
Introduction
Compte tenu de la prévalence du sommeil dans notre routine quotidienne, il est important de comprendre sa fonction. Les études avec cet objectif exigent une mesure précise du sommeil. La polysomnographie (PSG) est la mesure de l’étalon-or du sommeil. PSG permet une mesure objective et quantitative du sommeil à haute résolution temporelle et peut être utile à la fois pour la recherche et à des fins cliniques. Le PSG est une combinaison d’enregistrements physiologiques. Au minimum, un montage PSG comprend les mesures suivantes : électroencéphalographie (EEG), électrooculographie (EOG) et électromyographie (EMG). Ces mesures évaluent les potentiels électriques du cerveau, des yeux et des muscles respectivement, et permettent la classification des stades de sommeil (voir la figure 1). D’autres mesures, telles que l’électrocardiographie (ECG), la respiration et l’oxymétrie des impulsions peuvent être incluses pour identifier la présence de troubles du sommeil.
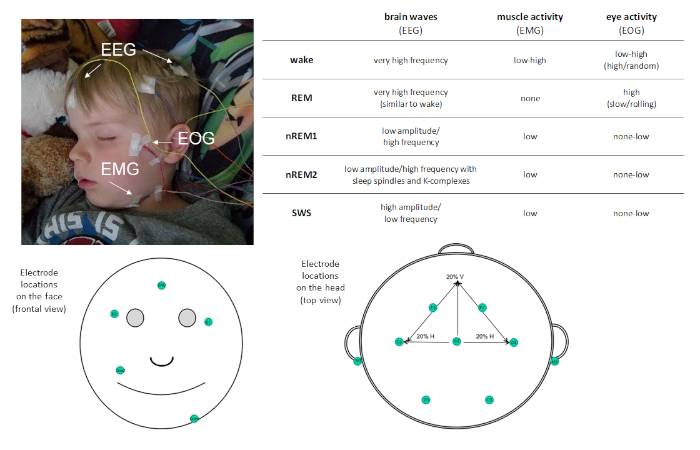
Figure 1 : Exemple de placement d’électrodes et de description de l’activité enregistrée via le PSG. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Le PSG permet de caractériser le sommeil en quatre stades distincts du sommeil : le mouvement oculaire non rapide (non-REM) étape 1 (nREM1; 4-7 Hz), non-REM étape 2 (nREM2; 12-15 Hz), et non-REM étape 3 (plus communément connu sous le nom de sommeil à ondes lentes [SWS]; 0,5 à 4 Hz), et le mouvement rapide des yeux (REM) ) dormir. nREM1 marque l’début du sommeil, et est identifié sur la base de la tonalité musculaire réduite dans le recodage EMG et les oscillations mixtes d’amplitude EEG par rapport à l’alpha observé dans le sillage de repos. Suivent le nREM2, qui se distingue par la présence de fuseaux de sommeil (courtes rafales d’activité de fréquence sigma; 11-16 Hz) et de k-complexes (ondes lentes uniques qui se démarquent de l’activité environnante) dans l’EEG. SWS se caractérise par des oscillations distinctes d’EEG à haute amplitude à haute fréquence lente. Le sommeil paradoxal se caractérise par une activité cérébrale oscillatoire à faible amplitude rapide très semblable à celle observée pendant le sillage. Cependant, ce qui distingue le sommeil paradoxal du réveil, c’est qu’il est également caractérisé par des mouvements oculaires rapides phasiques (d’où le surnom REM) et l’atonie musculaire. Au cours d’un accès de sommeil, les stades du sommeil sont vécus cycliquement, à un rythme d’environ 90 min/cycle.
Le sommeil suit également le rythme circadien, avec des accès de sommeil se déroulant en cycles de 24 h. Le moment du sommeil et la cohérence peuvent influencer la fonction du sommeil et sont également importants à évaluer. Bien que le PSG soit nécessaire pour caractériser les stades de sommeil, il est long à appliquer et n’est donc pas idéal pour évaluer plusieurs épisodes de sommeil (par exemple, plusieurs nuits de sommeil, siestes et nuit de sommeil). Pour cela, l’actigraphie est bénéfique. Actigraphy utilise un accéléromètre tri-axial, généralement sur le poignet, pour estimer le sommeil en fonction de l’absence de mouvement. Bien que l’actigraphie ne puisse pas être utilisée pour caractériser les stades du sommeil, il a été démontré qu’elle est fiable pour détecter l’début du sommeil et le réveil (y compris la fragmentation du sommeil ou le réveil après le début du sommeil) dans une gamme de populations allant des nourrissons1 aux personnes âgées2. . Le PSG et l’actigraphie sont des méthodes préférées aux mesures d’auto-déclaration des parents. Les mesures d’autodéclaration et de déclaration des parents sont faciles à administrer et relativement peu coûteuses, mais elles sont également sujettes à des biais et à la non-conformité. Enfin, il convient de noter que ces méthodes peuvent être utilisées en combinaison pour capitaliser sur les forces de chacune. Par exemple, le PSG peut être combiné à l’actigraphie et/ou à l’auto-déclaration pour obtenir à la fois la qualité du sommeil pendant la nuit ainsi que la vérification des quantités de sommeil ou des cycles veille-sommeil, en particulier sur de longues durées (p. ex., semaines ou mois).
Une fonction du sommeil qui a suscité un intérêt particulier est la consolidation de la mémoire dépendante du sommeil, le traitement des souvenirs qui les laisse plus forts et moins vulnérables aux interférences3. Bien que la consolidation de mémoire puisse avoir lieu pendant le sillage chez les enfants4 et adultes5,il y a des preuves substantielles que la consolidation est augmentée pendant le sommeil. Des recherches antérieures ont fourni des exemples comportementaux de consolidation de la mémoire dépendante du sommeil en comparant les changements dans les performances de la mémoire à la suite d’un intervalle de sommeil (p. ex., de 20 h à 8 h) aux changements qui ont suivi un intervalle équivalent passé éveillé (p. ex., 8 h à 20 h). Chez les adultes, les souvenirs sont protégés6 ou mêmeamélioré7 après un intervalle de sommeil tandis que les souvenirs se désintègrent généralement sur un intervalle équivalent de sillage. Des contrôles ont été utilisés qui dissocient les changements de performance des influences circadiennes8,9,10. Par exemple, des bienfaits similaires du sommeil sont observés en comparant les performances au cours d’une sieste à la mi-journée à une période de veille équivalente à la mi-journée9.
Bien que le sommeil ait été autrefois pensé pour refléter un processus passif, protégeant simplement des mémoires contre la pourriture ou l’interférence, les théories modernes suggèrent que le sommeil joue un rôle plus actif et favorise réellement la mémoire par des réactivations11,12 ,13. Le soutien pour cela vient des corrélations observées entre les mesures comportementales de la consolidation de la mémoire sur le sommeil (changement de rappel de mémoire après le sommeil par rapport à avant le sommeil) et des aspects spécifiques de la physiologie du sommeil. Pour de nombreuses tâches de mémoire déclarative, la consolidation de la mémoire est associée à des aspects du sommeil non REM, en particulier des mesures de SWS ou fuseaux de sommeil trouvés dans nREM2 et SWS. Si le rôle du sommeil était la protection passive contre les interférences, on ne s’attendrait pas à une telle corrélation; plutôt une corrélation entre le temps endormi (indépendamment de l’étape de sommeil) et la performance serait prévu, comme plus de temps endormi fournirait plus de protection contre l’interférence14.
Un soutien supplémentaire pour le rôle actif de SWS dans la consolidation de la mémoire est évident dans les études de réactivation de la mémoire ciblée. Dans ces études, une mémoire est apprise dans le contexte d’un repère perceptuel, par exemple une odeur, et le rappel de la mémoire est plus grande après le sommeil si le signal est re-présenté pendant le sommeil, SWS en particulier15. Bien que le mécanisme sous-jacent est débattu16,17, une théorie proéminente, la théorie de consolidation des systèmes, soutient que les souvenirs codés dans l’hippocampe sont stabilisés dans le cortex si le dialogue hippocampal-néocortical. Plus précisément, les ondes lentes corticales et les fuseaux de sommeil, se produisant en conjonction avec les ondulations hippocampales associées à la réactivation de la mémoire, soutiennent le transfert de mémoire3.
Le rôle du sommeil dans la consolidation de la mémoire pendant le développement est moins clair. La petite enfance est une période d’intérêt particulier que les enfants commencent à passer d’une biphasique (composé d’une sieste à la mi-journée et un accès de sommeil de nuit) à un modèle de sommeil monophasique. Des recherches récentes suggèrent que cette transition peut refléter la maturation du cerveau18. Cet argument est compatible avec les données empiriques montrant des changements de développement dans le sommeil de nuit (c.-à-d., la topographie de l’activité lente d’onde) reflète celui de la maturation corticale19.
Bien qu’il existe plusieurs démonstrations comportementales de la consolidation sommeil-dépendante de nuit chez les enfants20,21 et les enfants en bas âge22, la recherche sur les fondements neuronaux de la consolidation de mémoire avec le sommeil de mi-journée sont commence à faire l’objet d’une enquête. Dans le travail novateur examinant le rôle des siestes à la mi-journée sur la mémoire chez les enfants d’âge préscolaire, les siestes ont été montrées pour protéger les souvenirs de l’information récemment apprise, tandis que la mémoire a été réduite (de 12%) lorsque les enfants sont restés éveillés pendant l’intervalle de sieste23. Cette « prestation de sieste » était plus importante chez les enfants qui dormaient habituellement (c.-à-d. 5 fois ou plus par semaine, selon l’actigraphie) quel que soit leur âge. En enregistrant le PSG pendant la sieste, le changement de performance de la mémoire tout au long de la période de sieste s’est avéré être spécifiquement associé à la densité de fuseau de sommeil (le nombre de fuseaux de sommeil par minute de nREM), suggérant la qualité de sieste (pas la quantité) a été un facteur critique dans promouvoir la rétention de la mémoire (voir la section des résultats représentatifs).
Cette étude souligne l’importance du PSG dans l’exploration des relations entre le sommeil et la mémoire pendant le développement. Il souligne l’importance de caractériser le sommeil macro- (étapes de sommeil) et micro- (qualités de ces étapes telles que les fréquences et la présence de fuseaux) structures pendant les siestes pour la consolidation de la mémoire. Il souligne également l’importance d’évaluer les rythmes du sommeil (caractérisant les enfants comme des nappers habituels ou non habituels). Bien que notre travail ait caractérisé la fonction des siestes dans l’apprentissage visuospatial (et plus récemment l’apprentissage émotionnel24 et procédural25), beaucoup de questions demeurent. Par exemple, il sera important d’examiner d’autres tâches de mémoire déclarative afin d’évaluer la généralisation de ces résultats et d’évaluer les tâches utilisées dans les salles de classe préscolaires pour comprendre des paramètres spécifiques (p. ex., la quantité d’avantages de sieste par rapport à l’apprentissage) pour tâches écologiquement valides. Des travaux supplémentaires seront également nécessaires pour comprendre quand le sillage est suffisant pour la consolidation de la mémoire. Ainsi, notre objectif est de démystifier le processus de mesure du sommeil et de la consolidation de la mémoire dépendante du sommeil chez les enfants. Nous fournissons des conseils pratiques pour examiner le bénéfice d’une sieste de l’après-midi sur la mémoire déclarative chez les enfants d’âge préscolaire en développement en général (environ 3 à 4 ans) en utilisant une tâche de mémoire visuospatiale informatisée ainsi que des méthodes pour évaluer l’accoutumance de sieste l’actigraphie, le rapport parent et la physiologie de la sieste à l’aide du PSG. Bien que ces méthodes aient été développées pour les enfants d’âge préscolaire qui font la sieste avec une fréquence variable, ces méthodes pourraient être adaptées à n’importe quel groupe d’âge.
Protocol
Representative Results
Discussion
Cet article décrit comment étudier la consolidation sommeil-dépendante de la mémoire déclarative pendant des siestes dans la petite enfance. Les méthodes incluent l’évaluation comportementale de la mémoire à travers les conditions de sieste et d’éveil, l’actigraphie et le parent-rapport pour évaluer des cycles de sommeil, et le PSG pour évaluer l’architecture de sommeil. Cette combinaison unique est essentielle pour évaluer la mémoire, caractériser les cycles de sommeil, et examiner les mécanismes neurona…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Les auteurs aimeraient remercier le Laboratoire de développement neurocognitif de l’Université du Maryland, College Park et le Laboratoire Somneuro de l’Université du Massachusetts à Amherst pour leur aide dans ce projet. Le financement a été fourni par les NIH (HD094758) et NSF (BCS 1749280) à TR et RS. Les résultats des représentants ont été financés par les NIH HL111695.
Materials
| Actiwatch Spectrum Plus Starter Kit | Philips Respironics | 1109516 | Includes: Actiwatch Spectrum Plus Device, Actiware Software License, and manual |
| Actiware software | Philips Respironics | 1114828 | Alternatives may be available. |
| Brain Analyzer | Brain Products | BV-BP-170-1000 | Alternatives may be available. |
| Dell Latitude 5580 Laptop | Dell | X5580T [210-AKJR] | Laptop for running MatLab, Actiware, and RemLogic as well as storing/uploading data |
| EC2 cream | Grass | 12643 | Possible alternatives include Ten20 paste and Lic2 electride cream |
| Embla REMLogic software | Natus Medical Inc. | 21475 | Alternatives may be available. |
| Embletta MPR PG Sys – XR – US | Natus Medical Inc. | 12077 | Embletta system for PSG recordings |
| Embletta MPR ST + Proxy Kit | Natus Medical Inc. | 12696 | Attachment to Embletta to record PSG sensors |
| Nuprep cleaning solution | Natus Medical Inc. | 12643 | Possible alternatives may be available. |
| Sleep Supplies Starter Kit for Embletta MPR ST/ST + Proxy | Natus Medical Inc. | 12643 | Started kit for sleeping including guaze, EC2 cream, NuPrep cleaning solution, cotton swabs and more. |
References
- Sadeh, A., Acebo, C., Seifer, R., Aytur, S., Carskadon, M. A. Activity-based assessment of sleep-wake patterns during the 1st year of life. Infant Behavioral Development. 18 (3), 329-337 (1998).
- Sadeh, A., Urbach, D., Lavie, P. Actigraphically-based automatic bedtime sleep-wake scoring: Validity and clinical applications. Journal Ambulatory Monitoring. 2 (3), 209-216 (1989).
- Rasch, B., Born, J. About sleep’s role in memory. Physiological Reviews. 93, 681-766 (2013).
- Werchan, D. M., Gómez, R. L. Wakefulness (not sleep) promotes generalization of word learning in 2.5-year-old children. Child Development. 85 (2), 429-436 (2014).
- Wang, J. Y., Weber, F. D., Zinke, K., Inostroza, M., Born, J. More effective consolidation of episodic long-term memory in children than adults-unrelated to sleep. Child Development. 89 (5), 1720-1734 (2018).
- Sonni, A., Spencer, R. M. C. Sleep protects memories from interference in older adults. Neurobiology of Aging. 36 (7), 2272-2281 (2015).
- Marshall, L., Helgadóttir, H., Mölle, M., Born, J. Boosting slow oscillations during sleep potentiates memory. Nature. 444 (7119), 610-613 (2006).
- Baran, B., Wilson, J., Spencer, R. M. C. REM-dependent repair of competitive memory suppression. Experimental Brain Research. 203 (2), 471-477 (2010).
- Diekelmann, S., Born, J. The memory function of sleep. Nature Reviews Neuroscience. 11 (2), 114-126 (2010).
- Stickgold, R. Sleep dependent memory consolidation. Nature. 437 (27), 1272-1278 (2005).
- Dudai, Y., Karni, A., Born, J. The consolidation and transformation of memory. Neuron. 88 (1), 20-32 (2010).
- Feld, G. B., Born, J. Sculpting memory during sleep: concurrent consolidation and forgetting. Current Opinion in Neurobiology. 44, 20-27 (2017).
- Staresina, B. P., et al. Hierarchical nesting of slow oscillations, spindles and ripples in the human hippocampus during sleep. Nature Neuroscience. 18 (11), 1679-1686 (2015).
- Ellenbogen, J. M., Payne, J. D., Stickgold, R. The role of sleep in declarative memory consolidation: passive, permissive, active or none?. Current Opinion Neurobiology. 16 (6), 716-722 (2006).
- Oudiette, D., Paller, K. A. Upgrading the sleeping brain with targeted memory reactivation. Trends in Cognitive Sciences. 17 (3), 142-149 (2013).
- Yonelinas, A. P., Ranganath, C., Ekstrom, A. D., Wiltgen, B. J. A contextual binding theory of episodic memory: systems consolidation reconsidered. Nature Reviews Neuroscience. 20, 364-375 (2019).
- Antony, J. W., Schapiro, A. C. Active and effective replay: systems consolidation reconsidered again. Nature Reviews Neuroscience. , (2019).
- Lam, J., Mahone, E. M., Mason, T., Scharf, S. M. The effects of napping on cognitive function in preschoolers. Journal of Developmental & Behavioral Pediatrics. 32 (2), 90-97 (2011).
- Kurth, S., Ringli, M., Geiger, A., Lebourgeois, M., Jenni, O. G., Huber, R. High-density sleep electroencephalogram study. Journal of Neuroscience. 30 (40), 13211-13219 (2010).
- Backhaus, J., Hoeckesfeld, R., Born, J., Hohagen, F., Junghanns, K. Immediate as well as delayed post learning sleep but not wakefulness enhances declarative memory consolidation in children. Neurobiology of Learning and Memory. 89 (1), 76-80 (2008).
- Wilhelm, I., Diekelmann, S., Born, J. Sleep in children improves memory performance on declarative but not procedural tasks TT – Bei Kindern verbessert Schlaf die Gedächtnisleistung für deklarative aber nicht für prozedurale Aufgaben. Learning and Memory. 15 (5), 373-377 (2008).
- Seehagen, S., Konrad, C., Herbert, J. S., Schneider, S. Timely sleep facilitates declarative memory consolidation in infants. Proceedings of the National Academy of Sciences. 112 (5), 1625-1629 (2015).
- Kurdziel, L., Duclos, K., Spencer, R. M. C. Sleep spindles in midday naps enhance learning in preschool children. Proceedings of the National Academy of the Sciences of the United States of America. 110 (43), 17267-17272 (2013).
- Kurdziel, L. B. F., Kent, J., Spencer, R. M. C. Sleep-dependent enhancement of emotional memory in early childhood. Scientific Reports. 8 (12609), 1-10 (2018).
- Desrochers, P. C., Kurdziel, L. B. F., Spencer, R. M. C. Delayed benefit of naps on motor learning in preschool children. Experimental Brain Research. 234 (3), 763-772 (2016).
- Maldonado, C. C., Bentley, A. J., Mitchell, D. A pictorial sleepiness scale based on cartoon faces. Sleep. 27 (3), 541-548 (2004).
- Stern, R. A., Arruda, J. E., Hooper, C. R., Wolfner, G. D., Morey, C. E. Visual analogue mood scales to measure internal mood state in neurologically impaired patients: Description and initial validity evidence. Aphasiology. 11 (1), 59-71 (1997).
- Plihal, W., Born, J. Effects of early and late nocturnal sleep on indicators of procedural and declarative memory. Journal of Cognitive Neuroscience. 9 (4), 534-547 (1997).
- Donohue, K. C., Spencer, R. M. C. Continuous re-exposure to environmental sound cues during sleep does not improve memory for semantically unrelated word pairs. Journal of Cognitive Education and Psychology. 10 (2), 167-177 (2015).
- Wilson, J. K., Baran, B., Pace-Schott, E. F., Ivry, R. B., Spencer, R. M. C. Sleep modulates word-pair learning but not motor sequence learning in healthy older adults. Neurobiology of Aging. 33 (5), 991-1000 (2012).
- Wamsley, E. J., et al. Reduced sleep spindles and spindle coherence in schizophrenia: Mechanisms of impaired memory consolidation?. Biological Psychiatry. 71 (2), 154-161 (2012).
- Mölle, M., Bergmann, T. O., Marshall, L., Born, J. Fast and slow spindles during the sleep slow oscillation: Disparate coalescence and engagement in memory processing. Sleep. 34 (10), 1411-1421 (2011).
- Acebo, C., et al. Sleep/wake patterns derived from activity monitoring and maternal report for healthy 1- to 5-year-old children. Sleep. 28 (12), 1568-1577 (2005).
- Acebo, C., et al. Estimating sleep patterns with activity monitoring in children and adolescents: How many nights are necessary for reliable measures?. Sleep. 22 (1), 95-103 (1999).
- Geiger, A., et al. The sleep EEG as a marker of intellectual ability in school age children. Sleep. 34 (2), 181-189 (2011).
- Wagner, U., Gais, S., Born, J. Emotional memory formation is enhanced across sleep intervals with high amounts of rapid eye movement sleep. Learning and Memory. 8, 112-119 (2001).
- Gómez, R. L., Bootzin, R. R., Nadel, L. Naps promote abstraction in language-learning infants. Psychological Science. 17 (8), 670-674 (2006).
- Konrad, C., Herbert, J. S., Schneider, S., Seehagen, S. Gist extraction and sleep in 12-month-old infants. Neurobiology of Learning and Memory. 134, 216-220 (2016).

