Utilisation d’embryons de poisson zèbre Tg(Vtg1:mcherry) pour tester les effets œstrogéniques des composés perturbateurs endocriniens
Summary
Voici un protocole détaillé pour l’utilisation des embryons de poisson zèbre Tg(vtg1: mCherry) pour la détection des effets œstrogéniques. Le protocole couvre la propagation du poisson et le traitement des embryons, et met l’accent sur la détection, la documentation et l’évaluation des signaux fluorescents induits par les composés perturbateurs endocriniens (EDC).
Abstract
Il existe de nombreux composés perturbateurs endocriniens (EDC) dans l’environnement, en particulier les substances œstrogéniques. La détection de ces substances est difficile en raison de leur diversité chimique; par conséquent, de plus en plus de méthodes de détection d’effets sont utilisées, telles que les organismes biomonitor/bioindicateurs sensibles aux effets œstrogéniques. Ces organismes de biosurveillance comprennent plusieurs modèles de poissons. Ce protocole couvre l’utilisation de la lignée transgénique Tg(vtg1: mCherry) du poisson zèbre comme organisme de biosurveillance, y compris la propagation des poissons et le traitement des embryons, en mettant l’accent sur la détection, la documentation et l’évaluation des signaux fluorescents induits par EDC. Le but du travail est la démonstration de l’utilisation des embryons transgéniques Tg(vtg1: mCherry) pour détecter les effets œstrogéniques. Ce travail documente l’utilisation d’embryons transgéniques de poissons zèbres Tg(vtg1: mCherry) pour la détection des effets œstrogéniques en testant deux substances œstrogéniques, α- et β-zearalenol. Le protocole décrit n’est qu’une base pour la conception des essais; la méthode d’essai peut être modifiée selon les critères d’essai et les échantillons. En outre, il peut être combiné avec d’autres méthodes d’essai, facilitant ainsi l’utilisation future de la ligne transgénique.
Introduction
Il y a un nombre important de composés perturbateurs endocriniens (EDC) qui sont parmi les substances les plus dangereuses dans notre environnement. Ce sont principalement des composés œstrogéniques qui contaminent l’eau des ressources naturelles. La diversité chimique des substances appartenant au groupe rend les tests de leur présence difficiles, car différentes méthodes d’analyse sont nécessaires pour leur détection. Sur la base de leur structure chimique, il est très difficile de déterminer si une substance est réellement capable d’agir comme un œstrogène. En outre, ces substances ne sont jamais présentes sous une forme pure dans l’environnement, de sorte que leurs effets peuvent être affectés par d’autres composés, trop1. Ce problème peut être résolu par des méthodes de détection d’effet, telles que l’utilisation d’organismes biomonitor/bioindicateurs qui présentent des effets œstrogéniques2,3,4,5.
Récemment, une variété de cellules ligne6 et de systèmes d’essai à base de levure2,3 ont été développés pour détecter les effets œstrogéniques. Cependant, ceux-ci ne sont généralement en mesure de détecter la liaison de la substance au récepteur d’oestrogène2,3. En outre, ils sont incapables de modéliser des processus physiologiques complexes dans l’organisme, ou de détecter les phases sensibles aux hormones des stades de la vie; ainsi, ils conduisent souvent à de faux résultats.
On sait que certains gènes réagissent sensiblement à l’œstrogène dans les organismesvivants 7. La détection des produits génétiques par des méthodes de biologie moléculaire est également possible au niveau de protéine ou d’ARNm8,9, mais implique généralement le sacrifice d’animaux. Les lois sur la protection des animaux sont devenues plus strictes, et il y a une demande croissante de systèmes d’essai alternatifs qui minimisent le nombre et la souffrance des animaux utilisés dans les expériences ou le remplacement du modèle animal par un autre système modèle10. Avec la découverte de protéines fluorescentes et la création de lignées de biomarqueurs, les technologies transgéniques offrent une bonne alternative11. Avec ces lignes, l’activation d’un gène sensible à l’œstrogène peut être testée in vivo.
Chez les vertébrés, le potentiel des poissons dans l’évaluation des risques environnementaux est exceptionnel. Ils offrent de nombreux avantages par rapport aux modèles de mammifères : étant des organismes aquatiques, ils sont capables d’absorber les polluants dans tout leur corps, produisent un grand nombre de descendants, et certaines de leurs espèces sont caractérisées par un temps de production de courte durée. Leur système endocrinien et leurs processus physiologiques présentent de grandes similitudes avec d’autres vertébrés et même avec les mammifères, y compris les humains12.
Plusieurs gènes pour la détection des effets œstrogéniques chez les poissons sont également connus. Les plus importants sont les récepteurs d’oestrogène aromatase-b, choriogenine-H, et vitellogénine (vtg)7,13. Récemment, plusieurs lignées de biocapteurs produisant des œstrogènes ont également été créées à partir de modèles de poissons utilisés en laboratoire, comme celui du poisson zèbre (Danio rerio)4,5,14,15,16,17. Le principal avantage du poisson zèbre dans la création de lignes de biocapteur est le corps transparent des embryons et des larves, parce que le signal de journaliste fluorescent peut alors être facilement étudié in vivo sans sacrifier l’animal10. En plus de la protection des animaux, il est également une caractéristique précieuse car il permet d’étudier la réaction d’un même individu à différents moments du traitement18.
Ces expériences utilisent un journaliste de vitellogenine transgénique zèbre ligne15. La construction transgène utilisée pour le développement de Tg(vtg1:mCherry) a un long (3,4 kbp) naturel vitellogenin-1 promoteur. Le récepteur d’oestrogène (ER) est une protéine d’exhausteur activée par des ligands qui est un représentant de la superfamille stéroïde/récepteur nucléaire. ER se lie à des séquences d’ADN spécifiques appelées éléments de réponse d’oestrogène (EER) avec une forte affinité et transactive l’expression des gènes en réponse à l’estradiol et d’autres substances œstrogéniques, de sorte que plus ERE dans le promoteur provoque une réponse plus forte19. Il y a 17 sites ERE dans la région de promoteur de la construction transgène Tg(vtg1:mCherry) et on s’attend à ce qu’ils imitent l’expression du gène vtg indigène15. Il y a une expression continue du signal fluorescent chez les femelles sexuellement matures. Cependant, chez les mâles et les embryons, l’expression dans le foie n’est visible que lors du traitement avec des substances œstrogéniques (figure 1).
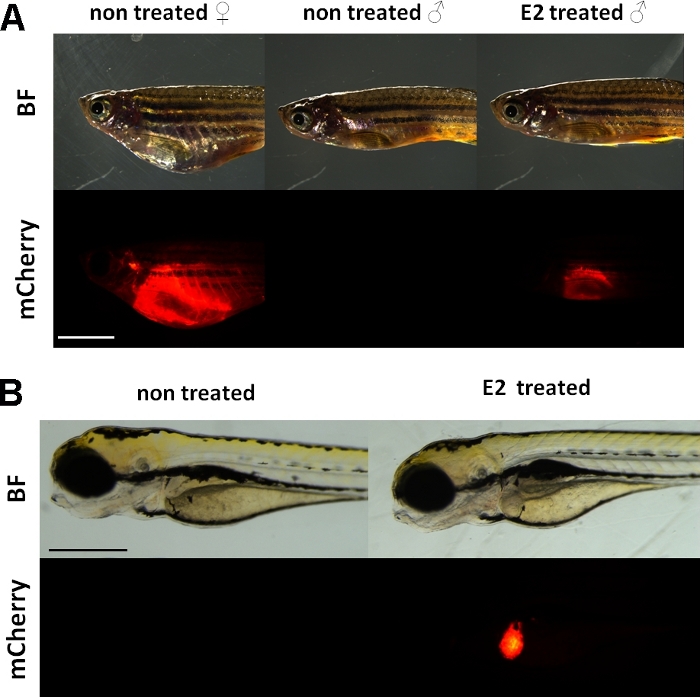
Figure 1 : Signal fluorescent rouge dans le foie du poisson zèbre adulte transgénique vtg1:mCherry et de 5 embryons de dpf, après induction de 17-ß-estradiol (E2). Chez les femelles et chez les hommes traités par E2 (25 μg/L temps d’exposition : 48hrs), une forte fluorescence du foie est visible même à travers la peau pigmentée. Aucun signal fluorescent n’est visible chez les mâles non traités (A). Après induction e2 (50 μg/L temps d’exposition : 0-120 hpf), un signal fluorescent rouge dans le foie de 5 embryons de dpf peut également être observé, ce qui n’est pas visible dans les embryons témoins (B). Bien que le signal fluorescent soit continuellement présent chez les femelles adultes, principalement les mâles et les embryons de la lignée sont appropriés pour détecter les effets œstrogéniques. (BF: champ lumineux, mCherry: vue de filtre fluorescent rouge, images simples, barre d’échelle A: 5mm, barre d’échelle B: 250 μm) Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Semblable à la vitellogénine endogène, le journaliste mCherry n’est exprimé que dans le foie. Parce que la vitellogénine n’est produite qu’en présence d’œstrogènes, il n’y a pas de signal fluorescent dans les commandes. Parce que l’expression est seulement dans le foie, l’évaluation des résultats est beaucoup plus facile15.
La sensibilité et la facilité d’utilisation des embryons de cette lignée ont été étudiées sur divers mélanges de composés œstrogéniques ainsi que sur des échantillons environnementaux15,20, et dans la plupart des cas, des relations dose-réponse ont été documentées ( figure2). Toutefois, dans le cas de substances hautement toxiques, principalement hépatotoxiques (p. ex., zéaralenone), seul un signal fluorescent très faible peut être visible dans le foie des embryons traités et l’intensité maximale causée par le signal fluorescent peut être atteinte dans une très petite plage de concentration, ce qui rend difficile l’établissement de relations dose-effet20.
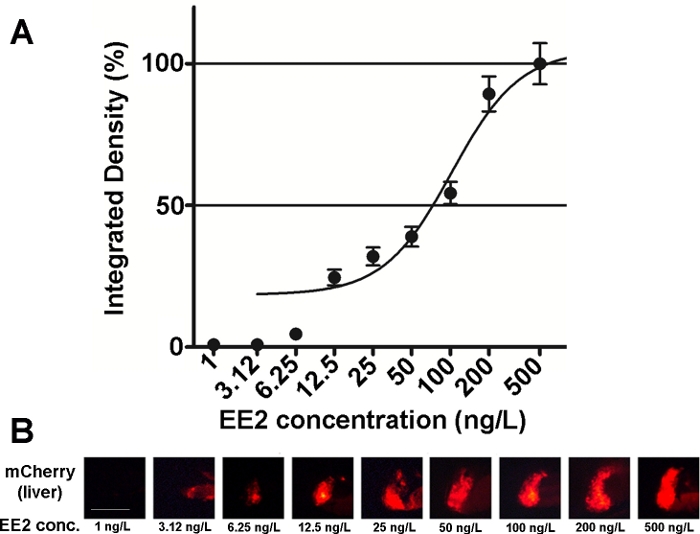
Figure 2 : Diagramme dose-réponse (A) et images fluorescentes (mCherry) du foie (B) exposés au 17-α-ethynilestradiol (EE2), dans 5 larves de dpf vtg1:mCherry. Les résultats sont exprimés sous forme de densité intégrée générée par la force du signal et la taille de la zone touchée (±SEM, n = 60). 100% se réfère au maximum observé. L’intensité du signal fluorescent a augmenté progressivement avec la concentration. Barre d’échelle = 250 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Il existe plusieurs substances œstrogéniques dans l’environnement, comme 17-β-estradiol (concentration environnementale : 0,1–5,1 ng/L)21, 17-α-éthylestradiol (concentration environnementale : 0,16–0,2 μg/L)22, zéaralenone (concentration environnementale : 0,095–0,22 μg/L)23, bisphénol-A (concentration environnementale : 0,45–17,2 mg/L)24. Lors de l’essai de ces substances sous une forme purement active à l’aide d’embryons transgéniques mCherry, les concentrations d’effet les plus faibles observées (LOEC) pour la détection des signes fluorescents étaient de 100 ng/L pour 17-ß-estradiol, 1 ng/L pour 17-α-ethynilestradiol, 100 ng/L pour la zéaralenone, et 1 mg/L pour le bisphénol-A (traitement 96–120 hpf), qui est très proche ou dans la gamme des concentrations environnementales des substances15. La ligne transgénique Tg(vtg1:mCherry) peut aider à détecter l’œstoïscité dans les échantillons d’eaux usées après une exposition directe. La ligne est aussi sensible que le test d’oestrogène de levure couramment utilisé, l’oestrogène de levure bioluminscente (BLYES) essai15. À l’aide de cette ligne, les effets protecteurs des bêta-cyclodextrines contre la toxicité induite par la zéaralénone ont été confirmés à l’aide de mélanges chimiques20.
Dans un rapport récent, l’utilisation in vivo de la lignée transgénique a été démontrée à l’aide de deux métabolites œstrogéniques de zéaralenone (ZEA), α- et β-zearalénol (α-ZOL et β-ZOL)25. La base de référence du protocole est appropriée pour étudier les effets œstrogéniques de plusieurs composés ou échantillons environnementaux sur les embryons de Tg(vtg1:mCherry).
Protocol
Representative Results
Discussion
L’utilisation de biomonitors/bioindicateurs pour les effets œstrogéniques s’est répandue dans des études toxicologiques. Les modèles in vivo jouent un rôle remarquable, car contrairement aux tests in vitro, ils fournissent non seulement des informations sur la réponse d’une cellule ou d’un récepteur, mais permettent également l’étude de processus complexes dans l’organisme. Plusieurs lignes transgéniques pour l’étude des effets œstrogéniques ont été produites à partir de poissons zèbres, d…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ces travaux ont été appuyés par le Bureau national de la recherche, du développement et de l’innovation (NKFIH) du Fonds national de recherche, de développement et d’innovation (NKFIA); Accord de subvention : NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 projet cofinancé par l’Union européenne, et le Programme d’excellence thématique NKFIH-831-10/2019 de Szent István University, décerné par le ministère de l’Innovation et de la Technologie.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

