एंडोक्राइन बाधित यौगिकों के एस्ट्रोजेनिक प्रभावों का परीक्षण करने के लिए टीजी (Vtg1:mcherry) ज़ेब्राफ़िश भ्रूण का उपयोग करना
Summary
यहां मौजूद एस्ट्रोजेनिक प्रभावों का पता लगाने के लिए जेब्राफिश भ्रूण टीजी (vtg1: mCherry) के उपयोग के लिए एक विस्तृत प्रोटोकॉल है। प्रोटोकॉल मछली के प्रचार और भ्रूण के उपचार को शामिल किया गया है, और पता लगाने, प्रलेखन पर जोर देती है, और अंतःस्रावी बाधित यौगिकों (EDC) द्वारा प्रेरित फ्लोरोसेंट संकेतों के मूल्यांकन ।
Abstract
पर्यावरण में कई एंडोक्राइन बाधित यौगिक (ईडीसी), विशेष रूप से एस्ट्रोजेनिक पदार्थ हैं। इन पदार्थों का पता लगाना उनकी रासायनिक विविधता के कारण मुश्किल है; इसलिए, तेजी से अधिक प्रभाव का पता लगाने के तरीकों का उपयोग किया जाता है, जैसे एस्ट्रोजेनिक प्रभाव-संवेदनशील बायोमॉनिटर/बायोइंडिकेटर जीव। इन बायोमॉनिटरिंग जीवों में कई फिश मॉडल शामिल हैं। इस प्रोटोकॉल में एक बायोमॉनिटरिंग जीव के रूप में जेब्राफिश टीजी (vtg1: mCherry) ट्रांसजेनिक लाइन के उपयोग को शामिल किया गया है, जिसमें मछली के प्रचार और भ्रूण के उपचार शामिल हैं, जिसमें ईडीसी द्वारा प्रेरित फ्लोरोसेंट संकेतों का पता लगाने, प्रलेखन और मूल्यांकन पर जोर दिया गया है। काम का लक्ष्य एस्ट्रोजेनिक प्रभावों का पता लगाने के लिए टीजी (वीटीजी1: एमचेरी) ट्रांसजेनिक लाइन भ्रूण के उपयोग का प्रदर्शन है। यह काम दो एस्ट्रोजेनिक पदार्थों, α-और α-zearalenol का परीक्षण करके एस्ट्रोजेनिक प्रभावों का पता लगाने के लिए ट्रांसजेनिक जेब्राफिश भ्रूण टीजी (vtg1: mCherry) के उपयोग को दस्तावेज करता है। वर्णित प्रोटोकॉल केवल परख डिजाइन करने का आधार है; परीक्षण विधि परीक्षण अंत बिंदुओं और नमूनों के अनुसार भिन्न हो सकती है। इसके अलावा, इसे अन्य परख विधियों के साथ जोड़ा जा सकता है, जिससे ट्रांसजेनिक लाइन के भविष्य के उपयोग को सुविधाजनक बनाया जा सकता है।
Introduction
एंडोक्राइन बाधित यौगिकों (ईडीसी) की एक महत्वपूर्ण संख्या है जो हमारे पर्यावरण में सबसे खतरनाक पदार्थों में से हैं। ये मुख्य रूप से एस्ट्रोजेनिक यौगिक हैं जो प्राकृतिक संसाधनों से पानी को दूषित करते हैं। समूह से संबंधित पदार्थों की रासायनिक विविधता उनकी उपस्थिति के लिए परीक्षण को मुश्किल बनाती है, क्योंकि उनका पता लगाने के लिए विभिन्न विश्लेषणात्मक तरीकों की आवश्यकता होती है। उनकी रासायनिक संरचना के आधार पर यह निर्धारित करना बहुत मुश्किल है कि क्या कोई पदार्थ वास्तव में एस्ट्रोजन के रूप में कार्य करने में सक्षम है। इसके अलावा, ये पदार्थ पर्यावरण में शुद्ध रूप में कभी भी मौजूद नहीं होते हैं, इसलिए इनके प्रभाव अन्य यौगिकों से प्रभावित हो सकते हैं, बहुत1। इस समस्या का समाधान प्रभाव-पता लगाने के तरीकों से किया जा सकता है, जैसे कि एस्ट्रोनॉमी प्रभाव दिखाने वाले बायोमॉनिटर/बायोइंडिकेटर जीवों का उपयोग2,,3,,4,,5।
हाल ही में एस्ट्रोजेनिक प्रभावों का पता लगाने के लिए विभिन्न प्रकार के सेल लाइन6 और यीस्ट बेस्ड टेस्ट सिस्टम2,,3 विकसित किए गए हैं। हालांकि, ये आम तौर पर केवल एस्ट्रोजन रिसेप्टर2,3के लिए पदार्थ के बाध्यकारी का पता लगाने में सक्षम हैं । इसके अलावा, वे जीव में जटिल शारीरिक प्रक्रियाओं को मॉडल करने में असमर्थ हैं, या जीवन चरणों के हार्मोन-संवेदनशील चरणों का पता लगाने में असमर्थ हैं; इस प्रकार, वे अक्सर झूठे परिणाम देते हैं।
यह ज्ञात है कि कुछ जीन जीवित जीवों में एस्ट्रोजन के प्रति संवेदनशीलता से प्रतिक्रिया करते हैं7. आणविक जीव विज्ञान विधियों द्वारा जीन उत्पादों का पता लगाना प्रोटीन या एमआरएनए स्तर8,,9पर भी संभव है, लेकिन आमतौर पर पशु बलि शामिल है। पशु संरक्षण कानून सख्त हो गए हैं, और वैकल्पिक परीक्षण प्रणालियों की मांग बढ़ रही है जो प्रयोगों में उपयोग किए जाने वाले जानवरों की संख्या और पीड़ा को कम करती है या किसी अन्य मॉडल प्रणाली10के साथ पशु मॉडल के प्रतिस्थापन को कम करती है। फ्लोरोसेंट प्रोटीन की खोज और बायोमार्कर लाइनों के निर्माण के साथ, ट्रांसजेनिक प्रौद्योगिकियां एक अच्छा विकल्प प्रदान करती हैं11। इन रेखाओं के साथ, एक एस्ट्रोजन के प्रति संवेदनशील जीन की सक्रियता का परीक्षण वीवो में किया जा सकता है।
कशेरुकी के बीच, पर्यावरण जोखिम आकलन में मछली की क्षमता बकाया है । वे स्तनधारी मॉडलों पर कई फायदे प्रदान करते हैं: जलीय जीव होने के नाते, वे अपने पूरे शरीर के माध्यम से प्रदूषकों को अवशोषित करने में सक्षम होते हैं, बड़ी संख्या में संतान पैदा करते हैं, और उनकी कुछ प्रजातियों को कम पीढ़ी के समय की विशेषता होती है। उनकी अंतःस्रावी प्रणाली और शारीरिक प्रक्रियाएं अन्य कशेरुकी और यहां तक कि स्तनधारियों के साथ भी बहुत समानताएं दिखाती हैं, जिनमें मनुष्य12शामिल हैं।
मछली में एस्ट्रोजेनिक प्रभावों का पता लगाने के लिए कई जीन भी जाने जाते हैं। सबसे महत्वपूर्ण एस्ट्रोजन रिसेप्टर्स अरोमाटेस-बी, कोरियोजेनिन-एच, और विटेलेजेनिन (वीटीजी)7,,13हैं। हाल ही में प्रयोगशाला में इस्तेमाल होने वाले मछली के मॉडलों से कई एस्ट्रोजन उत्पादक बायोसेंसर लाइनें भी बनाई गई हैं, जैसे,जेब्राफिश(दानियो रेरियो)4, 5,,,14, 15,,516,,17से ।17 बायोसेंसर लाइनें बनाने में जेब्राफिश का मुख्य लाभ भ्रूण और लार्वा का पारदर्शी शरीर है, क्योंकि फ्लोरोसेंट रिपोर्टर सिग्नल को जानवर10का त्याग किए बिना वीवो में आसानी से अध्ययन किया जा सकता है। पशु संरक्षण के अलावा, यह भी एक मूल्यवान विशेषता है क्योंकि यह उपचार18के विभिन्न समयों पर एक ही व्यक्ति की प्रतिक्रिया का अध्ययन करने की अनुमति देता है।
इन प्रयोगों में एक विटेलेजेनिन रिपोर्टर ट्रांसजेनिक जेब्राफिश लाइन15का उपयोग किया जाता है । टीजी (वीटीजी1:एमएचरी) के विकास के लिए उपयोग किए जाने वाले ट्रांसजीन निर्माण में एक लंबा (3.4 केबीपी) प्राकृतिक विटेलोजेनिन-1 प्रमोटर है। एस्ट्रोजन रिसेप्टर (ईआर) लिगांड द्वारा सक्रिय एक एन्हांसर प्रोटीन है जो स्टेरॉयड/न्यूक्लियर रिसेप्टर सुपरफैमिली का प्रतिनिधि है । ईआर विशिष्ट डीएनए दृश्यों को बांधता है जिसे एस्ट्रोजन प्रतिक्रिया तत्व (ईआरई) कहा जाता है, जिसमें उच्च आत्मीयता होती है और एस्ट्रोडिओल और अन्य एस्ट्रोजेनिक पदार्थों के जवाब में जीन अभिव्यक्ति को स्थानांतरित करता है, इसलिए प्रमोटर में अधिक ईई एक मजबूत प्रतिक्रिया19का कारण बनता है। टीजी (vtg1:mCherry) ट्रांसजीन निर्माण के प्रमोटर क्षेत्र में 17 ERE साइटें हैं और उन्हें देशी वीटीजी जीन15की अभिव्यक्ति की नकल करने की उम्मीद है। यौन परिपक्व महिलाओं में फ्लोरोसेंट संकेत की निरंतर अभिव्यक्ति है। हालांकि, पुरुषों और भ्रूण में जिगर में अभिव्यक्ति केवल एस्ट्रोजेनिक पदार्थों(चित्रा 1)के साथ उपचार पर दिखाई देती है।
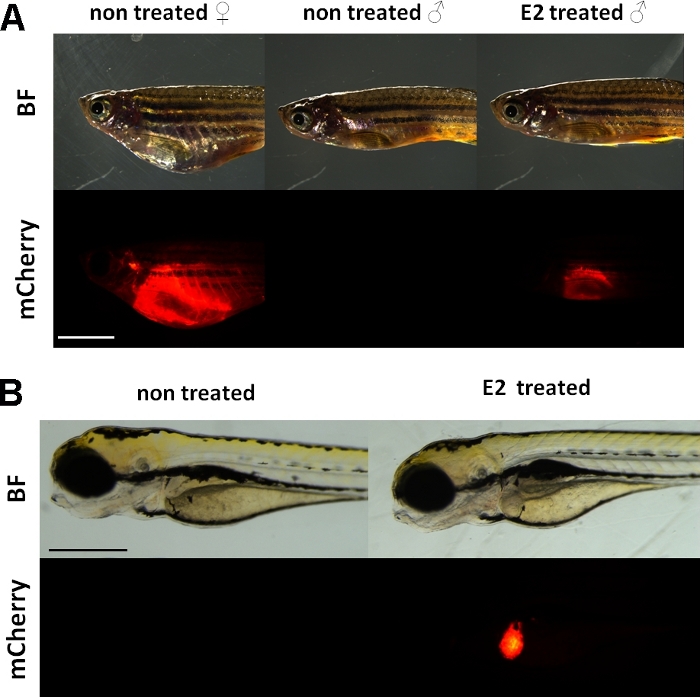
चित्रा 1: vtg1 के जिगर में लाल फ्लोरोसेंट संकेत: mCherry ट्रांसजेनिक वयस्क ज़ेब्राफिश और 5 डीपीएफ भ्रूण, 17-ß-estradiol (E2) प्रेरण के बाद । महिला में और पुरुष में E2 के साथ इलाज (25 μg/L जोखिम समय: 48hrs) जिगर की मजबूत फ्लोरेसेंस भी वर्णक त्वचा के माध्यम से दिखाई देता है । अनुपचारित पुरुष(ए)में कोई फ्लोरोसेंट सिग्नल दिखाई नहीं देता है। E2 प्रेरण के बाद (50 μg/L जोखिम समय: 0-120 hpf), 5 डीपीएफ भ्रूण के जिगर में एक लाल फ्लोरोसेंट संकेत भी देखा जा सकता है, जो नियंत्रण भ्रूण(बी)में दिखाई नहीं देता है । जबकि फ्लोरोसेंट सिग्नल वयस्क महिलाओं में लगातार मौजूद है, मुख्य रूप से पुरुषों और लाइन के भ्रूण एस्ट्रोजेनिक प्रभाव का पता लगाने के लिए उपयुक्त हैं। (BF: उज्ज्वल क्षेत्र, mCherry: लाल फ्लोरोसेंट फिल्टर व्यू, एकल सादे छवियां, स्केल बार ए: 5 मिमी, स्केल बार बी: 250 माइक्रोन) कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
अंतर्जात विटेलोजिन के समान, रीचेरी रिपोर्टर केवल जिगर में व्यक्त किया जाता है। क्योंकि विटेलोजिन केवल एस्ट्रोजन की उपस्थिति में उत्पादित होता है, इसलिए नियंत्रणों में कोई फ्लोरोसेंट संकेत नहीं होता है। क्योंकि अभिव्यक्ति केवल जिगर में है, परिणामों का मूल्यांकन बहुत आसान है15।
इस लाइन के भ्रूणों की संवेदनशीलता और उपयोगिता की जांच विभिन्न एस्ट्रोजेनिक यौगिक मिश्रणों और पर्यावरणीय नमूनों15,,20पर भी की गई है और ज्यादातर मामलों में खुराक-प्रतिक्रिया संबंधों को प्रलेखित किया गया था(चित्रा 2)। हालांकि, अत्यधिक विषाक्त के मामले में, मुख्य रूप से हेपेटोटॉक्सिक, पदार्थ (उदाहरण के लिए, ज़ेरालेनोन), केवल एक बहुत कमजोर फ्लोरोसेंट संकेत इलाज भ्रूण के जिगर में दिखाई दे सकता है और अधिकतम तीव्रता फ्लोरोसेंट सिग्नल का कारण एक बहुत छोटी एकाग्रता सीमा के भीतर पहुंचा जा सकता है, जिससे खुराक-प्रभाव संबंधों को स्थापित करना मुश्किल हो जाता है20।
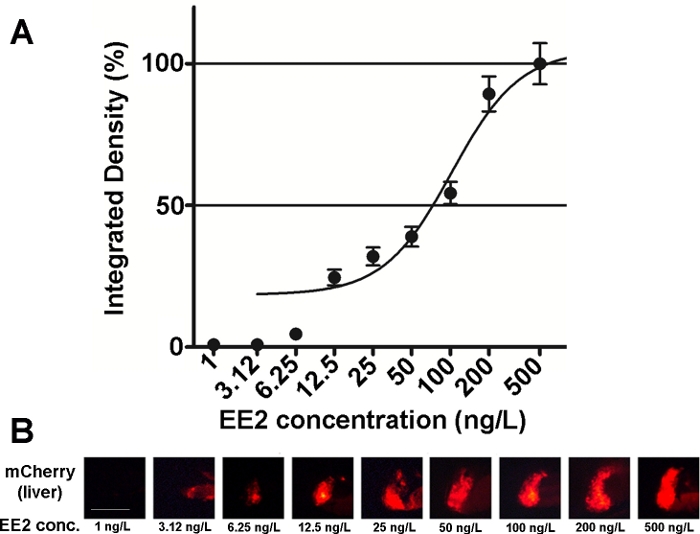
चित्रा 2: 5 डीपीएफ vtg1:mCherry लार्वा में 17-α-ethynilestradiol (EE2) के संपर्क में जिगर (बी) की खुराक-प्रतिक्रिया आरेख (ए) और फ्लोरोसेंट छवियां (mCherry) । परिणाम संकेत शक्ति और प्रभावित क्षेत्र के आकार (± SEM, n = 60) से उत्पन्न एकीकृत घनत्व के रूप में व्यक्त किए जाते हैं। 100% मनाया अधिकतम करने के लिए संदर्भित करता है। फ्लोरोसेंट सिग्नल तीव्रता एकाग्रता के साथ धीरे-धीरे बढ़ गई। स्केल बार = 250 माइक्रोन. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
पर्यावरण में कई एस्ट्रोजेनिक पदार्थ मौजूद हैं, जैसे 17-1-एस्ट्रेडिओल (पर्यावरण एकाग्रता: 0.1-5.1 एनजी/एल)21,17-α-α-ethynylestradiol (पर्यावरण एकाग्रता: 0.16-0.2 μg /L)22,zearalenone (पर्यावरण एकाग्रता: 0.095-0.22 μg/L)23,बिस्फेनोल-ए (पर्यावरण एकाग्रता: 0.45-17.2 मिलीग्राम/एल)24। रीचेरी ट्रांसजेनिक भ्रूण की मदद से शुद्ध सक्रिय रूप में इन पदार्थों का परीक्षण करते समय, फ्लोरोसेंट साइन डिटेक्शन के लिए सबसे कम मनाया गया प्रभाव सांद्रता (एलईसी) 17-ß-estradiol के लिए 100 एनजी/एल थे, 1 एनजी/एल के लिए 17-α-ethynilestradiol, १०० एनजी/Zearalenone के लिए एल, और बिस्फेनोल के लिए 1 मिलीग्राम/एल-ए (96-120 hpf उपचार), जो बहुत करीब है या पदार्थों की पर्यावरणीय सांद्रता की सीमा के भीतर15। टीजी (vtg1:mCherry) ट्रांसजेनिक लाइन सीधे जोखिम के बाद अपशिष्ट जल के नमूनों में एस्ट्रोजेनिकता का पता लगाने में मदद कर सकती है। लाइन आमतौर पर इस्तेमाल खमीर एस्ट्रोजन परीक्षण, बायोलुमिनिसेंट खमीर एस्ट्रोजन (BLYES) परख15के रूप में के रूप में संवेदनशील है । इस लाइन की मदद से, जेरालेनोन-प्रेरित विषाक्तता के खिलाफ बीटा-साइक्लोडेक्स्ट्रिन के सुरक्षात्मक प्रभावों की पुष्टि रासायनिक मिश्रण20का उपयोग करके की गई है।
हाल ही में एक रिपोर्ट में, ट्रांसजेनिक लाइन के वीवो उपयोग में दो एस्ट्रोजेनिक ज़ेरालेनोन (ZEA) मेटाबोलाइट्स, α-और α-ZOL (α-ZOL और α-ZOL)25की मदद से प्रदर्शन किया गया था । प्रोटोकॉल बेसलाइन टीजी (vtg1:mCherry) भ्रूण पर कई यौगिकों या पर्यावरण के नमूनों के एस्ट्रोजेनिक प्रभावों का अध्ययन करने के लिए उपयुक्त है।
Protocol
Representative Results
Discussion
एस्ट्रोजेनिक प्रभावों के लिए बायोमॉनिटर/बायोइंडिटेटर का उपयोग विष विज्ञानीय अध्ययनों में फैल रहा है। वीवो मॉडल में एक उत्कृष्ट भूमिका निभाते हैं, क्योंकि इन विट्रो परीक्षणों के विपरीत, वे न केवल कोश…
Divulgations
The authors have nothing to disclose.
Acknowledgements
इस काम को राष्ट्रीय अनुसंधान, विकास और नवाचार कोष (एनकेएफआईएच) से राष्ट्रीय अनुसंधान, विकास और नवाचार कार्यालय (एनकेएफआईएच) द्वारा समर्थित किया गया था; अनुदान समझौता: NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 परियोजना सह यूरोपीय संघ द्वारा वित्त पोषित, और विषयगत उत्कृष्टता कार्यक्रम NKFIH-831-10/2019 S Szent István विश्वविद्यालय मंत्रालय, नवाचार और प्रौद्योगिकी के लिए संमानित किया ।
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

