Tg(Vtg1:mcherry)ゼブラフィッシュ胚を用いて内分泌破壊化合物のエストロゲン効果を試験する
Summary
ここに、エストロゲンの効果を検出するためのゼブラフィッシュ胚Tg(vtg1:mCherry)を使用するための詳細なプロトコルが存在する。このプロトコルは、魚の伝播と胚の治療をカバーし、内分泌破壊化合物(EDC)によって誘導される蛍光シグナルの検出、ドキュメンテーション、および評価を強調しています。
Abstract
環境中に多くの内分泌破壊化合物 (EDC) があります, 特にエストロゲン物質.これらの物質の検出は、その化学的多様性のために困難です。したがって、エストロゲン効果感受性バイオモニター/バイオ指標生物など、ますます効果検出方法が使用されています。これらの生物モニタリング生物には、いくつかの魚のモデルが含まれる。このプロトコルは、魚の伝播や胚の治療を含むバイオモニタリング生物としてのゼブラフィッシュTg(vtg1:mCherry)トランスジェニックラインの使用をカバーし、EDCによって誘導される蛍光シグナルの検出、文書化、評価に重点を置いています。この研究の目的は、Tg(vtg1: mCherry)トランスジェニックライン胚を使ってエストロゲンの効果を検出する方法を実証することです。この研究は、α-およびβ-ゼアラレノールの2つのエストロゲン物質を試験することによってエストロゲンの効果を検出するためのトランスジェラフィッシュ胚Tg(vtg1:mCherry)の使用を文書化した。記述されたプロトコルはアッセイを設計するための唯一の基礎である;テストメソッドは、テストエンドポイントとサンプルに応じて変更できます。また、他のアッセイ法と組み合わせることが可能であり、トランスジェニックラインの将来の利用を促進する。
Introduction
私たちの環境で最も危険な物質の一つである内分泌破壊化合物(EDC)のかなりの数があります。これらは主に天然資源から水を汚染するエストロゲン性化合物です。グループに属する物質の化学的多様性は、異なる分析方法が検出に必要なため、その存在のテストを困難にします。その化学構造に基づいて、物質が実際にエストロゲンとして機能できるかどうかを判断することは非常に困難です。また、これらの物質は環境中で純粋な形で存在することはないので、その効果は他の化合物によって影響を受ける可能性があります。この問題は、エストロゲンの,効果,22、3、4、53を示すバイオモニター/バイオ指標生物の使用などの効果検出方法によって解決することができる。45
近年、エストロゲンの効果を検出するために、種々の細胞株6および酵母ベースの試験システム2,33が開発されている。2しかしながら、これらは一般に、エストロゲン受容体22,33への物質の結合を検出することしかできない。さらに、生物の複雑な生理学的プロセスをモデル化したり、生命段階のホルモン感受性相を検出したりすることができない。したがって、誤った結果につながることがよくあります。
特定の遺伝子が生物のエストロゲンに敏感に反応することが知られている7.分子生物学法による遺伝子産物の検出は、タンパク質またはmRNAレベル88、99でも可能であるが、通常は動物の犠牲を伴う。動物保護法は厳しくなり、実験や動物モデルを別のモデルシステム10に置換する動物の数と苦しみを最小限に抑える代替試験システムの需要が高まっている。蛍光タンパク質の発見とバイオマーカーラインの作成により、トランスジェニック技術は良い代替11を提供します。これらのラインを使用すると、エストロゲン感受性遺伝子の活性化を生体内で試験することができる。
脊椎動物の中でも、環境リスク評価における魚の可能性は顕著である。彼らは哺乳類モデルよりも多くの利点を提供する:水生生物であること、彼らは全身を通して汚染物質を吸収することができ、多数の子孫を生み出し、その種のいくつかは短い生成時間によって特徴付けられる。彼らの内分泌系および生理学的プロセスは、他の脊椎動物、さらにはヒト12を含む哺乳類との間に大きな類似点を示す。
魚のエストロゲンの効果を検出するためのいくつかの遺伝子も知られています。.最も重要なのは、アロマターゼb、絨毛ゲニン-H、およびヴィテロゲニン(vtg)7、13のエストロゲン受容体である7,13。最近では、ゼブラフィッシュ,,,,(Daniorerio)4、5、14、15、16、17など、実験室で使用される魚4,5のモデルから、いくつかのエストロゲン産生バイオセンサーラインも作成されています。14151617バイオセンサーラインを作る際のゼブラフィッシュの主な利点は、胚および幼虫の透明体であり、その後、蛍光レポーターシグナルは動物10を犠牲にすることなく生体内で容易に研究することができるからである。動物保護に加えて、治療18の異なる時間に同じ個体の反応を研究することができるので貴重な特徴でもある。
これらの実験は、ビテロゲニンレポータートランスジェニックゼブラフィッシュライン15を使用する。Tg(vtg1:mCherry)の開発に使用されるトランスジーン構造は、長い(3.4 kbp)天然のビテロゲニン-1プロモーターを有する。エストロゲン受容体 (ER) ステロイド/核受容体スーパーファミリーの代表であるリガンドによって活性化されるエンハンサータンパク質です。.ERは、エストラジオールや他のエストロゲン由来物質に応答して遺伝子発現をトランスアクティブ化する高親和性を有するエストロゲン応答元素(ERE)と呼ばれる特定のDNA配列に結合し、プロモーター内のEREが多いほど強い応答を引き起こす19。Tg(vtg1:mCherry)トランスジーン構築物のプロモーター領域には17のERE部位があり、それらは天然vtg遺伝子15の発現を模倣することが期待されている。性的に成熟した女性の蛍光シグナルの連続的な発現がある。しかし、男性や胚では、肝臓での発現はエストロゲン物質による治療時にのみ見える(図1)。
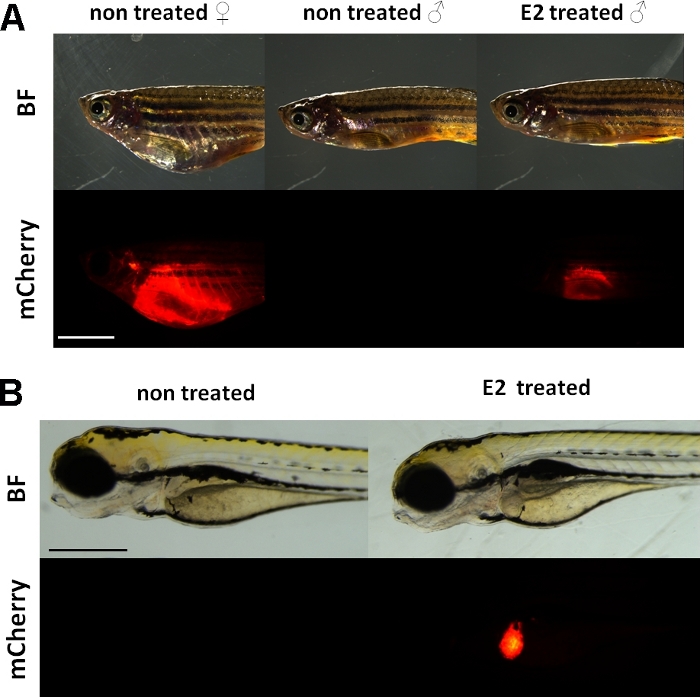
図1:17-ß-エストラジオール(E2)誘導に続くvtg1:mCherryトランスジェニック成ゼブラフィッシュおよび5 dpf胚の肝臓における赤色蛍光シグナル。E2(25μg/L暴露時間:48時間)で治療された女性および男性では、色素な皮膚を通しても肝臓の強い蛍光が見える。未処理の男性(A)では蛍光シグナルは見えません。E2誘導(50μg/L露光時間:0-120hpf)に続いて、5dpf胚の肝臓における赤色蛍光シグナルも観察され、対照胚(B)では見えない。蛍光シグナルは成人女性に継続的に存在するが、主に男性および胚の系統はエストロゲンの効果を検出するのに適している。(BF:明視野、mCherry:赤色蛍光フィルタビュー、単一平野画像、スケールバーA:5mm、スケールバーB:250μm)この図の大きなバージョンを表示するには、ここをクリックしてください。
内因性ビテロゲニンと同様に、mCherryレポーターは肝臓でのみ発現される。ビテロゲニンはエストロゲンの存在下でのみ産生されるため、コントロール内に蛍光シグナルはありません。発現は肝臓のみであるため、結果の評価は15がはるかに簡単である。
このラインの胚の感受性と使いやすさは、様々なエストロゲン性化合物混合物および環境サンプル15、20、そしてほとんどの場合15,、用量応答関係が文書化された(図2)。しかしながら、毒性が高い場合、主に肝毒性、物質(例えば、ゼアラレノン)は、治療された胚の肝臓に極めて弱い蛍光シグナルしか見えないし、極めて小さな濃度範囲内で蛍光シグナルが生じる極めて弱い蛍光シグナルに達することができ、これは用量効果関係を確立することが困難となる20。
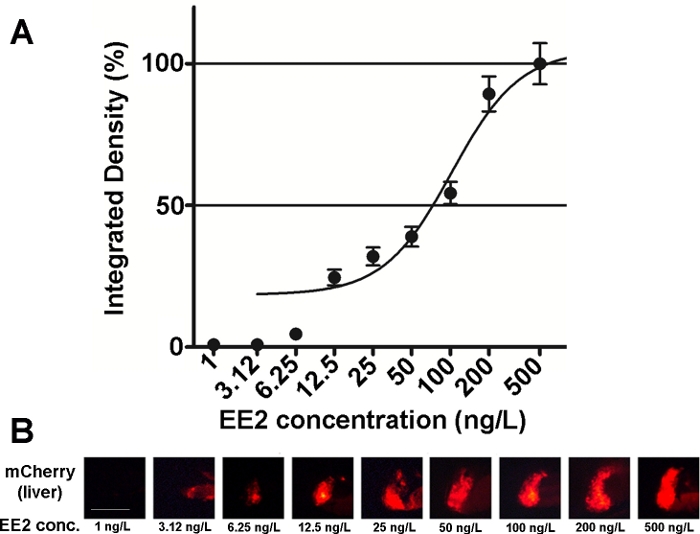
図2:肝臓(B)の用量応答図(A)および蛍光画像(mCherry)を17-α-エチニルエストラジオール(EE2)に曝露し、5dpf vtg1:mCherry幼虫で示した。結果は、信号強度と患部のサイズ(±SEM、n = 60)から生成された一体型密度として表されます。100%は、観察された最大値を指す。蛍光シグナル強度は濃度とともに徐々に増加した。スケールバー= 250 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。
環境内に存在するエストロゲン物質がいくつか存在し、 17-β-エストラジオール(環境濃度:0.1-5.1 ng/L)21、17-α-エチニルエストラジオール(環境濃度:0.16~0.2 μg/L)22,ゼアラレノン (環境濃度: 0.095-0.22 μg/L)23, ビスフェノール-A (環境濃度: 0.45–17.2 mg/L)24.21mCherryトランスジェニック胚の助けを借りて純粋な活性形態でこれらの物質をテストするとき、 蛍光サイン検出のための最も低い観察効果濃度(LOEC)は、17-エストラジオールで100ng/L、17-α-エチニルエストラジオールの場合は1ng/L、ゼアラレノンの場合は100 ng/L、ビスフェノールA(96-120 hpf)の場合は1mg/Lであった。Tg(vtg1:mCherry)トランスジェニックラインは、直接暴露後の排水サンプル中のエストロゲン性を検出するのに役立ちます。このラインは、一般的に使用される酵母エストロゲン試験と同じくらい敏感であり、生物発光酵母エストロゲン(BLYES)アッセイ15.このラインの助けを借りて、ゼアラレニン誘導毒性に対するβ-シクロデキストリンの保護効果が、化学混合物20を用いて確認されている。
最近の報告では、トランスジェニックラインのin vivo使用が2つのエストロゲンゼアラレノン(ZEA)代謝産物、α-およびβ-ゼアラレノール(α-ZOLおよびβ-ZOL)25の助けを借りて実証された25。プロトコルベースラインは、Tg(vtg1:mCherry)胚に対するいくつかの化合物または環境サンプルのエストロゲンの影響を研究するのに適している。
Protocol
Representative Results
Discussion
エストロゲンの効果のためのバイオモニター/バイオ指標の使用は、毒物学的研究で広がっています。.生体内モデルは、インビトロ検査とは異なり、細胞または受容体の応答に関する情報を提供するだけでなく、生物の複雑なプロセスの調査を可能にするため、顕著な役割を果たす。エストロゲンの効果を研究するためのいくつかのトランスジェニックラインはゼブラフィッシュから作製さ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
この研究は、国立研究開発・イノベーション基金(NKFIA)の国立研究開発・イノベーション事務所(NKFIH)によって支援されました。助成金契約:NVKP_16-1-2016-0003、EFOP-3.6.3-VEKOP-16-2017-00008欧州連合(EU)が共同出資するプロジェクト、およびツェント・イストバン大学のテーマ・エクセレンス・プログラムNKFIH-831-10/2019、イノベーション・テクノロジー省から授与されました。
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

